气相色谱-质谱法结合QuEChERS方法和分散液液微萃取技术测定茭白中三唑类农药残留
2018-01-19,,,,,,
, , , , , ,
(浙江工业大学 化学工程学院, 杭州 310014)
茭白是生长于浅水的多年水生草本植物,是我国特有水生蔬菜之一,含有多种丰富的营养物质,如糖类、蛋白质、脂肪、氨基酸,以丰富的营养价值而被誉为“水中参”,质地鲜嫩,味甘实,被视为蔬菜中的佳品。近年来,茭白产业发展非常迅速。三唑类农药是一种新型的杀菌剂,不仅具有内吸杀菌活性,还具有调节植物生长的作用,在蔬菜、水果中应用广泛[1];同时三唑类农药也是防治茭白锈病、胡麻叶斑病和灰心斑病的常用农药[2-4]。但部分农户对农药的合理使用观念相对缺乏,农药乱用和滥用情况较为严重,除了直接使用农药之外,茭白等水生蔬菜易从土壤和水体环境中吸收污染物并富集[5]。因此,建立简单快速地测定茭白中三唑类农药残留的分析方法具有重要意义。
目前,关于蔬菜和水果中三唑类农药残留的分析检测已有较多的报道[6-11],然而关于茭白的文献大多涉及生物特性领域[12-14],农药残留方向报道的文献较少,主要有酶速测方法[15]和固相萃取法(SPME)[16]。本工作采用QuEChERS(quick,easy,cheap,effective,rugged and safe)法结合基于巴斯德吸管的分散液液微萃取技术(DLLME)对茭白中的腈菌唑、戊唑醇和苯醚甲环唑等3种三唑类农药进行萃取浓缩,并进行气相色谱-质谱法(GC-MS)分析。
1 试验部分
1.1 仪器与试剂
GC 2000-Mars 6100型气相色谱-质谱联用仪;AL 204型电子分析天平;SY-360型超声波清洗器;Vortex Genius 3型涡旋混匀器;5 mL巴斯德吸管。
腈菌唑纯度不小于97%,戊唑醇纯度不小于96.5%,氟环唑纯度不小于97%,苯醚甲环唑纯度不小于96%;甲苯、正己烷、环己烷、乙腈、氯化钠、硫酸钠和无水硫酸镁为分析纯;试验用水为超纯水。
1.2 仪器工作条件
1) 色谱条件 DB-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);载气为氦气(纯度99.999%),流量1.0 mL·min-1;进样口温度280 ℃;不分流进样,进样量1.0 μL,0.75 min后以20 mL·min-1进行载气吹扫。升温程序:起始温度180 ℃,保持1 min;然后以5 ℃·min-1速率升温至200 ℃,保持1 min;之后以2 ℃·min-1速率升温至220 ℃;最后以10 ℃·min-1速率升至290 ℃,保持6 min。
2) 质谱条件 电子轰击(EI)离子源;电子能量70 eV;离子阱温度180 ℃;歧管温度为50 ℃;传输线温度250 ℃;扫描速率3 scans·s-1;溶剂延迟3 min。采用选择离子监测(SIM)模式,各化合物的质谱参数见表1,*为内标。
缼齿蓑藓106份样本的13个形态性状见附表。106份样本6个数量性状的变异情况见表3。从表3可看出,缺齿蓑藓6个数量性状在不同的样本间存在一定的变异,变异程度在18.01% ~ 24.02%。6个数量性状的变异系数从大到小依次为:下部细胞长宽比、叶上部长宽比、叶长、叶下部长宽比、叶中部长宽比和中肋粗细。
1.3 试验方法
将茭白样品擦洗干净,取可食用部分切成小块,置于榨汁机中匀浆,匀浆好的样品存储于4 ℃的冰箱中。

表1 质谱参数Tab. 1 MS parameters
QuEChERS净化步骤:称取匀浆好的茭白样品3.000 g于带盖的离心管中,加入内标物氟环唑(在茭白中的质量比为100 μg·kg-1),加入乙腈3 mL,超声提取1 min;随后加入无水硫酸镁0.8 g和氯化钠0.5 g,涡旋30 s后,于5 000 r·min-1转速下离心3 min;接着取出上层乙腈层,转移至事先装有30 mgN-丙基乙二胺(PSA)和30 mg C18的离心管中,继续涡旋30 s后,于5 000 r·min-1转速下离心3 min。
DLLME步骤:移取QuEChERS净化后的上层乙腈萃取物800 μL于改造过的4.5 mL巴斯德吸管中,加入甲苯30 μL,混合均匀,快速注入水2.5 mL,在水浴中超声辅助萃取45 s后形成乳浊液,然后在5 000 r·min-1转速下离心3 min;离心结束后轻轻挤压巴斯德吸管使上层甲苯相进入窄口径处,用微量进样针抽取上层甲苯相(12±1) μL至0.5 mL聚合酶链式反应薄壁管(PCR)中,加入少量无水硫酸钠除去有机相中微量水分,抽取1 μL注入GC-MS中分析检测。
2 结果与讨论
2.1 色谱行为
空白茭白样品中加标的总离子流图见图1。
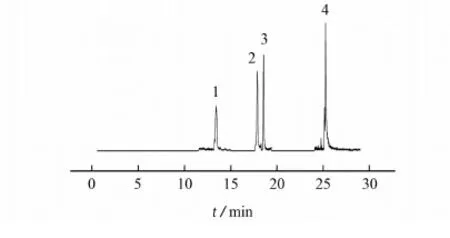
1-腈菌唑;2-戊唑醇;3-氟环唑;4-苯醚甲环唑图1 空白茭白样品加标后的总离子流图Fig. 1 TIC chromatogram of spiked Zizania latifolia sample
2.2 QuEChERS试验条件的选择
2.2.1 提取方式及提取时间
试验选取乙腈作为QuEChERS步骤的萃取溶剂,为使得分析物能快速充分萃取到乙腈中,考察了涡旋辅助提取和超声辅助提取两种方式对试验结果的影响,结果表明在相同提取时间的情况下超声辅助提取效果更好。
一般来说,提取时间越长,提取越充分,但时间过长,会造成提取剂的蒸发损失。试验考察了超声时间分别为0.50,0.75,1.0,2.0,5.0 min时的提取效果,结果见图2。

1-腈菌唑;2-戊唑醇;3-苯醚甲环唑图2 提取时间对提取效果的影响Fig. 2 Effect of extraction time on the extraction efficiency
由图2可知:3种三唑类农药的峰面积随着超声时间增加而增加;当超声时间大于1.0 min时,峰面积基本保持稳定。试验选择提取时间为1.0 min。
2.2.2 吸附剂类型及其用量
试验考察了PSA、C18、PSA-C18混合物等3类吸附剂的净化效果,结果发现:只用PSA净化时,溶液颜色呈现淡黄色;只用C18净化时,杂质响应较高从而降低了目标物的响应。试验选择质量比为1∶1的PSA-C18混合吸附剂。
试验考察了吸附剂的用量对净化效果的影响,见图3。
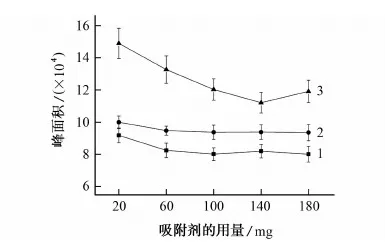
1-腈菌唑;2-戊唑醇;3-苯醚甲环唑图3 吸附剂用量对净化效果的影响Fig. 3 Effect of amount of adsorbents on the purification efficiency
由图3可知:当吸附剂用量为20 mg时,萃取效果较好,但此时溶液颜色呈现淡黄色;而当吸附剂量增加60 mg时,虽然峰面积有所下降,但溶液呈澄清透明;随着吸附剂量的继续增加,溶液颜色皆为澄清透明而峰面积略有下降直至稳定,可能是因为吸附剂对目标物也进行了一定程度的吸附。综合考虑溶液颜色及吸附效果,试验选择30 mg PSA与30 mg C18为吸附剂。
2.3 DLLME试验条件的选择
2.3.1 萃取剂及其用量
萃取剂在DLLME过程中直接影响目标物的萃取效率。试验采用甲苯、环己烷、正己烷等低密度溶剂作为萃取剂进行优化。其中,上述3种萃取剂在收集到相同体积上层有机相(11±1) μL时所用体积分别为40,70,80 μL。综合考虑萃取剂的用量及萃取效率,试验选择甲苯作为萃取剂。
萃取剂使用量少,可获得较高的富集倍数和减少对环境的污染,但同时需确保有足够的上层有机相以便于收集。试验考察了甲苯体积分别为25,30,35,40,45 μL时对萃取结果的影响。结果表明:当甲苯体积为25 μL时,所得到的上层有机相体积较少,不便于收集;当甲苯体积大于30 μL时,峰面积随着甲苯体积的增加而逐渐减小,这是因为随着甲苯体积的增大,稀释作用占主导作用。综合考虑,试验选择甲苯体积为30 μL。
2.3.2 分散剂用量
乙腈萃取物在DLLME过程中作为待测定的提取样品(其中的乙腈又作为DLLME的分散剂),分散剂的用量直接影响“水/乙腈/甲苯乳浊液”体系的形成:如果分散剂的用量少,不能很好地将萃取剂分散,也不能完全形成乳浊液或者乳化不完全;若分散剂的用量过多,则萃取剂在水中的溶解度增加从而使萃取效率降低;同时,分散剂的体积是影响富集倍数及仪器响应的重要参数。试验选取600,800,1 000,1 200,1 400 μL的乙腈萃取物进行考察。结果表明:当乙腈萃取物体积为600 μL时,所得到的上层有机相很少,几乎无法取出;当乙腈萃取物体积大于800 μL时,峰面积随着乙腈萃取物体积的增大而逐渐减小。试验选择乙腈萃取物的体积为800 μL。
2.3.3 萃取时间
超声能加速目标分析物从水相到萃取相的质量传递,同时还能减小萃取剂微滴的尺寸来增加萃取相与水相的接触面积,从而提高萃取效率。超声时间过短,萃取剂没有完全形成细小的颗粒均匀地分散在水相溶液中,乳化作用不充分。超声波的机械作用和热效应会导致萃取剂的挥发损失,有机相的体积会随着超声时间的延长而减小。因此在保证最佳萃取效率的基础上还要考虑上层有机相的体积。试验考察了超声时间分别为15,30,45,60,75 s时的萃取效果,结果表明:开始3种三唑类农药的峰面积随着超声时间增加而有所增加;当超声时间大于45 s时,峰面积随超声时间增加而减小。综合考虑,试验选择超声时间为45 s。
2.3.4 水的体积
试验中水相的作用是除去水溶性高沸点杂质和以分散微萃取的方式富集待测定的目标物,以提高方法的灵敏度。试验选择1.0,1.5,2.0,2.5,2.8 mL水进行试验,结果发现:当水的体积从1.0 mL逐渐增大至2.5 mL时,峰面积呈现逐渐增大的趋势;而当水的体积继续增大时,峰面积有所减小。试验选择水的体积为2.5 mL。
2.4 工作曲线与检出限
分别对腈菌唑、戊唑醇质量比为5.0,10.0,20.0,50.0,100,200,500 μg·kg-1,苯醚甲环唑质量比为12.5,25.0,50.0,125,250,500,1 250 μg·kg-1的空白茭白加标样品,在优化的条件下进行萃取,再进行GC-MS分析,以3种三唑类农药的峰面积与内标物(氟环唑质量比为100 μg·kg-1)峰面积的比值(y)对质量比(x)绘制工作曲线,线性范围、线性回归方程和相关系数见表2。
分别以3倍信噪比和10倍信噪比作为检出限(3S/N)和测定下限(10S/N),结果见表2。

表2 线性参数、检出限和测定下限Tab. 2 Linearity parameters, detection limits and lower limits of determination
2.5 精密度与回收试验
选用空白茭白为基质,加入不同浓度水平的混合标准溶液,使腈菌唑、戊唑醇质量比为20,100,200 μg·kg-1,苯醚甲环唑质量比为50,250,500 μg·kg-1,按试验方法进行前处理后,平行测定5次,计算加标回收率和测定值的相对标准偏差(RSD),结果见表3。

表3 精密度和回收试验结果(n=5)Tab. 3 Results of tests for precision and recovery(n=5)
由表3可知:3种三唑类农药的加标回收率在82.7%~116%之间,RSD在4.1%~15%之间。
2.6 样品分析
从浙江某农场获得8个阳性茭白样品(在茭白种植过程中,定期施用3种三唑类农药后采集到的在不同施药时间下的茭白样品),按试验方法进行测定。8个茭白样品中均检出3种三唑类农药残留,测定结果见表4。结果表明,该方法适用于实际茭白样品的分析检测。
本工作采用QuEChERS-DLLME结合GC-MS分析方法用于测定茭白样品中三唑类农药残留。采用聚乙烯材质的一次性巴斯德吸管为萃取装置,避免了交叉污染;使用密度小于水的甲苯为萃取剂代替传统分散液液微萃取中高毒性的萃取剂,降低了对环境和人体的伤害;将QuEChERS净化方法与DLLME技术结合,既对样品基质进行净化操作,又对目标物进行富集浓缩。该方法重复性良好,检出限低,成功应用于茭白实际样品的检测。

表4 样品中3种三唑类农药的测定结果Tab. 4 Determination results of 3 triazole pesticides in samples μg·kg-1
[1] 周子燕,李昌春,高同春,等.三唑类杀菌剂的研究进展[J].安徽农业科学, 2008,36(27):11842-11844.
[2] 陈建明,丁新天,潘远勇,等.4种杀菌剂对茭白锈病的防治效果[J].浙江农业科学, 2013(11):1463-1465.
[3] 叶琪明,顾国平,李建荣,等.茭白锈病和胡麻斑病的发生规律及其无害化防治[J].浙江农业学报, 2003,15(3):144-148.
[4] 汪爱娟,戴德江,李阿根,等.茭白胡麻斑病药剂防治技术研究[J].中国植保导刊, 2016,36(1):68-70.
[5] 杨兰,杨慧,王富华,等.水生蔬菜中主要污染物风险项目分析研究[J].湖北农业科学, 2013,55(22):5577-5580.
[6] 卢亚玲,贾清华,肖加加,等.固相萃取-气相色谱-质谱法测定果蔬中36种农药[J].理化检验-化学分册, 2015,51(6):828-832.
[7] 程盛华,张利强,魏晓奕,等.固相萃取-在线凝胶渗透色谱-气相色谱-质谱法测定豆芽中53种农药残留量[J].理化检验-化学分册, 2015,51(2):146-152.
[8] 王璐,罗铭,贺泽英,等.液相色谱-串联质谱法测定大蒜中40种农药残留[J].理化检验-化学分册, 2015,51(12):1702-1707.
[9] BORDAGARAY A, GARCIA-ARRONA R, MILLN E. Determination of triazole fungicides in liquid samples using ultrasound-assisted emulsification microextraction with solidification of floating organic droplet followed by high-performance liquid chromatography[J]. Food Analytical Methods, 2014,7(6):1195-1203.
[10] FARAJZADEH M A, SHEYKHIZADEH S, KHORRAM P. Extraction and preconcentration of some triazole pesticides in grape juice by salting out homogeneous liquid-liquid extraction in a narrow-bore tube prior to their determination by gas chromatography-flame ionization detection[J]. Food Analytical Methods, 2014,7(6):1229-1237.
[11] GOLGE O, KABAK B. Determination of 115 pesticide residues in oranges by high-performance liquid chromatography-triple-quadrupole mass spectrometry in combination with QuEChERS method[J]. Journal of Food Composition and Analysis, 2015,41:86-97.
[12] FAN J, SHI M, HUANG J Z, et al. Regulation of photosynthetic performance and antioxidant capacity by (60)Coγ-irradiation in Zizania latifolia plants[J]. Journal of Environmental Radioactivity, 2014,129:33-42.
[13] ZHANG X K, WAN A, WANG H L, et al. The overgrowth of Zizania latifolia in a subtropical floodplain lake: changes in its distribution and possible water level control measures[J]. Ecological Engineering, 2016,89:114-120.
[14] YAN N, WANG X Q, XU X F, et al. Plant growth and photosynthetic performance of Zizania latifolia are altered by endophytic Ustilago esculenta infection[J]. Physiological and Molecular Plant Pathology, 2013,83:75-83.
[15] 刘云霞.茭白中农药残留酶速测法假阳性消除研究[J].农民致富之友, 2013(6):120-120.
[16] 喻磊.固相微萃取在水生蔬菜农药残留分析中的应用研究[D].武汉:华中农业大学, 2014.
