毛蕊花糖苷对抑郁症大鼠行为学和前额叶皮层内质网应激的影响*
2018-01-19邓海峰孙缦利王兴红常全忠
邓海峰, 孙缦利, 陈 浩, 王兴红, 吴 琼, 常全忠
(漯河医学高等专科学校, 河南 漯河 462000)
抑郁症(depression)是一种由多种应激引起的严重的精神疾病,具有发病率高、致残率高、自杀率高和易复发等特征[1]。目前,由于其发病机制复杂,目前尚未完全明确,临床上也没有特异性的治疗方案。近年来,由于社会环境多变和竞争压力的增大,抑郁症患者呈逐年增多的趋势,世界卫生组织预测在2020 年左右抑郁症将成为继高血压之后的第二大临床慢性疾病,严重危害人类生存健康[2]。情绪低落、快感缺失和认知功能障碍是抑郁症患者最突出的特征,因此,及早干预提高情感认知对抑郁症患者的身心恢复具有重要的意义。
毛蕊花糖苷(acteoside)是从肉苁蓉中提取出来的一种苯乙醇苷,是肉苁蓉的主要活性成分之一,具有抗氧化、抗肿瘤和调节免疫等多种药理作用[3]。近年来研究发现,毛蕊花糖苷对中枢神经系统损伤具有有效的保护作用[4-6],但其对抑郁症是否有疗效,目前还未见文献报道。本研究旨在通过慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)结合孤养的方式建立抑郁症大鼠模型,探讨毛蕊花糖苷对抑郁症大鼠行为学影响及可能机制,以期为临床上预防或治疗抑郁症提供实验依据。
材 料 和 方 法
1 动物
健康雄性Sprague-Dawley (SD)大鼠108只,清洁级,体重200~220 g,购于湖南斯莱克景达实验动物有限公司,动物合格证编号为SCXK(湘)2011-0003,动物自由觅食、饮水,在自然光暗周期的环境中饲养。
2 实验仪器及试剂
DYCY-24DN型双垂直电泳槽、DYCP-40E型转印槽和DYY-7C型电泳仪均购自北京市六一仪器厂;ChemiDocTMXRS+凝胶成像系统购自Bio-Rad;S11/12紫外可见分光光度计购自Biochrom。毛蕊花糖苷购自南京景竹生物科技有限公司;氟西汀(fluoxetine)购自礼来苏州制药有限公司;兔抗鼠葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)多克隆抗体和兔抗鼠C/EBP同源蛋白(C/EBP homologous protein,CHOP)多克隆抗体均购自Abcam;FITC标记山羊抗兔IgG购自碧云天生物技术公司;Aβ25-35和戊巴比妥钠均购自Sigma;caspase-3活性检测试盒购自南京建成生物工程研究所。
3 主要方法
3.1动物分组 动物适应性饲养1周后开始实验。将大鼠随机分为6组,每组18只:对照组、模型组、氟西汀组和毛蕊花糖苷低、中、高剂量组。
3.2抑郁症模型的建立 采用CUMS结合孤养的方式制备抑郁模型。应激包括昼夜颠倒24 h、禁食 24 h、禁水 24 h、夹尾 2 min、潮湿垫料 24 h、4 ℃冰水游泳5 min、45 ℃热水游泳5 min和悬尾20 min等8种方式, 每天1种,相邻2 d不给予同种应激(使动物无法预见应激),共持续28 d。
3.3给药方法 在造模结束1周后氟西汀组给予氟西汀(20 mg/kg)灌胃,毛蕊花糖苷各剂量组分别予以毛蕊花糖苷(30 mg/kg、60 mg/kg、120 mg/kg)灌胃,给药剂量参考文献[4],对照组及模型组在相同时间等体积的生理盐水灌胃,每天给药1次,每天给药时间固定,连续给药3 周。末次给药24 h后进行行为学实验。
3.4旷场实验 将大鼠置于100 cm×80 cm×40 cm的旷场箱中央,旷场箱4面和底部均为黑色,通过动物行为自动追踪系统记录大鼠在旷场箱内5 min的总行程和中间停留时间。每只大鼠实验后,清理箱内的粪便并使用75%乙醇擦拭旷场箱,以免留下的气味影响下一只大鼠的实验。
3.5糖水偏好实验 动物于正式实验前进行糖水适应性训练,每笼放置2个装有200 mL 1%蔗糖溶液的水瓶24 h,随后禁食禁水24 h,之后同时放置1瓶纯水和1瓶1%蔗糖溶液(均为200 mL),0.5 h后调换两瓶位置,继续放置0.5 h后,测量并计算每只大鼠的糖水偏好量,糖水偏好量(%)=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
3.6免疫荧光染色法 行为学实验结束后,每组随机选取6只大鼠行灌流、冰冻,制备脑组织切片,切片厚度为25 μm。所得切片置于0.01 mol/L PBS(pH 7.4)洗3次,每次5 min。0.3% Triton X-100破膜处理2 h,0.01 mol/L PBS 洗3次,10% BSA封闭1 h,处理好的脑片分别加入 I 抗[GRP78(1∶500)和CHOP(1∶500)]4 ℃孵育48 h,PBS洗3次,再加入FITC标记的IgG(1∶1 000)孵育2 h,PBS 洗3次,90%甘油封片,激光共聚焦显微镜下观察、拍照,利用Image-Pro Plus 6.0 图像分析软件测定积分吸光度(integrated absorbance,IA)。
3.7Western blot实验 行为学实验结束后,每组随机选取6只大鼠,断头取脑,冰上分离前额叶皮层,剪刀剪碎,每50 mg组织加入50 μL裂解液,冰上研磨,4 ℃ 12 000 r/min离心10 min,吸取上清,BCA法进行蛋白定量,加入5×蛋白上样缓冲液,100 ℃水浴5 min,-80 ℃保存备用。10% SDS-PAGE,浓缩胶电压80 V,15 min,分离胶电压120 V,直至溴汾蓝跑到分离胶底部。湿转法转膜1 h,将蛋白转至膜上。5%脱脂奶粉溶液(TBST配制)4 ℃过夜封闭,TBST洗膜3次,每次5 min,加入 I 抗(GRP78为1∶500、CHOP为1∶200、β-actin为1∶200)室温孵育1 h,TBST洗膜3次,再加入辣根过氧化物酶标记的 II 抗(1∶5 000)室温孵育1 h,TBST洗膜3次,将膜置于凝胶成像仪中,加入ECL发光剂,曝光显影,采用ImageJ软件分析蛋白表达情况。
3.8分光光度计法 每组剩余大鼠行断头取脑,冰上分离出前额叶皮层,剪刀剪碎,按照每10 mg组织加入100 μL裂解液的比例加入裂解液,冰上匀浆,4 ℃、20 000 r/min离心15 min,将上清液转移至冰上预冷的96孔板中,配制反应体系,加入适量的Ac-DEVD-pNA(2 mmol/L)后混匀,37 ℃孵育1.5 h,用分光光度计在λ=405 nm处测定其吸光度(A)值,测定caspase-3酶活性。实验过程严格按照试剂盒说明书进行操作。
4 统计学处理
采用SPSS 19.0与GraphPad Prism 5.0软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),各组均数间的两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 毛蕊花糖苷对抑郁症大鼠行为学的影响
旷场实验和糖水偏好实验结果显示,6组大鼠间旷场实验总行程、中间停留时间和糖水偏好量均有显著差异(P<0.05)。与对照组相比,模型组、氟西汀组和毛蕊花糖苷各剂量组旷场实验总行程、中间停留时间和糖水偏好量明显降低(P<0.05);与模型组相比,氟西汀组和毛蕊花糖苷各剂量组旷场实验总行程、中间停留时间和糖水偏好量明显增加,且毛蕊花糖苷高剂量组各指标改变最为明显(P<0.05),见表1。
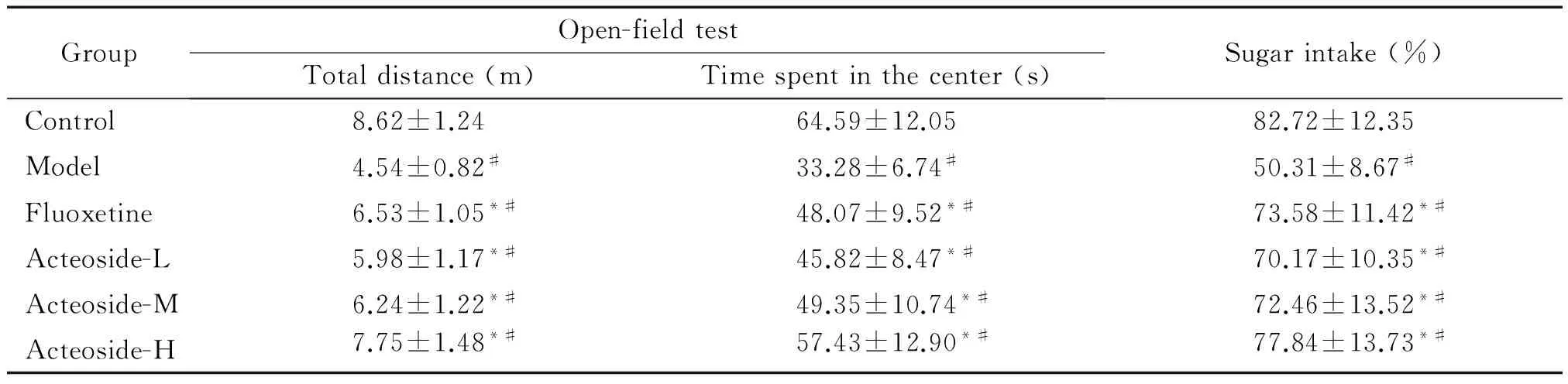
表1 毛蕊花糖苷对抑郁症大鼠行为学的影响
#P<0.05vscontrol group;*P<0.05vsmodel group.
2 毛蕊花糖苷对抑郁症大鼠前额叶皮层GRP78与CHOP阳性神经元表达的影响
各组大鼠前额叶皮层GRP78与CHOP表达情况显示,被标记上绿色的神经元为GRP78和CHOP表达阳性,6组大鼠间GRP78与CHOP阳性神经元的表达水平均有显著差异(P<0.05)。与对照组相比,模型组前额叶皮层GRP78和CHOP的阳性神经元表达水平显著升高(P<0.05);与模型组相比,氟西汀组和毛蕊花糖苷各剂量组前额叶皮层GRP78和CHOP的阳性神经元表达水平显著降低,且毛蕊花糖苷高剂量组GRP78和CHOP阳性神经元表达水平降低最为明显(P<0.05),见图1、2。
3 毛蕊花糖苷对抑郁症大鼠前额叶皮层GRP78与CHOP蛋白表达的影响
各组大鼠前额叶皮层GRP78与CHOP蛋白表达情况示,6组间GRP78与CHOP蛋白表达均有显著差异(P<0.05)。与对照组相比,模型组前额叶皮层GRP78和CHOP蛋白表达水平显著升高(P<0.05);与模型组相比,氟西汀组和毛蕊花糖苷各剂量组前额叶皮层GRP78和CHOP蛋白表达水平显著降低,且毛蕊花糖苷高剂量组GRP78和CHOP蛋白表达水平降低最为明显(P<0.05),见图3。

Figure 1. The observation of GRP78 positive neurons in prefront cortex of the rats in each group (immunofluorescence staining, ×400, scale bar=50 μm). A: control group; B: model group; C: fluoxetine group; D: acteoside-L group; E: acteoside-M group; F: acteoside-H group. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsmodel group.
图1免疫荧光染色观察前额叶皮层GRP78阳性神经元的表达
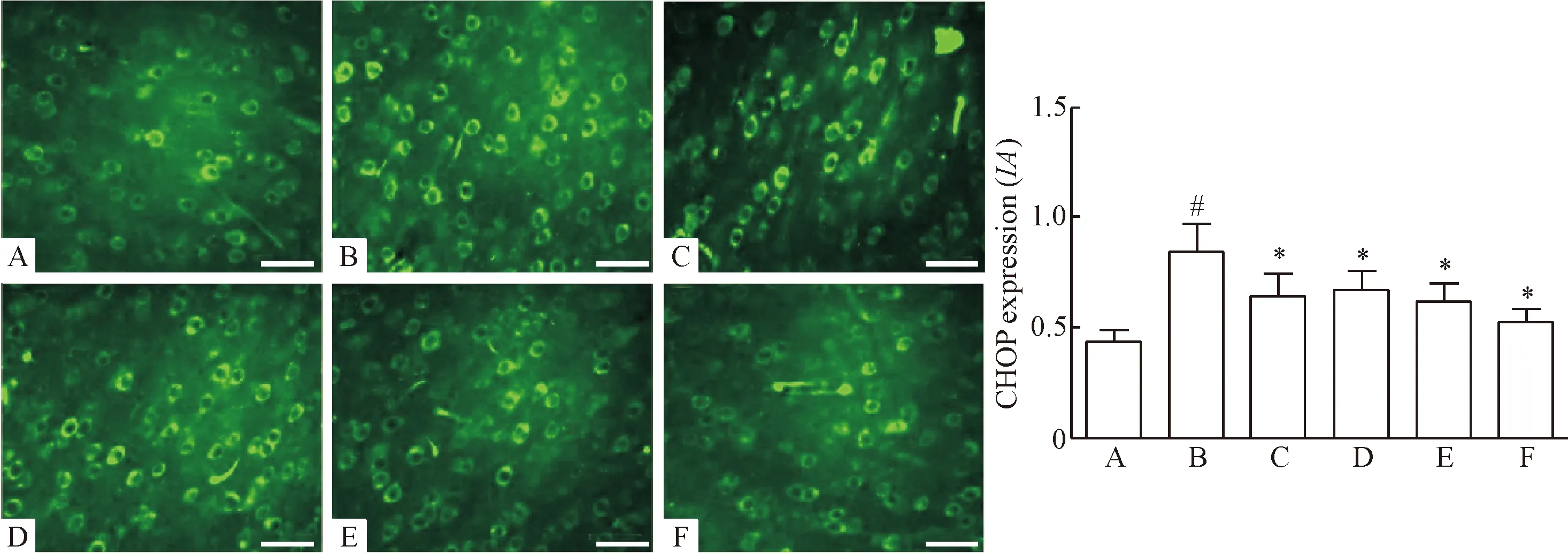
Figure 2. The observation of CHOP positive neurons in prefront cortex of the rats in each group (immunofluorescence staining, ×400, scale bar=50 μm). A: control group; B: model group; C: fluoxetine group; D: acteoside-L group; E: acteoside-M group; F: acteoside-H group. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsmodel group.
图2免疫荧光染色观察前额叶皮层CHOP阳性神经元的表达
4 毛蕊花糖苷对抑郁症大鼠前额叶皮层caspase-3酶活性的影响
6组大鼠间caspase-3酶活性均有显著差异(P<0.05)。与对照组相比,模型组前额叶皮层caspase-3酶活性显著升高(P<0.05);与模型组相比,氟西汀组和毛蕊花糖苷各剂量组caspase-3酶活性显著降低(P<0.05),见图4。
讨 论
抑郁症是以持续的心情低落、焦虑、认知能力下降及其它行为症状等为主要特征的一类精神疾病,已成为自杀死亡的主要原因,并且也是引起其它疾病的危险因素,给社会带来了严重的经济负担。阐明抑郁症的神经病理机制,寻找新型、安全、有效的抗抑郁药已成为亟待解决的问题。
在CUMS结合孤养实验中,实验动物长时间地接受多种不可预见的温和应激刺激并且与同伴分离,使之比较现实地模拟人们在日常生活中独立面对的各种不期而遇的“困难”。在经过长期温和应激刺激后,动物的食物消耗和饮水减少,反映了内源性抑郁症的中心症状,即快感缺失;同时,该模型还模拟了其它重度抑郁障碍的症状表现,如运动能力、探索行为能力和社会交际能力下降等[7]。因此,一般认为通过CUMS结合孤养方式制备抑郁症模型具有高度的有效性,是目前国内外文献报道中广泛使用的抑郁症模型之一。本研究结果显示,抑郁症模型组大鼠在旷场实验总行程、中间停留时间和糖水偏好量较对照组均减少,表明抑郁症模型制备成功。
毛蕊花糖苷是从肉苁蓉中提取出来的一种苯乙醇苷,是肉苁蓉的主要活性成分之一,具有抗氧化、抗肿瘤和调节免疫等多种药理作用[3]。近年来有研究发现,毛蕊花糖苷对中枢神经系统有保护作用,其可以通过提高中枢胆碱能功能、上调神经生长因子及增加原肌球蛋白受体激酶A的表达等途径改善D-半乳糖导致的脑损伤[4,8],亦可以通过激活PI3K/AKT信号通路促进成年小鼠神经干细胞增殖[6],而毛蕊花糖苷是否具有抗抑郁效应未见报道。本研究发现,经过毛蕊花糖苷治疗后,大鼠旷场实验总行程、中间停留时间和糖水偏好量较模型组均增加,说明大鼠抑郁样行为得到改善,提示毛蕊花糖苷具有抗抑郁作用,抗抑郁效果与氟西汀相似。
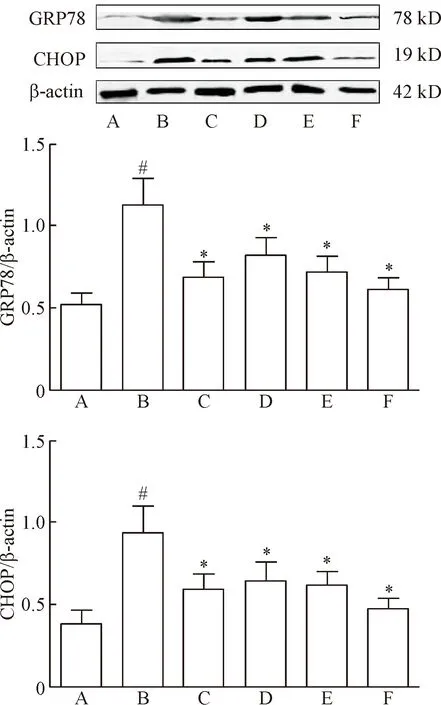
Figure 3. The protein expression of GRP78 and CHOP in prefront cortex of the rats in each group determined by Western blot. A: control group; B: model group; C: fluoxetine group; D: acteoside-L group; E: acteoside-M group; F: acteoside-H group. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsmodel group.
图3Westernblot检测前额叶皮层GRP78和CHOP蛋白的表达
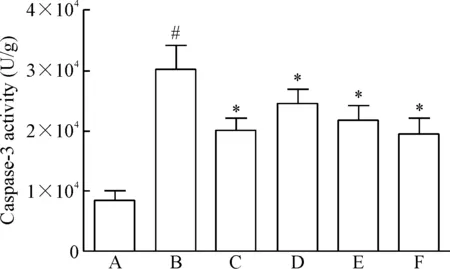
Figure 4. The effect of acteoside on caspase-3 activity in prefront cortex of the rats in each group. A: control group; B: model group; C: fluoxetine group; D: acteoside-L group; E: acteoside-M group; F: acteoside-H group. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsmodel group.
图4前额叶皮层caspase-3酶活性的变化
虽然抑郁症的发病机制尚未明确,但越来越多的证据显示,细胞凋亡与抑郁症的发生发展关系密切[9-11]。细胞凋亡在不同的环境或刺激条件下,会由不同的途径介导。ERS是近年来新发现的一种介导细胞凋亡的途径。研究认为,慢性应激可以通过ERS介导脑区神经元凋亡、数目减少,进而导致突触联系减少,最终引起抑郁样行为的发生[12-13]。内质网是存在于细胞内的一种负责蛋白质折叠和修饰的细胞器。生理状态下,热休克蛋白70(heat shock protein 70,HSP70)家族的成员GRP78作为分子伴侣,参与内质网上蛋白质的折叠与转运,维持细胞内钙稳定[14];病理或应激条件下,GRP78的活性增强,激活ERS通路,减少蛋白错误折叠的发生,以保护细胞正常的状态;如果应激过度,超过了GRP78的处理能力,便通过PERK-eIF2α通路促进活化转录因子4(activating transcription factor 4,ATF4)表达,后者又可进一步促进CHOP表达升高,而CHOP可以促进Bax的表达,Bax是Bcl-2家族中促凋亡因子,Bax的过度表达可使细胞趋于死亡,此过程即为ERS介导的细胞凋亡[15-16]。故无论是生理状态还是应激状态,GRP78在内质网上蛋白质的合成过程中都发挥着重要的作用,是内质网关键的分子伴侣,也是ERS过程中重要的调控因子。因其在ERS发生时表达水平升高,被认为是ERS激活的标志蛋白[17]。同时CHOP在ERS发生时表达水平也升高,也被认为是ERS激活的关键蛋白[18]。本研究通过免疫荧光组化和Western blot法检测大鼠前额叶皮层GRP78和CHOP的表达,发现模型组大鼠GRP78和CHOP的表达较对照组均明显增加,提示ERS参与了抑郁症的发生发展过程;而毛蕊花糖苷各剂量组和氟西汀组GRP78和CHOP的表达较模型组均明显下降,其中,毛蕊花糖苷高剂量组GRP78和CHOP的表达改变最为明显,提示毛蕊花糖苷可以通过降低ERS应激程度发挥抗抑郁效应。
Caspase-3 作为一种促凋亡蛋白,属于caspase蛋白激酶家族成员,广泛分布于脑组织中,是细胞凋亡过程中的关键执行分子,其表达变化与细胞的生死存亡密切相关[19-20]。本研究通过分光光度计检测大鼠前额叶皮层caspase-3酶活性,发现模型组大鼠caspase-3酶活性较对照组明显升高,而毛蕊花糖苷各剂量组和氟西汀组caspase-3酶活性较模型组明显降低。提示毛蕊花糖苷可能通过降低细胞凋亡程度发挥抗抑郁效应。
综上所述,毛蕊花糖苷可以改善抑郁症大鼠的抑郁样行为,具有抗抑郁效应,其抗抑郁机制可能与缓解ERS应激程度、减少细胞凋亡有关。但何种剂量的毛蕊花糖苷作用效果最好及其具体作用机制还需进一步研究明确。
[1] 沈忠飞, 王志坚, 潘巍巍, 等. 氟西汀调控CUMS抑郁大鼠海马突触重塑[J]. 中国病理生理杂志, 2016, 32(9):1642-1647.
[2] Strekalova T, Couch Y, Kholod N, et al. Update in the methodology of the chronic stress paradigm: internal control matters[J]. Behav Brain Funct, 2011, 7:9.
[3] Alipieva K, Korkina L, Orhan IE, et al. Verbascoside: a review of its occurrence, (bio)synthesis and pharmacological significance[J]. Biotechnol Adv, 2014, 32(6):1065-1076.
[4] 高 莉, 彭晓明, 霍仕霞, 等. 毛蕊花糖苷改善D-半乳糖致亚急性衰老小鼠脑损伤的作用[J]. 中草药, 2014, 45(1): 81-84.
[5] Shiao YJ, Su MH, Lin HC, et al. Acteoside and isoac-teoside protect amyloid β peptide induced cytotoxicity, cognitive deficit and neurochemical disturbancesinvitroandinvivo[J]. Int J Mol Sci, 2017, 18(4):E895.
[6] Yuan JW, Ren J, Wang Y, et al. Acteoside binds to caspase-3 and exerts neuroprotection in the rotenone rat model of Parkinson’s disease[J]. PLoS One, 2016, 11(9):e0162696.
[7] Luo KR, Hong CJ, Liou YJ, et al. Differential regulation of neurotrophin S100B and BDNF in two rat models of depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010, 34(8):1433-1439.
[8] Gao L, Peng XM, Huo SX, et al. Memory enhancement of acteoside (Ver-bascoside) in a senescent mice model induced by a combination of D-gal and AlCl3[J]. Phytother Res, 2015, 29(8):1131-1136.
[9] 樊 凌, 吕爱平, 符文彬, 等. 针刺对抑郁症大鼠海马5-HT、NE、BDNF水平和神经元细胞凋亡相关基因表达的影响[J]. 中华中医药杂志, 2016, 31(8):3204-3207.
[10] Miguel-Hidalgo JJ, Whittom A, Villarreal A, et al. Apoptosis-related proteins and proliferation markers in the orbi-tofrontal cortex in major depressive disorder[J]. J Affect Disord, 2014, 158:62-70.
[11] 董海影, 张静艳, 柏青杨, 等. 柴胡皂苷A对抑郁模型大鼠海马神经细胞凋亡的保护作用[J]. 中国老年学杂志, 2015, 35(7):1935-1937.
[12] Nevell L, Zhang KZ, Aiello A,et al. Elevated systemic expression of ER stress related genes is associated with stress-related mental disorders in the Detroit Neighborhood Health Study[J]. Psychoneuroendocrino, 2014, 43:62-70.
[13] Apostolova N, Gomez-Sucerquia LJ, Alegre F, et al. ER stress in human hepatic cells treated with Efavirenz: mitochondria again[J]. J Hepatol, 2013, 59(4):780-789.
[14] Park KW, Eun Kim G, Morales R, et al. The endoplasmic reticulum chaperone GRP78/BiP modulates prion propagationinvitroandinvivo[J]. Sci Rep, 2017, 7: 44723.
[15] Yi S, Shi W, Wang H, et al. Endoplasmic reticulum stress PERK-ATF4- CHOP pathway is associated with hypothalamic neuronal injury in different durations of stress in rats[J]. Front Neurosci, 2017, 11:152.
[16] Yang Y, Sun M, Shan Y, et al. Endoplasmic reticulum stress-mediated apoptotic pathway is involved in corpus luteum regression in rats[J]. Reprod Sci, 2015, 22(5):572-584.
[17] 陈理军, 马 艳, 李 霞, 等. 脑缺血及后适应对树鼩海马内质网应激信号分子PERK及GRP78的影响[J]. 中国病理生理杂志, 2015, 1(6):1105-1110.
[18] Willy JA, Young SK, Stevens JL, et al. CHOP links endoplasmic reticulum stress to NF-κB activation in the pathogenesis of nonalcoholic steatohepatitis[J]. Mol Biol Cell, 2015, 26(12):2190-2204.
[19] 董雅洁, 高维娟, 钱 涛, 等. Bcl-2抑制剂对黄芪注射液降低缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的影响[J]. 中国病理生理杂志, 2016, 32(6):1051-1056.
[20] Suresh A, Subedi K, Kyathanahalli C, et al. Uterine endoplasmic reticulum stress and its unfolded protein response may regulate caspase 3 activation in the pregnant mouse uterus[J]. PLoS One, 2013, 8(9):e75152.
