糖基化与胰蛋白酶酶解对大豆蛋白构象和功能性质的影响
2018-01-19宋春丽陈佳鹏康文娜齐齐哈尔大学食品与生物工程学院黑龙江省普通高校农产品加工重点实验室黑龙江齐齐哈尔161006
宋春丽,任 健,陈佳鹏,康文娜,张 新 (齐齐哈尔大学 食品与生物工程学院,黑龙江省普通高校农产品加工重点实验室,黑龙江 齐齐哈尔161006)
大豆分离蛋白(SPI)的蛋白质含量可达90%以上,营养价值高,消化利用率也较高。大豆分离蛋白作为功能性配料添加于许多食品中,在食品工业中备受关注。但作为食品功能性配料的需求多种多样,单一来源的天然蛋白质,不可能具备所有期望的蛋白质特性。因而,蛋白质改性技术是一种获得具有特定的功能性质和营养特性的必要手段。
酶法水解蛋白质是利用蛋白酶的催化作用,使蛋白质肽键断裂,得到蛋白质酶解产物,改善蛋白质的营养价值[1]以及某些功能性质,如改善燕麦浓缩蛋白的溶解性、乳化性[2],乳清蛋白的生物活性[3]。与之不同的是,转谷氨酰胺酶(TGase)催化的糖基化作用,通过蛋白质与氨基糖的交联作用,将氨基糖导入到食品蛋白质分子中[4]。该修饰作用能够有效改善蛋白质的一些功能性质,如流变性、凝胶性及乳化稳定性[5-7]。然而,限制性酶解对转谷氨酰胺酶催化制备的糖基化蛋白质的构象及功能性质的研究鲜有报道。
本研究通过转谷氨酰胺酶催化大豆蛋白(SPI)与壳寡糖发生糖基化交联反应,制备糖基化大豆蛋白(GSPI),随后利用胰蛋白酶酶解该蛋白质。分析糖基化及蛋白酶的酶解作用对大豆蛋白的构象及功能性质的影响,为扩大大豆蛋白作为功能性食品配料的应用提供理论依据和技术支持。
1 材料与方法
1.1 实验材料
脱脂豆粉:哈尔滨市宾县禹王植物蛋白有限公司;转谷氨酰胺酶:江苏一鸣精细化工有限公司;壳寡糖(平均相对分子质量为1 kDa,脱乙酰度≥90%):浙江金壳生物化学有限公司;胰蛋白酶(酶活>2 500 U/mg):Sigma公司;其他试剂均为分析纯。
RF-5301pc型荧光分光光度计:日本岛津公司;UV5100型紫外可见分光光度计;CF15RX型高速离心机:Hitachi公司。
1.2 实验方法
1.2.1 糖基化大豆蛋白及其胰蛋白酶酶解产物的制备
按照文献[6]的方法制备糖基化大豆蛋白(GSPI)。将其分散液(3.5%,pH 7.0)于60℃下加入1%胰蛋白酶,反应过程中通过滴加0.5 mol/L NaOH溶液维持体系pH(7.0)恒定。根据pH-Stat法[8]计算NaOH溶液的添加量,反应结束后立即取出酶解液,85℃灭酶5 min。冷却后,冻干备用,制得水解度(DH)分别为1%、5%、10%和15%的酶解产物。
1.2.2 内源荧光发射光谱分析
将蛋白质分散液(0.5 mg/mL,pH 7.0的10 mmol/L 的磷酸盐缓冲液)在10 000 r/min条件下离心15 min,取上清液。在发射波长为290 nm、激发和发射狭缝宽度均为5 nm条件下,扫描300~500 nm的发射光谱。
1.2.3 热稳定性的测定
热稳定性=Cpo/Cpt×100%
式中:Cpo为上清液中蛋白质的质量浓度,mg/mL;Cpt为大豆蛋白分散液的质量浓度(1 mg/mL)。
1.2.4 起泡性的测定
参照Motoi等[11]的方法,采用搅打法测定大豆蛋白及其修饰产物的起泡性和泡沫稳定性。
1.2.5 乳化性的测定
参照Pearce等[12]的方法,采用比浊法测定大豆蛋白及其修饰产物的乳化活性和乳化稳定性。
1.2.6 体外消化性的测定
参照Song等[13]的方法。采用两步酶解法,即一步酶解(胃蛋白酶酶解)和两步酶解(胃蛋白酶-胰蛋白酶酶解)模拟蛋白质的消化,以消化液在三氯乙酸溶液中的可溶性氮含量表示蛋白质的体外消化能力,以其在280 nm处吸光值表示。
2 结果与讨论
2.1 三级结构
大豆蛋白、糖基化大豆蛋白及其酶解产物的内源荧光发射光谱如图1所示。
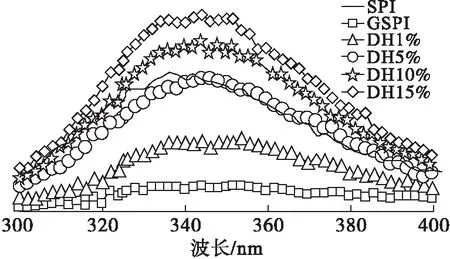
图1 大豆蛋白及其修饰产物的内源荧光发射光谱
从图1可以看出,大豆蛋白的荧光峰在336 nm处,是典型的色氨酸荧光光谱[14],表明色氨酸基位于大豆蛋白的疏水性区域,如蛋白质分子的内部。相对于大豆蛋白,糖基化大豆蛋白及其酶解产物对应的波长分别为347 nm和343~349 nm,高于大豆蛋白,表明发生了红移。一般来说,最大吸收波长的红移,表明荧光发射基团暴露在溶剂中,蛋白质分子展开。荧光分析结果表明,酶解改性使蛋白质的肽链伸展,并伴随着更多包埋在蛋白质内部的疏水性基团暴露于水溶液中[14]。即大豆蛋白修饰产物具有更加松散的蛋白质三级结构。
2.2 热稳定性
糖基化大豆蛋白及其酶解产物在pH 4.0和pH 7.0的热稳定性变化如图2所示。


图2 大豆蛋白及其修饰产物的热稳定性
从图2可以看出,相对于大豆蛋白,糖基化大豆蛋白经过热处理后,热稳定性下降。而其经过胰蛋白酶酶解后,热稳定性显著提高,pH 4.0和pH 7.0的酶解产物(DH 15%)经过热处理后,仍分别有50.74%和67.66%的热稳定性。结果表明,胰蛋白酶的酶解显著地增强了糖基化大豆蛋白的热稳定性。这是由于胰蛋白酶切断了蛋白质肽链中赖氨酸、精氨酸残基中的羧基,增加的带电氨基酸能够形成更多的离子键,这对提高蛋白质的热稳定性起到了关键作用[15]。胰蛋白酶修饰产物在酸性及中性pH条件下均具有较好的热稳定性,这将扩大大豆蛋白在食品加工中作为配料的应用范围。
2.3 起泡性(见图3)
从图3可以看出,相对于大豆蛋白,糖基化大豆蛋白的起泡性没有显著变化,而其胰蛋白酶酶解产物的起泡性随着水解度的增加先增加后下降,水解度为10%的酶解产物的起泡性最大(92.5%),当水解度继续增加到15%时,酶解产物的起泡性反而下降。糖基化大豆蛋白具有较高的泡沫稳定性,而其胰蛋白酶酶解产物的泡沫稳定性下降,水解度为15%的糖基化大豆蛋白的泡沫稳定性最低(51.3%)。这是因为酶解改性后蛋白质的平均相对分子质量降低,蛋白质更容易在界面扩散,吸附在气-液界面,所以起泡性增加。酶解导致大豆蛋白的黏度下降,电荷数目增加过多,使气液薄膜强度降低,泡沫易破裂,泡沫稳定性下降[16]。
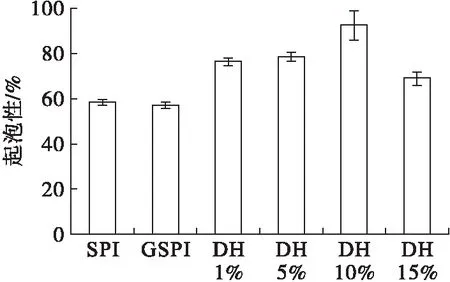
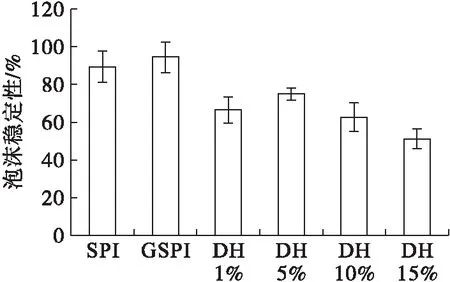
图3 大豆蛋白及其修饰产物的起泡性与泡沫稳定性
2.4 乳化性(见图4)
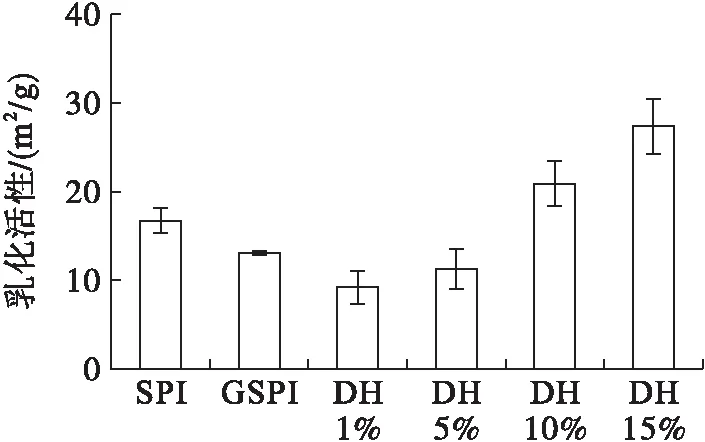

图4 大豆蛋白及其修饰产物的乳化活性及乳化稳定性
从图4可以看出,相对于大豆蛋白,糖基化大豆蛋白的乳化活性下降,而其胰蛋白酶酶解产物的乳化活性随着水解度的增加而增加,这表明糖基化大豆蛋白酶解产物更易于向水油界面扩散,排列更为有序[17]。糖基化大豆蛋白的乳化稳定性提高,其酶解产物也表现出较高的乳化稳定性,但当水解度大于5%时,酶解产物的乳化稳定性下降,这是由于不同水解度的酶解产物中低相对分子质量肽的含量不同。研究表明,胰蛋白酶酶解有利于提高大豆蛋白的乳化活性,但是酶解产物的相对分子质量较低(10 kDa)时,酶解产物的乳化稳定性下降[18]。
2.5 体外消化性(见图5)


图5 大豆蛋白及其修饰产物的体外消化性
由图5可以看出,一步酶解中(胃蛋白酶的消化作用),糖基化大豆蛋白的体外消化能力低于大豆蛋白,而其胰蛋白酶酶解产物的体外消化能力随着水解度的增加逐渐增强,水解度为10%的酶解产物的体外消化能力与大豆蛋白的体外消化能力没有显著差异;两步酶解(胃蛋白酶-胰蛋白酶酶解)显著提高了糖基化大豆蛋白的体外消化能力。结果表明,大豆蛋白修饰产物对胃蛋白酶和胰蛋白酶的敏感性存在差异,体外消化能力不同。
3 结 论
转谷氨酰胺酶催化的糖基化及胰蛋白酶的酶解作用都可以赋予大豆蛋白疏松的三级结构。糖基化作用提高了大豆蛋白的泡沫稳定性和乳化稳定性。酶解作用能够显著提高大豆蛋白溶液在酸性及中性条件下的热稳定性;控制水解度能够改善大豆蛋白的乳化性和起泡性。两种修饰作用会改变大豆蛋白的体外消化能力。结合两种修饰作用可以制备具有特定功能性质的食品蛋白质配料。
[1] 庞美蓉, 丁秀臻, 孔祥珍,等. 蛋白酶水解大豆分离蛋白的分子水平表征[J]. 中国油脂, 2013, 38(5):20-23.
[2] GUAN X, YAO H, CHEN Z, et al. Some functional properties of oat bran protein concentrate modified by trypsin[J]. Food Chem, 2007, 101(1): 163-170.
[3] FERREIRA I, PINHO O, MOTA M V, et al. Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates[J]. Int Dairy J, 2007, 17(5): 481-487.
[4] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry. A review [J]. Folia Microbiol, 2014, 59(3): 241-250.
[5] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products [J]. Eur Food Res Technol, 2010, 231(5):679-689.
[6] SONG C L, ZHAO X H. Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J]. Food Chem, 2014, 163(12): 114-119.
[7] FU M, ZHAO X H. Modified properties of a glycated and cross-linked soy protein isolate by transglutaminase and an oligochitosan of 5 kDa [J]. J Sci Food Agric, 2017, 97(1): 58-64.
[8] ADLER-NISSEN J. Limited enzymic degradation of proteins: a new approach in the industrial application of hydrolases[J]. J Chem Technol Biotechnol, 1982, 32:138-156.
[10] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem, 1951, 193(1): 265-275.
[11] MOTOI H, FUKUDOME S, URABE I. Continuous production of wheat gluten peptide with foaming properties using immobilized enzymes [J]. Eur Food Res Technol, 2004, 219(5): 522-528.
[12] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. J Agric Food Chem, 1978, 26(3): 716-723.
[13] SONG C L, ZHAO X H. The preparation of an oligochitosan-glycosylated and cross-linked caseinate obtained by a microbial transglutaminase and its functional properties[J]. Int J Dairy Technol, 2014, 67(1):110-116.
[14] ZHAO G, LIU Y, ZHAO M, et al. Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J]. Food Chem, 2011, 127(4): 1438-1443.
[15] 田健, 王平, 伍宁丰,等. 理性设计提高蛋白质热稳定性的研究进展[J]. 生物技术进展, 2012, 2(4):233-239.
[16] 黄群, 杨万根, 金永国,等. 酶法改善卵白蛋白起泡性[J]. 食品科学, 2014, 35(23):171-175.
[17] 赵新淮, 侯瑶. 大豆蛋白限制性酶解对乳化性质和吸油性的影响[J]. 农业机械学报, 2009, 40(12):159-163.
[18] 任方林,杨玥熹,陈业明,等.大豆乳清蛋白及其糖基化产物体外模拟胃肠消化特性研究[J].中国油脂, 2016, 41(9):18-23.
