中心切割二维液相色谱串联质谱法分析烟草农残研究
2018-01-19王轩堂戚大伟刘百战张祥民
陈 敏,王轩堂,吴 达,戚大伟,罗 辰,刘百战*,张祥民*
(1.复旦大学,上海 200433;2.上海烟草集团有限责任公司技术中心,上海 200082)
烟草作为世界上种植最广泛的非粮食作物,在全世界129个国家和地区种植[1]。在烟草栽培、生长、成熟和储存醇化过程中,常需要农药[2],因此,农药残留作为烟草质量安全问题的一个重要组成部分,引起广泛关注[3-4]。国际烟草科学研究合作中心(CORESTA)于2003年首次提出烟草中农用化学品指导性残留限量(Guidance Residue Levels,GRLs),至2016年已经更新至第四版,涉及农药从最初的99种增至106种[5]。
有关农药残留检测的研究一直是CORESTA会议关注的热点[6],行业内出台了相应的检测标准[7-8],常用的方法主要有GC-MS/MS和LC-MS/MS方法。CHEN等[9]建立了GC-MS/MS测定烟草中159种农药残留的方法,并将其用于118种不同烟草样品的测试。KERKDIJK[10],GUO[11],LU 等[12]运用 GPC、SPE与GC-MS相连等技术净化样品,从而达到减少基质效应的效果。QI等[13]采用在线LC-GC技术,测定了18种有机氯农残。LC-MS/MS法测定农药残留量近年来得到了广泛应用[14-16],BERNARDI等[15]报道采用低温和分散微萃取技术净化样品,并进行LC-MS/MS测定。
配合液质、气质的高灵敏性、高选择性,QuEChERS提取方法以其简便、快速、安全、价廉的特点得到广泛应用[7]。烟草萃取液基质有超过5000种化合物[17-18],QuEChERS法通过乙腈萃取、分散质萃取,可以有效去除其中的糖类、有机酸、色素等大部分干扰物质,但难以去除大分子的蛋白及一些非极性物质[19]。因此在一维液质(LC-MS/MS)多农残检测中,通常每做20个左右样品,基质抑制效应就较明显,为了保证测试结果的准确性,需经常对质谱离子源进行清洗维护。体积排阻色谱(GPC)利用填料孔径按分子大小分离待测样,是净化去除大分子干扰物质的理想方式[20]。采用基于GPC与RPLC二维联用技术降低基质影响,来保持大批量样品农残测试稳定性,是较为可行的解决方案。但构建GPC-RPLC联用系统较为复杂,需综合考察二维系统中流动相的兼容性、待测物的捕集效率、馏分转移是否完全等,相应的研究与应用较少。
本研究构建了体积排阻色谱与反相液相联用的中心切割二维液相色谱质谱联用系统,并开发了基于该系统的测定烟草多种农药残留分析方法。采用GPC柱净化去除烟草样品中大分子干扰物质,分流后通过定量环收集目标物,通过阀切换将样品带入第二维反相液相色谱分离。该方法仪器自动运行,方法的检测限和定量限满足农药残留限量检测需要,可有效降低大批量样品检测中的大分子基质影响,减少离子源污染,适合于农残的大批量日常检测。
1 材料与方法
1.1 仪器与试剂
空白烟叶样品,为0.42 mm(40目)烤烟烟末,购自英国食品分析能力评价体系(Food Analysis Performance Assessment Scheme,FAPAS);农药残留标样纯度大于99.8%、浓度1 mg/mL,内标三磷酸苯酯(TPP),QuEChERS试剂盒(粉包含4 g无水硫酸镁、1 g氯化钠和0.5g柠檬酸氢钠,小管含150 mg无水硫酸镁和25 mg N-丙基乙二胺键合固定相吸附剂),均购自百灵威公司;乙腈、甲酸均为色谱纯,购自德国Merk公司;过0.22µm的有机相滤膜,购自安谱公司;甲酸铵为分析纯,购自国药集团化学试剂有限公司。
中心切割二维色谱由Agilent 1290液相色谱、Agilent 1260四元泵和六通阀构成,美国Agilent公司;AB SCIEX三重四级杆质谱仪API 4000,美国AB SCIEX公司;电子天平,感量瑞士Mettler Toledo公司;SW12H超声仪,瑞士Sono Swiss公司;TALBOYS Advanced Multi-Tube Vortexer涡旋振荡仪,美国Henry Troemner.LLC公司;Eppendorf centrifuge 5810R离心机,德国EppendorfAG公司;Milli-Q纯水仪,美国Millpore公司。GPC色谱柱:TOSOH TSK-Gel SuperSW3000(4.6 mm×300 mm,4µm),安谱公司;反相液相色谱柱:Welch Ultimate XB C18(2.1 mm×200 mm,3µm),安谱公司;定量环:500µL,1 mm内径,自制,检测波长230 nm。
1.2 样品提取与净化
称取2.000 g烟末于50 mL离心管中,加入10 mL纯水振荡至样品被水充分浸润后静置10 min。移取含内标100 ng/mL的乙腈溶液10 mL加入离心管中,置于涡旋振荡仪以2000 r/min振荡1 min。分别加入QuEChERS试剂盒粉包,置于涡旋振荡仪以2000 r/min振荡2 min,再以5000 r/min的速度离心10 min。取1 mL上清液样品于QuEChERS试剂盒(含吸附剂)小管中,用涡旋振荡仪以2000 r/min振荡2 min,再以5000 r/min的速度离心5 min,取上清液并用0.22 μm的有机相滤膜过滤。
1.3 标准溶液配置
分别移取1 mg/mL的混合标准溶液,用乙腈稀释至5µg/mL,贮存于−18℃冰箱,有效期3个月。配置农药浓度为10、25、50、100、250、500 ng/mL,内标浓度为100ng/mL的系列标准溶液。用空白烟叶样品按1.2步骤制取空白提取液,移取400µL于色谱瓶中,氮气常温吹干。移取400µL农药标样进行复溶,得到含烟草基质的标样,内标浓度为100ng/mL,农残分析物系列标样浓度分别为10、25、50、100、250、500 ng/mL。
1.4 仪器分析参数
中心切割二维液相色谱串联质谱样品进样量为3µL,柱温均为30℃。第一维体积排阻色谱分析条件为A相纯水,B相纯乙腈,保持40%B相等度洗脱,流速为0.4 mL/min。柱后分流器分流比为7∶1,六通阀切割时间为8~14 min。中心切割馏分由第二维流动相带入第二根色谱柱进行梯度淋洗,第二维反相液相色谱分析条件为A相为2 mmol/L甲酸铵,0.1%甲酸溶液,95%H2O+5%CH3CN(V:V),B相为2 mmol/L甲酸铵,0.1%甲酸溶液,5%H2O+95%CH3CN(V∶V),流速为 0.4 mL/min。第二维梯度淋洗程序如表1所示。
质谱条件为电喷雾离子源(ESI),正、负离子扫描方式,多反应检测(MRM)模式;喷雾(IS)电压5500 V;雾化气(Gas1)414 kPa;气帘气(Curtain Gas)压力206.7 kPa;辅助雾化气(Gas2)压力482.6 kPa;离子源温度 (TEM)500℃。

表1 第二维梯度淋洗程序Table 1 Gradient elution of the second dimensional separation
2 结果与讨论
2.1 中心切割二维液相色谱串联质谱系统建立
在一维液相色谱串联质谱方法测定烟草农残的过程中,去除基质中的大分子物质对保持分析的准确性与稳定性十分重要。研究建立中心切割GPC-RPLC串联质谱系统进行烟草中农残的分析,装置示意图如图1所示。一维采用二元泵40%乙腈的梯度经过GPC柱,利用填料孔径按分子大小分离待测样,对烟草萃取液中大分子物质进行分离去除。为解决GPC流动相对第二维反相LC分离的影响,目标馏分采用分流器分流,仅允许少部分馏分转移到二维柱;为避免中心切割过程中GPC柱压力过高,目标馏分用定量环收集。第二维采用反相液相色谱柱,二维泵通过六通阀连反冲定量环将目标物馏分转移到二维柱,最后进入质谱MRM定量。
2.2 第一维分离条件优化
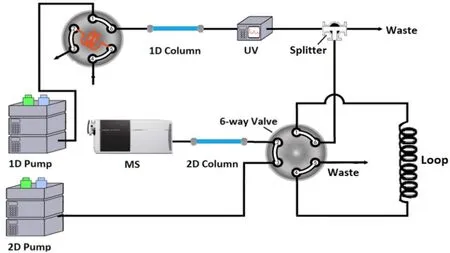
图1 中心切割GPC-RPLC串联质谱系统示意图Fig.1 Schematic diagram of the heart-cutting GPC-RPLC tandem mass spectrometry system
考虑到第一维流动相需与第二维反相液相兼容,一维色谱柱选用水性GPC柱匹配性较合适,研究考察了多种水性GPC柱,并对进样量、色谱柱内径、长度、淋洗条件等方面进行优化。本研究自制了毛细管GPC柱,通过调整毛细管柱长与内径,大分子干扰物与目标农残可实现较好的基线分离,但色谱柱较长导致柱压过高,且样品最大上样量仅为0.2 μL,后续质谱定量分析灵敏度无法达到测试要求。选择高分离度的商品化水性GPC柱,若以纯水为流动相,对目标物与干扰物有较好的分离,但由于目标农残较多且性质差异较大,流出时间跨度长达40 min,需切割馏分的体积大、浓度低,难以向下一维转移。对不同内径、长度的常规水性GPC柱进行了考察及分析条件优化,采用内径为4.6 mm,柱长 30 cm的GPC柱较合适,进样量为3 μL,40%乙腈等度洗脱条件可有效去除烟草萃取液基质中大分子物质,且农残组分的流出时间可压缩到适合的范围。
通过对第一维馏分收集并离线分析,发现大分子干扰成分流出主要集中在4~7 min。将一维分离后样品直接引入质谱,进行多反应监测模式扫描。从图2一维分离后质谱总离子流图可以看出,农残目标物集中在9~13 min,因此将六通阀切割时间确定为8~14 min。
2.3 第二维分离条件优化
在第一维目标馏分转移过程中,可采取的转移方式主要有捕集柱捕集、定量环收集。本研究农残检测目标物种类众多,且极性、pKa值、溶解性等差异较大,考察了多种捕集柱的捕集方式,捕集效果均不理想,此外,GPC柱耐压性能也有一定限制,因此采用了定量环收集目标馏分的方式。在第一维流动相0.4 mL/min条件下,切割体积达2.4 mL。切割馏分体积过大,且有机相比例较高,若全部转移,对二维RPLC分离的影响较大,弱保留成分流失及峰展宽问题较为严重,因而采取分流后收集的方式。考察了不同分流比(11:1、9:1、7:1、5:1),分流比为7:1较合适,转移馏分体积约340 μL,选择500 μL的定量环对目标物馏分进行收集。
2.4 方法的验证
切割馏分转移到二维柱过程中,为避免在第二维反相液相保留能力弱的极性较大的农残流失,经优化确定5%乙腈浓度冲洗定量环3 min。进一步优化淋洗梯度,得到的加烟草萃取液基质的标样质谱MRM扫描总离子流如图3所示。在15.5 min一些在反相液相色谱保留能力差的农残化合物共流出,有一定保留的农残化合物在20~50 min呈现较好的分离。运用该方法对烟草实际样品进行测定,得到实际样品质谱MRM扫描总离子流图4所示。

图2 加标萃取液与纯标样一维分离后质谱总离子流图Fig.2 Total ion chromatogram of spiked extraction solution and standards in first dimensional separation

图3 加基质标样质谱MRM扫描总离子流图Fig.3 Total ion chromatogram of MRM spectra from spiked extraction solution

图4 实际样品质谱MRM扫描总离子流图Fig.4 Total ion chromatogram of MRM spectra from extraction solution
对含空白基质混合标准工作溶液进行2DLCMS/MS分析,并制备工作曲线,采用最低浓度标样重复进样10次,取其3倍标准偏差为检出限,10倍标准偏差为定量限,结果见表2。在10~500 ng/mL的线性浓度范围内,农药的线性相关系数大于0.99,拥有良好的动态线性范围,不同农药方法的定量限(LOQ)在0.22~0.152 mg/kg。对方法的回收率、重复性进行考察,方法中农药的回收率在72%~136%,日内重复性1.6%~10.2%,日间重复性为3.3%~13.6%,满足农残检测的需要。
2.5 本方法与一维LC-MS/MS测定比较
运用本方法与一维LC-MS/MS方法分别对农残样品进行测定,测定过程中每10个样品增加1个监控标样QC。从图5中可以发现做了20个样品之后,一维LC-MS/MS方法的质谱MRM总离子流图明显降低,不同农残的质谱信号均有不同程度的降低。而本方法测定烟草农残100个样品后,监控标样信号无明显变化,如图6所示。
采用本方法与LC-MS/MS方法分别对农残样品进行实际样品的测定,结果显示(表3),多数农残具有较好的一致性,部分农残数据差异较大,但差异趋势较为一致。我们推测,基质效应可能是主要因素。相比一维LC-MS/MS方法,二维LC-MS/MS在大批量烟草农残检测中可有效避免大分子基质影响,基质效应大大降低。
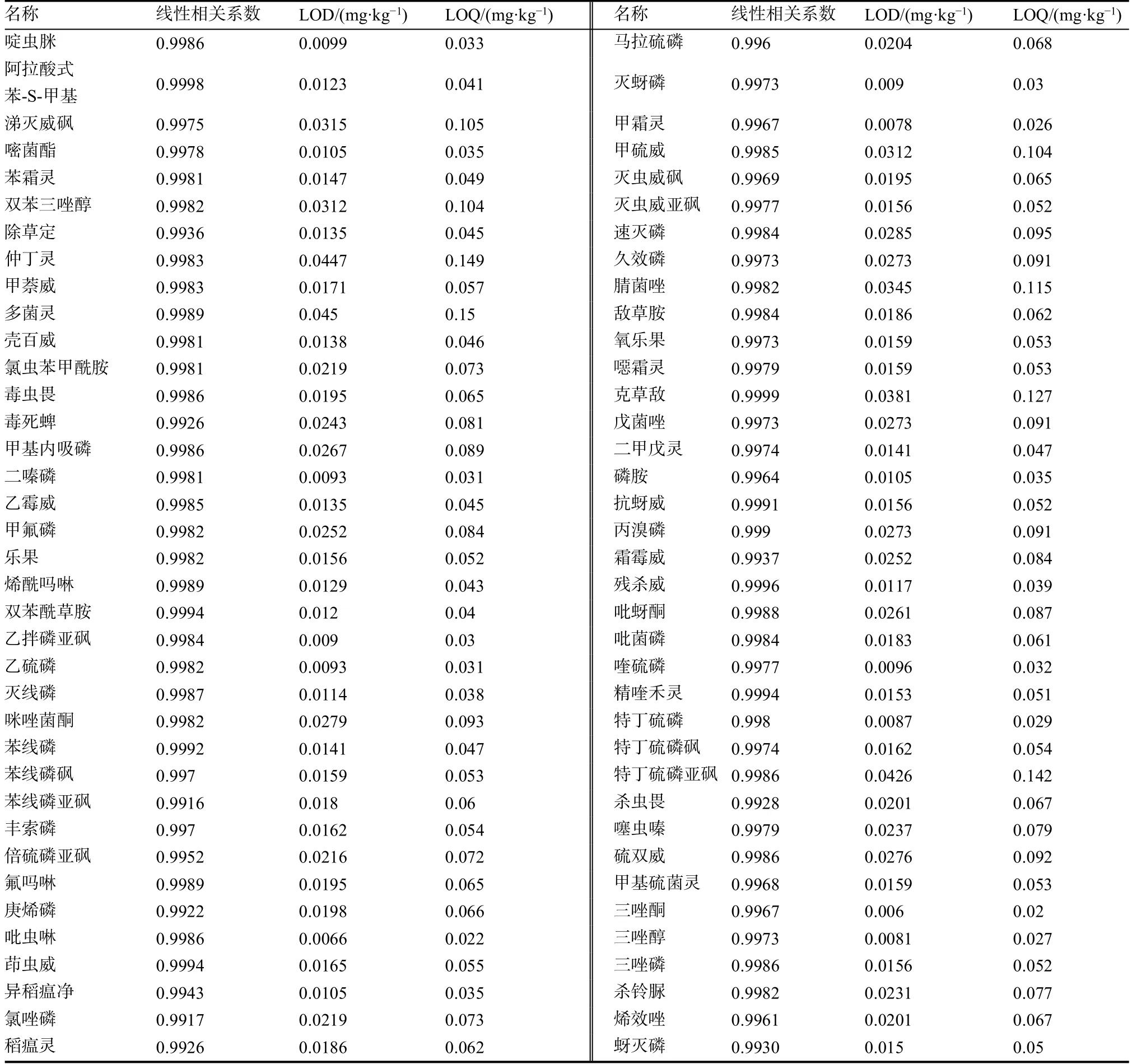
表2 方法线性相关系数及检出限、定量限Table 2 Linear correlation coefficients,LODs and LOQs of the method

图5 LC-MS/MS方法测定烟草农残监控标样比较Fig.5 Detection results of tobacco pesticide residues in reference samples achieved by LC-MS/MS method
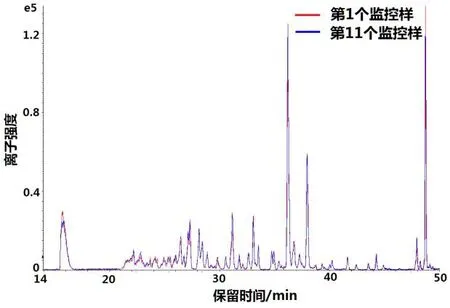
图6 2DLC-MS/MS方法测定烟草农残监控标样比较Fig.6 Detection results of tobacco pesticide residues in reference samples achieved by 2DLC-MS/MS method
2.6 实际样品测定
应用该方法对不同烟草实际样品进行农药残留情况筛查,结果如表4所示。检出量较高的主要为霜霉威、二甲戊灵和吡虫啉,均未超过限量标准。

表3 本方法与LC-MS/MS测定结果比较Table 3 Comparision of detection results achieved by the new method and LC-MS/MS method mg/kg

表4 部分烟草实际样品农残测定结果Table4 Resultsofpesticideresiduesin tobaccosamplesmg/kg
3 结论
在烟草等复杂体系农残LC/MS/MS测定中,基质对离子源的影响严重,基质效应已经成为瓶颈问题之一。本文基于中心切割二维液相色谱技术,建立了体积排阻-反相液相二维液相色谱串联质谱方法测定烟草中多种农残成分。通过体积排阻色谱GPC柱将样品中分子量高于2000的大分子物质在第一维分离去除,目标物中心收集至定量环,切割至下一维反相液相色谱梯度淋洗。不同种类农药回收率在72%~136%,定量限在0.022~0.152 mg/kg。
结果表明方法的重复性好、准确度高,进样200次后,基质效应无明显变化,尤其适应大批量样品农残的日常检测工作。本方法不仅稳定性好,离子源清洗、仪器校正等维护工作量也大大下降。
此外,该体积排阻-反相液相二维液相色谱串联质谱平台不仅可以用于烟草多种农残测定中大分子物质的去除,在复杂基质样品中大分子去除和小分子目标物分析中具有广阔的应用前景。
[1]PEEDIN G F.Tobacco cultivation in:Specialty Crops.,International Labor Organization[EB/OL].(2011-03-10)[2017-07-17]. http://www.iloencyclopaedia.org/part-x-96841/agriculture-and-natural-resources-based-industries/specialty-crops/106-specialty-crops/tobacco-cultivation.
[2]DAMALAS C A,KOUTROUBAS S D,Determinants of farmers’decisions on pesticide use in oriental tobacco:a survey ofcommon practices [J].JournalofPest Management,2014,60(3):224-231.
[3]KAUSAR A,GIRI S,ROY P,et al.Changes in buccal micronucleus cytome parameters associated with smokeless tobacco and pesticide exposure among female tea garden workers of Assam[J].International Journal of Hygiene and EnvironmentalHealth,2014,217(2):169-175.
[4]FARIA N M X,FASSA A G,MEUCCI R D,et al.Occupational exposure to pesticides,nicotine and minor psychiatric disorders among tobacco farmers in southern Brazil[J].Neuro Toxicology,2014,45:347-354.
[5]CORESTA. No.1-Agrochemical Guidance Residue Levels (GRLs)[EB/OL].[2017-07-17]. https://www.coresta.org/sites/default/files/technical_documents/main/Guide-No01-GRLs4th-Issue-July16.pdf.
[6]CORESTA.No.5-TechnicalGuideline forPesticide Residues Analysis on Tobacco&Tobacco Products(includes Technical Notes)[EB/OL]. [2017-07-17].https://www.coresta.org/technical-guideline-pesticide-resi dues-analysis-tobacco-tobacco-products-includes-technic al-notes.
[7]中国烟草总公司.YQ/T 47.1—2014烟草及烟草制品多种农药残留量的测定第1部分:气相色谱-串联质谱联用法[S].北京:中国标准出版社,2014.
[8]中国烟草总公司.YQ/T 47.2—2014烟草及烟草制品多种农药残留量的测定第2部分:高效液相色谱-串联质谱联用法[S].北京:中国标准出版社,2014.
[9]CHEN X,BIAN Z,HOU H,et al.Development and Validation of a Method for the Determination of 159 Pesticide Residues in Tobacco by Gas Chromatography-TandemMass Spectrometry[J].Journal of Agricultural and Food Chemistry,2013,61(24):5746-5757.
[10]KERKDIJK H,MOL H G J,NAGEL B,Volume Overload Cleanup:An Approach for On-Line SPE-GC,GPC-GC,and GPC-SPE-GC[J].Analytical Chemistry,2007,79(21):7975-7983.
[11]LU D,QIU X,FENG C,etal.Simultaneous determination of 45 pesticides in fruit and vegetable using an improved QuEChERS method and on-line gel permeation chromatography-gas chromatography/mass spectrometer[J].Journal of Chromatography B,2012,895(3):17-24.
[12]GUO W,BIAN Z,TANG G,et al.Analysis of pesticide residues in tobacco with online size exclusion chromatography with gas chromatography and tandem mass spectrometry[J].Journal of Separation Science,2016,39(14):2754-2759.
[13]QI D,FEI T,SHA Y,et al.A novel fully automated on-line coupled liquid chromatography-gas chromatography technique used for the determination of organochlorine pesticide residues in tobacco and tobacco products[J].Journal of Chromatography A,2014,1374:273-277.
[14]YANG F,BIAN Z,CHEN X,et al.Analysis of 118 Pesticides in Tobacco after Extraction With the Modified QuEChRS Method by LC-MS-MS[J].Journalof Chromatographic Science,2014,52(8):788-792.
[15]LI M,JIN Y,LI H,et al.Rapid determination of residual pesticides in tobacco by the quick,easy,cheap,effective,rugged,and safe sample pretreatment method coupled with LC-MS[J].Journal of Separation Science,2013,36(15):2522-2529.
[16]BERNARDI G,KEMMERICH M,RIBEIRO L C,et al.An effective method for pesticide residues determination in tobacco by GC-MS/MS and UHPLC-MS/MS employing acetonitrile extraction with low-temperature precipitation and d-SPE clean-up[J].Talanta,2016,161:40-47.
[17]张小涛,侯宏卫,陈欢,等.液相色谱串联质谱法测定卷烟主流烟气中的苯并[a]芘[J].中国烟草科学,2016,37(6):77-81.
[18]ALAN R,PERFETTI T A.The chemical components of tobacco and tobacco smoke[C].Boca Raton:CRC press,2013.
[19]熊巍,韶济民,庞夙,等.UPLC-MS/MS法测定烟草中12种常用农药残留量[J].中国烟草科学,2015,36(1):5-9.
[20]KITTLAUS S,KEMPE G,SPEER K,Evaluation of matrix effects in different multipesticide residue analysis methods using liquid chromatography-tandem mass spectrometry,including an automated two-dimensional cleanup approach[J].Journal of Separation Science,2013,36(13):2185-2195.
