亚麻子发芽前后化学成分及抗氧化活性的研究
2018-01-18LIURonghuaTSAORong
闫 峻,冯 硕,吴 韬,LIU Rong-hua,TSAO Rong
(1.核工业北京地质研究院,北京 100029;2.加拿大农业部圭尔夫食品研究中心,安大略 圭尔夫 N1G5C9)
亚麻子是亚麻科植物亚麻(Linumusitatissimum, L.)的种子,主产于中国、加拿大、阿根廷和美国等地。在我国,亚麻子以内蒙、宁夏、新疆等地为主产区,是主要经济作物之一,也是高寒地区的主要油料作物之一[1]。研究表明,亚麻子中主要含有木酚素类[2]、多酚类[3]、黄酮类[3]、不饱和脂肪酸类、糖类、环肽类以及氨基酸类化合物[4-5],现已广泛用于保健品及功能性食品的生产[6-7]。
质谱法是分析化合物结构的重要手段之一,利用高效液相色谱-串联质谱联用技术(HPLC/MS2)可以同时完成成分分离和结构鉴定,是研究中药及天然产物复杂体系化学成分最有效的手段之一[8]。
现代研究表明,自由基会损伤机体,与许多疾病的发生和发展有密切关系。传统的合成抗氧化剂虽然抗氧化能力较强,但是长期服用会产生一定的毒性,甚至可能致畸和致癌。寻找有效清除自由基的中药或天然产物对于人类健康具有十分重要的意义[9]。目前,常用的抗氧化活性物质的体外评价方法主要包括铁离子还原能力法(FRAP)、1,1-二苯基-2-三硝基苯肼自由基清除法(DPPH)、氧自由基吸收能力法(ORAC)、电子自旋共振法(ESR)、紫外检测法(UV)和质谱法(MS)等[10]。其中FRAP法和ORAC法具有操作简单、速度快、重复性好等特点[11]。
本研究拟在恒定温度、湿度和光照的条件下使亚麻子发芽,以获得不同发芽时间的样品。采用高效液相色谱-串联质谱联用技术对亚麻子芽的化学成分进行研究,利用紫外分光光度法对亚麻子发芽前(0天)和发芽后(1、2、4、6、8天)样品的总黄酮和总多酚类成分进行定量分析,并采用铁离子还原能力法(FRAP)、自由基清除能力法(DPPH)和氧自由基吸收能力法(ORAC)对亚麻子发芽前和发芽后样品的抗氧化活性进行评价,希望为开发以亚麻子作为原料的保健品以及功能性食品提供可靠的理论依据。
1 实验部分
1.1 仪器
Agilent 1100型高效液相色谱仪:美国Agilent公司产品;Finnigan LCQTM离子阱质谱仪:美国Finnigan公司产品;自动酶标仪:美国Varian公司产品。
1.2 材料与试剂
亚麻子:由加拿大农业部圭尔夫食品研究中心Krista Power研究员课题组提供,并经Tsao Rong研究员鉴定;1,1-二苯基-2-三硝基苯肼、2,4,6-三吡啶基三嗪、抗坏血酸、6-羟基-2,5,7,8-四甲基色满-2-羧基、荧光素钠盐、2,2’-偶氮二(2-脒基丙烷)二盐酸盐:美国Sigma公司产品;甲醇、乙酸(色谱纯):美国Fisher公司产品;水为超纯水;其他试剂均为分析纯。
1.3 样品制备
精密称取2 g干燥亚麻子,在水中浸泡过夜,弃去水,将浸泡过的亚麻子放置在铺有纱布的托盘上,并用纱布覆盖,在25 ℃和80%湿度条件下使其发芽,每12 h加5 mL水以保持亚麻子湿润。分别在第0、1、2、4、6和8天取样品,并测量不同发芽时间样品的长度。将样品冷冻干燥,测量不同发芽时间样品的质量。将冷冻干燥后的样品粉碎,在室温下用80%甲醇振摇提取3次,每次2 h,合并提取液,减压浓缩并干燥。将干燥后的浸膏置于10 mL容量瓶中,用80%甲醇定容至刻度,过0.22 μm滤膜,待测。
1.4 实验条件
1.4.1色谱条件 Phenomenex ODS C18柱(4.6 mm×150 mm×3 μm);柱温25 ℃;进样量10 μL;流动相为0.2%乙酸(A)-甲醇(B);线性梯度洗脱程序:0~40 min(20%~60%B),40~50 min(60%~100%B),50~52.5 min(100%~20%B),52.5~60 min(20%B);流速0.75 mL/min;检测波长280 nm。
1.4.2质谱条件 电喷雾离子源(ESI);正、负离子检测模式;质量扫描范围m/z50~2 000;毛细管温度290 ℃;喷雾电压4.5 kV;壳气(N2)流速1.2 L/min;辅助气(N2)流速1.5 L/min。
1.5 紫外分光光度法测定总黄酮和总多酚
1.5.1总黄酮的含量测定 采用Jia等[12]方法对亚麻子不同发芽时间样品的总黄酮含量进行测定。取儿茶素为对照品,分别配制成0.010、0.040、0.060、0.080和0.100 g/L的溶液,将待测样品配制成干重浓度为25 g/L的溶液。将1 mL对照品或样品溶液分别加入15 mL离心管中,向各离心管中分别加入4 mL蒸馏水、0.3 mL 5% NaNO2溶液,静置5 min后,加入0.3 mL 10% AlCl3溶液,静置1 min,加入2 mL 1 mol/L NaOH溶液,最后加入2.4 mL蒸馏水,涡旋振荡。分别取200 μL各离心管中的溶液加入96孔板中,用自动酶标仪在510 nm波长下测定各孔的吸光度值,每个样品或对照品平行测定3次。测量结果以每克亚麻子干重相当于儿茶素的质量 (catechin equivalent per gram of dry weight, CAE)来表示。
1.5.2总多酚的含量测定 采用Tsao等[13]方法对亚麻子不同发芽时间样品中的总多酚含量进行测定。取没食子酸为对照品,分别配制成0.000、0.040、0.100、0.300和0.500 g/L溶液,将待测样品配制成干重浓度为100 g/L溶液。分别取25 μL对照品或样品溶液加入96孔板中,然后在每孔中加入125 μL 10% Folin-Ciocalteu Reagent (FCR)试剂,静置10 min,加入125 μL 7.5% Na2CO3溶液,静置30 min,用自动酶标仪在765 nm波长下测定各孔的吸光度值,每个样品或对照品平行测定3次。测量结果以每克亚麻子干重相当于没食子酸的质量(gallic acid equivalent per gram of dry weight, GAE)来表示。
1.6 抗氧化活性评价
1.6.1铁离子还原能力法(FRAP) 分别用80%甲醇配制成干重浓度20 g/L的亚麻子不同发芽时间样品溶液,待测。取抗坏血酸(Vc)为对照品,分别配制成1 000、500、250、125和62.5 μmol/L的溶液作为对照品溶液。
将300 mmol/L醋酸钠缓冲溶液(pH 3.6),10 mmol/L 2,4,6-三吡啶基三嗪(TPTZ)溶液(溶解于40 mmol/L的HCl中)和20 mmol/L FeCl3溶液以10∶1∶1(V/V/V)混合,配制成FRAP试剂,随用随配,并避光保存。取10 μL对照品溶液或待测样品溶液加入96孔板中,然后迅速加入300 μL FRAP试剂,37 ℃下测定各孔的吸光度值。每个对照品溶液和待测样品溶液平行测定3次。FRAP法的测量结果以每克亚麻子干重相当于微摩尔Vc的抗氧化能力 (Vc equivalent per gram of dry weight, VcE)来表示。
1.6.2自由基清除能力法(DPPH) 将亚麻子不同发芽时间样品分别用80%甲醇配制成干重浓度为20 g/L的溶液,待测。
将1,1-二苯基-2-三硝基苯肼(DPPH)用甲醇配制成浓度为65 μmol/L的溶液,随用随配,并避光保存。将20 μL甲醇和100 μL DPPH溶液混合作为A0,20 μL待测样品溶液和100 μL DPPH溶液混合作为Ai,20 μL待测样品溶液和100 μL甲醇作为Aj。将以上3种混合溶液避光放置30 min,用自动酶标仪在515 nm波长下分别测定其吸光度值,每个样品平行测定3次,其计算公式为:SA%=[A0-(Ai-Aj)]/A0×100%。DPPH法的测量结果用清除率(%)表示。
1.6.3氧自由基吸收能力法(ORAC) 分别用80%甲醇配制成干重浓度5 g/L的亚麻子不同发芽时间样品溶液,待测。取6-羟基-2,5,7,8-四甲基色满-2-羧基(trolox)对照品,分别配制成100、50、25、12.5和6.25 μmol/L的溶液作为对照品溶液。
取25 μL对照品或待测样品溶液,加入96孔培养板中,随后每孔加入150 μL 8.68×10-5mmol/L的荧光素钠盐,在37 ℃下静置30 min后,每孔加入25 μL 153 mmol/L的2,2’-偶氮二(2-脒基丙烷)二盐酸盐,用自动酶标仪测定1 h内曲线下的峰面积(AUC),每个trolox对照品溶液和待测样品溶液平行测定3次。ORAC法的测量结果以每克亚麻子干重相当于微摩尔trolox的抗氧化能力 (trolox equivalent per gram of dry weight, TE)来表示。
2 结果与讨论
2.1 亚麻子发芽过程中的长度和质量变化
在亚麻子发芽过程中,第0、1、2、4、6和8天的发芽图片示于图1,不同发芽时间亚麻子芽的长度和冷冻干燥后的质量列于表1。由表1可知,随着发芽时间的增加,亚麻子芽的长度逐渐增加,发芽后亚麻子的质量逐渐减小。因为在亚麻子发芽过程中,消耗种子内部能量使其萌发,没有加入外部能量,所以随着发芽时间的增加,亚麻子的质量逐渐减小[14]。

图1 发芽前(a)和发芽1天(b),2天(c),4天(d),6天(e),8天(f)的亚麻子芽Fig.1 Flaxseeds sprouts before germination (a) and after germination for 1 day (b), 2 days (c), 4 days (d), 6 days (e)and 8 days (f)
2.2 亚麻子芽样品化学成分的LC/MS2分析
亚麻子不同发芽时间(0、1、2、4、6和8天)样品的高效液相色谱图示于图2。由图2可知,亚麻子发芽后的样品出现了许多新的色谱峰,说明亚麻子在发芽过程中新产生了部分化合物,且随着发芽时间的增加,新的色谱峰峰面积逐渐增加,说明新产生的化合物含量随着发芽时间的增加而逐渐增加。
采用高效液相色谱-串联质谱联用技术,以亚麻子发芽后第8天的样品为代表,对亚麻子发芽后样品的化学成分进行分析,共鉴别出12个化合物,各化合物的LC/MS2数据列于表2。

表1 不同发芽时间亚麻子芽的长度、质量和发芽率Table 1 Lenth, weight and percentage of germination for flaxseed sprouts during germination

图2 发芽前(a)和发芽1天(b),2天(c),4天(d),6天(e),8天(f)的亚麻子芽样品HPLC谱图Fig.2 HPLC chromatograms of flaxseed before germination (a) and after germination for 1 day (b), 2 days (c), 4 days (d), 6 days (e) and 8 days (f)

序号No保留时间tR/min紫外波长UV/nmm/z(+)m/z(-)质谱数据MS2化合物Compounds1218-365365:203[M+Na-glc]+,蔗糖[15]185[M+Na-glc-H2O]+2248246,273152-鸟嘌呤∗3288260136-腺嘌呤∗4335252284284:152[M+H-rib]+鸟苷∗5359257268268:136[M+H-rib]+腺苷∗61770256,328593593:503[M-H-CH2OHCHOHCHO]-,葡萄糖基芹菜素[16]473[M-H-CH2OH(CHOH)2CHO]-,383[M-H-glc-CHO]-,353[M-H-glc-CH2OHCHO]-72020274,328563563:545[M-H-H2O]-,异夏佛塔苷[17]503[M-H-CH2OHCHO]-,473[M-H-CH2OHCHOHCHO]-,443[M-H-CH2OH(CHOH)2CHO]-,413[M-H-CH2OH(CHOH)3CHO]-,383[M-H-glc]-,353[M-H-glc-CHO]-82094274,328563563:545[M-H-H2O]-,夏佛塔苷[17]503[M-H-CH2OHCHO]-,473[M-H-CH2OHCHOHCHO]-,443[M-H-CH2OH(CHOH)2CHO]-,413[M-H-CH2OH(CHOH)3CHO]-,383[M-H-glc]-,353[M-H-glc-CHO]-92261269,349447447:357[M-H-CH2OHCHOHCHO]-,异荭草苷[16]327[M-H-CH2OH(CHOH)2CHO]-102441271,338431431:341[M-H-CH2OHCHOHCHO]-,牡荆素[17]311[M-H-CH2OH(CHOH)2CHO]-112547272,328563563:503[M-H-CH2OHCHO]-,Apigenin⁃6⁃C⁃glu⁃8⁃C⁃pent[17]473[M-H-CH2OHCHOHCHO]-,443[M-H-CH2OH(CHOH)2CHO]-,383[M-H-glc]-,353[M-H-glc-CHO]-122664269,336431431:341[M-H-CH2OHCHOHCHO]-,异牡荆素[18⁃19]311[M-H-CH2OH(CHOH)2CHO]-
注:*表示化合物与相对应的对照品具有相同的保留时间、质荷比和MS2谱
2.3 亚麻子发芽过程中总黄酮和总多酚类化合物的定量分析
2.3.1线性关系考察 将0.010、0.040、0.060、0.080和0.100 g/L的儿茶素对照品溶液,按照1.5.1节的方法,以吸光度(A)对浓度(C)进行线性回归,得到儿茶素对照品的线性回归方程为:A=2.395 2C+0.039 2,相关系数r=0.999 7。
将0.00、0.04、0.10、0.30和0.50 g/L的没食子酸对照品溶液,按照1.5.2节的方法,以吸光度(A)对浓度(C)进行线性回归,得到没食子酸对照品的线性回归方程为:A=6.820 5C+0.146 9,相关系数r=0.999 2。
2.3.2亚麻子发芽过程中总黄酮和总多酚类成分的含量 亚麻子不同发芽时间样品中总黄酮和总多酚类成分的含量测定结果列于表3。在亚麻子发芽过程中,发芽第1天的样品中总黄酮和总多酚类成分的含量低于发芽前样品中的含量,但随着发芽时间的增加,样品中总黄酮和总多酚类成分的含量逐渐增加。
2.4 亚麻子发芽过程中抗氧化活性的评价
将1 000、500、250、125和62.5 μmol/L的Vc对照品溶液,以吸光度(A)对浓度(C)进行线性回归,得到Vc对照品的线性回归方程为:A=0.001 51C-0.041 9,相关系数r=0.997 5。
按照1.6.2节的方法,分别用自动酶标仪测定A0、Ai和Aj,并计算各样品对DPPH自由基的清除率,以清除率(%)表述样品的抗氧化活性。
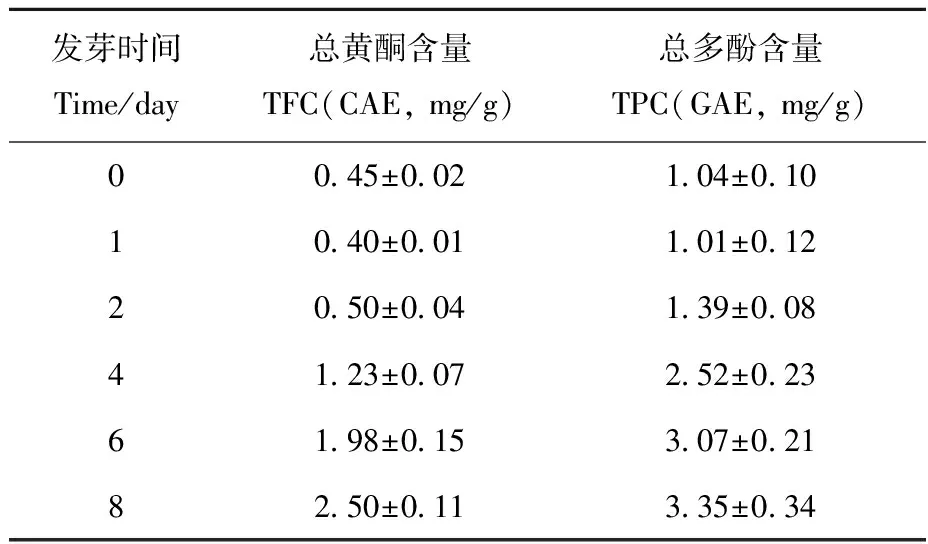
表3 亚麻子发芽过程中总黄酮和总多酚类成分的含量Table 3 Contents of TFC and TPC in flaxseed during germination
将100、50、25、12.5和6.25 μmol/L的trolox对照品溶液,以吸光度(A)对曲线下的峰面积(AUC)进行线性回归,得到trolox对照品的线性回归方程为:A=0.308(AUC)-0.777,相关系数r=0.995 0。
亚麻子不同发芽时间样品的抗氧化活性测定结果列于表4。由表4可知,在亚麻子发芽过程中,发芽第1天的样品的抗氧化活性低于发芽前样品,但随着发芽时间的增加,样品的抗氧化活性逐渐增强。

表4 亚麻子发芽过程中的抗氧化活性Table 4 Antioxidant activity of flaxseed during germination
3 结论
利用高效液相色谱-二级质谱联用(HPLC-MS2)技术对亚麻子芽的化学成分进行研究,结果表明,相比于发芽前,亚麻子发芽后新产生了12个化合物,包括糖类、核苷类、核酸类和黄酮类成分。利用紫外分光光度法对亚麻子发芽前后的总黄酮和总多酚类成分进行定量分析,并采用铁离子还原能力法(FRAP)、自由基清除能力法(DPPH)和氧自由基吸收能力法(ORAC)对亚麻子发芽后的抗氧化活性进行评价。结果表明,亚麻子在发芽第1天总黄酮和总多酚类成分的含量较发芽前降低,抗氧化活性下降,发芽第2天到第8天总黄酮和总多酚类成分的含量逐渐增多,抗氧化活性也逐渐增强。研究表明,黄酮类成分和多酚类成分具有一定的抗氧化活性,也是天然抗氧化剂的主要成分[20-21]。抗氧化活性的研究结果与总黄酮和总多酚含量的测定结果呈正相关,说明亚麻子芽中的黄酮类和多酚类成分可能为其抗氧化活性的主要有效成分,与文献报道的结果一致。发芽是提高亚麻子抗氧化能力的一种有效方法。本研究可为亚麻子作为保健品以及功能性食品的原料提供可靠的理论依据。
[1] 孙兰萍,许辉. 亚麻子生氰糖苷的研究进展[J]. 天然产物研究与开发,2007,32(10):24-27.
SUN Lanping, XU Hui. Research progress on flaxseed cyanogenetic glycoside[J]. China Oils and Fats, 2007, 32(10): 24-27(in Chinese).
[2] POPOVA I E, HALL C, KUBATOVA A. Determination of lignans in flaxseed using liquid chromatography with time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2009, 1 216(2): 217-229.
[3] LI X, YUAN J P, XU S P, et al. Separation and determination of secoisolariciresinol diglucoside oligomers and their hydrolysates in the flaxseed extract by high-performance liquid chromatography[J]. Journal of Chromatography A, 2008, 1 185: 217-229.
[4] 史高峰,孙浩冉,赵艳芳,等. 脱脂亚麻子的化学成分研究[J]. 天然产物研究与开发,2008,20:60-62.
SHI Gaofeng, SUN Haoran, ZHAO Yanfang, et al. Chemical constituents from the defatted seeds oflinumusitatissimumL.[J]. Natural Product Research and Development, 2008, 20: 60-62(in Chinese).
[5] 杜双奎,于修烛,王青林,等. 超声波辅助提取亚麻子油的研究[J]. 中国粮油学报,2009,24(4):70-73.
DU Shuangkui, YU Xiuzhu, WANG Qinglin, et al. Ultrasonic-assisted extraction of oil from flaxseeds[J]. Journal of the Chinese Cereals and Oils Association, 2009, 24(4): 70-73(in Chinese).
[6] 张文斌,许时婴. 亚麻子粘滞物的脱除工艺[J]. 食品与生物技术学报,2006,25(3):93-97.
ZHANG Wenbin, XU Shiying. Study on demucilage process of flaxseed[J]. Journal of Food Science and Biotechnology, 2006, 25(3): 93-97(in Chinese).
[7] 邓乾春,禹晓,黄庆德,等. 亚麻子油的营养特性研究进展[J]. 天然产物研究与开发,2010,22(4):715-721.
DENG Qianchun, YU Xiao, HUANG Qingde, et al. Research progress on nutritional characteristics of linseed oil[J]. Natural Product Research and Development, 2010, 22(4): 715-721(in Chinese).
[8] 周慧,宋凤瑞,刘志强,等. 刺五加叶的HPLC-UV和ESI-MS指纹图谱研究[J]. 质谱学报,2008,29(6):321-326.
ZHOU Hui, SONG Fengrui, LIU Zhiqiang, et al. The fingerprints of leaves ofAcanthopanaxsenticosusby HPLC-UV and ESI-MS[J]. Journal of Chinese Mass Spectrometry Society, 2008, 29(6): 321-326(in Chinese).
[9] 孙丽萍,王大仟,张智武. 11种天然植物提取物对DPPH自由基的清除作用[J]. 食品科学,2009,30(1):45-47.
SUN Liping, WANG Daqian, ZHANG Zhiwu. 2,2-Dipheny-1-picrylhydrazyl radical scavenging activites of eleven spenies of natural plant extracts[J]. Food Science, 2009, 30(1): 45-47(in Chinese).
[10] 黄鑫. 五味子、黄芪化学成分及抗氧化活性的质谱研究[D]. 长春:中国科学院长春应用化学研究所,2009.
[11] 高月红,郑建普,朱春赟,等. 抗氧化能力检测方法评估及微型化[J]. 中国药学杂志,2008,43(24):1 863-1 867.
GAO Yuehong, ZHENG Jianpu, ZHU Chunyun, et al. Evaluation and miniaturization for antioxidant capacity measurement[J]. Chinese Pharmaceutical Journal, 2008, 43(24): 1 863-1 867(in Chinese).
[12] JIA Z S, TANG M C, WU J M. The determination of flavonoid contents in mulberry and their scavenging effets on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.
[13] KHANIZADEH S, REKIKA D, EHSANI-MOGHADDAM B, et al. Horticultural characteristics and chemical composition of advanced raspberry lines from Quebec and Ontario[J]. LWT-Food Science and Technology, 2009, 42(4): 893-898.
[14] WANASUNDARA P, SHAHIDI F, BROSNAN M E. Changes in flax (Linumusitatissmum) nitrogenous compounds during germination[J]. Food Chemistry, 1999, 65(3): 289-295.
[15] 郭明全,宋凤瑞,陈貌连,等. 刺五加寡糖的电喷雾多级串联质谱研究[J]. 高等学校化学学报,2003,24(9):1 577-1 581.
GUO Mingquan, SONG Fengrui, CHEN Maolian, et al. Studies on oligosaccharides fromAcanthopanaxsenticosusharms(AS) by electrospray ionization tandem mass spectrometry(MSn)[J]. Chemical Journal of Chinese Univercities, 2003, 24(9): 1 577-1 581(in Chinese).
[16] MHON T, PLITZKO I, HAMBURGER M. A comprehensive metabolite profiling of isatis tinctoria leaf extracts[J]. Phytochemistry, 2009, 70(7): 924-934.
[17] HAN J, YE M, QIAO X, et al. Characterization of phenolic compounds in the Chinese herbal drugArtemisiaannuaby liquid chromatography coupled to electrospray ionization mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(3): 516-525.
[18] DENG X Y, GAO G H, ZHENG S N, et al. Qualitative and quantitative analysis of flavonoids in the leaves ofIsatisindigaticaFort. by ultra-performance liquid chromatography with PDA and electrospray ionization tandem mass spectrometry detection[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 48(3): 562-567.
[19] FERRERS F, ANDRADE P B, VALENTAO P, et al. Further knowledge on barley (HordeumvulgareL.) leavesO-glycosyl-C-glycosyl flavones by liquid chromatography-UV diode-array detection-electrospray ionization mass spectrometry[J]. Journal of Chromatography A, 2008, 1 182(1): 56-64.
[20] 黄池宝,罗宗铭,宾丽英. 黄酮类化合物抗氧化性与其结构关系的研究[J]. 广东工业大学学报,2000,17(2):71-75.
HUANG Chibao, LUO Zongming, BIN Liying. Study on the relation between structure and antioxygenic activity of flavonoid[J]. Journal of Guangdong University of Technology, 2000, 17(2): 71-75(in Chinese).
[21] WU T, YAN J, LIU R H, et al. Optimization of microwave-assisted extraction of phenolics from potato and its downstream waste using orthogonal array design[J]. Food Chemistry, 2012, 122(4): 1 292-1 298.
