中药麻黄汤的分子药理学机制研究Δ
2018-01-18通辽职业学院药品食品系内蒙古通辽028000
马 江(通辽职业学院药品食品系,内蒙古通辽 028000)
麻黄汤是《伤寒论》中治疗伤寒证的经典方药,由麻黄、桂枝、甘草和杏仁4味中药组成,具有发汗解表、宣肺平喘的功效,临床常用于流行性感冒、支气管炎、支气管哮喘等疾病[1-2]。现代药理学研究认为,麻黄汤的药理学作用包括解热作用、促进汗腺分泌作用、抗炎作用、镇咳作用、扩张支气管和平喘作用等[3-7]。麻黄汤的应用历史已长达千年,关于其药理学作用也已有较多研究,但尽管已知其中含有数百个化合物[8],但其分子药理学机制尚不明确。中医理论认为,中药药效组分可以很好地解释中药治疗病证的作用[9],通过计算机模拟预测,可以在短时间内得到中药的活性化合物群,并预测相关作用靶点,建立分子-靶点网络,从而阐明中药的分子药理学机制。为此,笔者采用文献检索和数据分析的方法对麻黄汤的中药组分进行分析,建立中药组分数据库,利用计算机模拟预测的方法筛选其中的活性化合物,对相关靶点进行预测,探索其治疗伤寒证的分子药理学机制,从而为其临床研究和应用提供理论依据。
1 资料与方法
1.1 麻黄汤的中药组分分析
通过检索已发表相关文献和中国科学院化学数据库、中药综合数据库、草药成分靶点数据库中的相关数据进行分析,获得麻黄汤中所含的所有化合物数据。
1.2 活性化合物的计算机模拟预测
1.2.1 口服生物利用度预测 采用OBioavail 1.1计算机模型[10]对麻黄汤中所含的化合物的口服生物利用度进行预测。首先,用包含足够多的具有口服生物利用度值的化合物建立一个数据集;其次,对建模化合物进行化学描述,用DRAGON 5.4软件获得不同类型的描述符描述化合物的结构信息,进行化合物和关键蛋白质的结合计算,对化合物分子与蛋白质晶体结构的对接进行评分,并将评分分为4个子集,随后使用多元线性回归等模型进行建模分析。选择口服生物利用度>30%的化合物作为候选化合物。
1.2.2 类药性分析 类药性指的是化合物具有药物的一些特性或特定结构。通过软件筛除非类药性化合物,可提高效率。本研究采用Tanimoto系数计算法[11]对麻黄汤中的候选化合物的类药性进行分析,将待预测的化合物的描述符向量与数据库中药物或类药性化合物的描述符向量进行对比,按如下公式计算得到类药性(式中:A表示待测的化合物的描述符向量,B表示数据库中药物或类药性化合物的描述符向量)。选择类药性>0.18的化合物为候选化合物。
将同时满足口服生物利用度和类药性要求的候选化合物定位为活性化合物。当化合物未能同时满足上述两项要求时,若其在麻黄中的含量较大,或其代谢产物却具有较好的生物利用度,也被归为活性化合物。
1.3 靶点预测
确定与麻黄汤药理学作用高度相关的活性化合物之后,利用DrugBank数据库获得蛋白质-靶点信息,从而建立配体-靶点配对集,通过检索文献验证该配对集的可靠性,进而预测活性化合物的作用靶点。
2 结果
2.1 麻黄汤的中药组分分析结果
通过文献检索和数据分析可知,麻黄汤中约含有723个化合物,其中麻黄约含有236个,桂枝约含有115个,甘草约含有287个,杏仁约含有85个。麻黄中主要含有麻黄碱、伪麻黄碱、去甲麻黄碱、去甲伪麻黄碱、N-甲基麻黄碱、甲基麻黄碱、甲基伪麻黄碱、草质素和槲皮素等;桂枝中主要含有香豆素、谷甾醇、查尔酮、肉桂醛、胡萝卜苷、黄杉素和肉桂酮等;甘草中主要含有甘草次酸、光甘草定、甘草苷、新甘草酚、菜豆素、异甘草素和甘草酸等;杏仁中主要含有胆固醇、雌素酮、鲨烯、苦杏仁苷、绿原酸和二十烯酸等。
2.2 活性化合物的计算机模拟预测结果
通过计算机模拟预测,从麻黄汤所含的化合物中共筛选出43个活性化合物,详见表1。
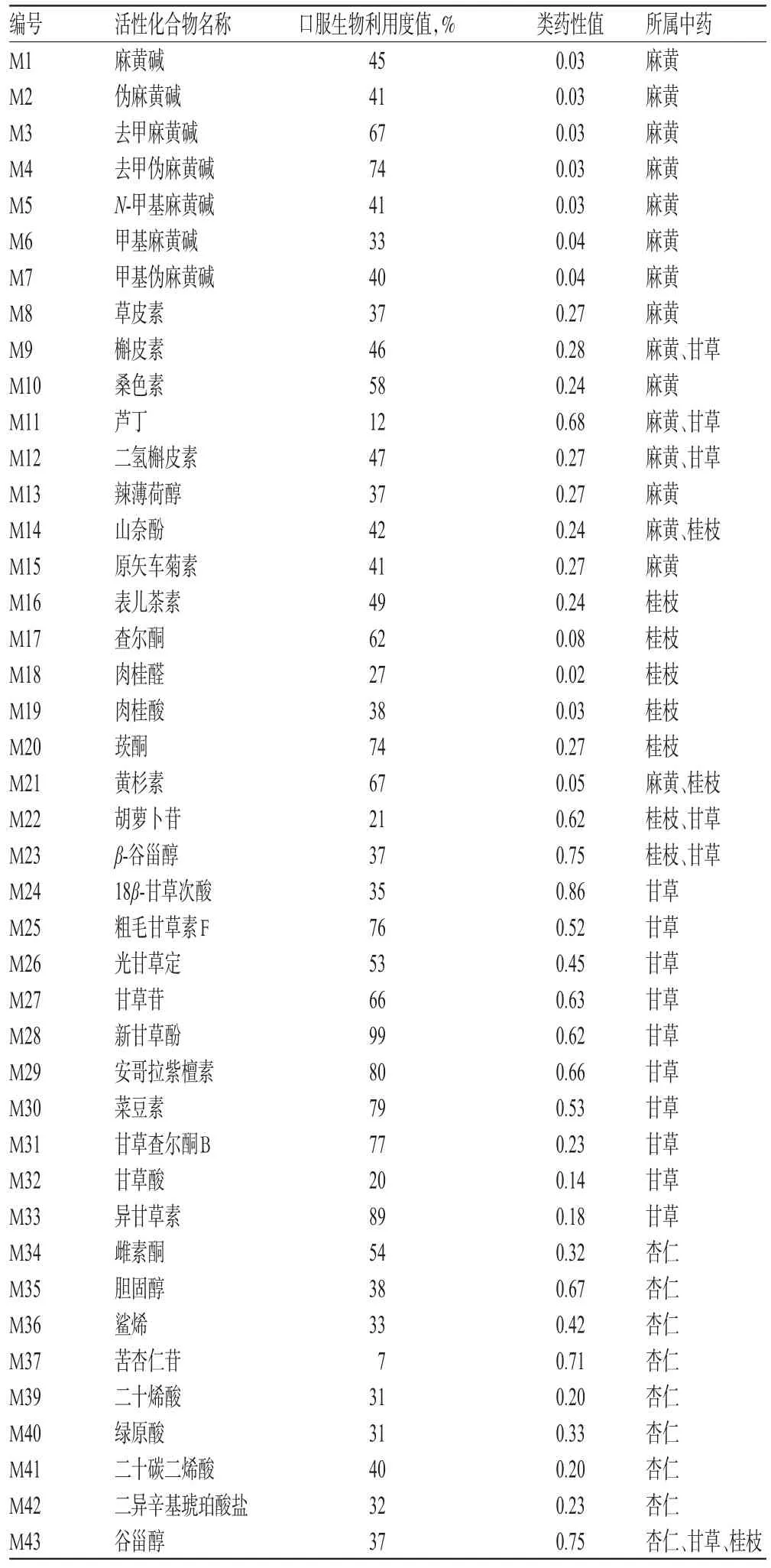
表1 麻黄汤中的活性化合物Tab 1 The active compounds of Mahuang decoction
2.3 靶点预测结果
通过检索相关数据库分析得到18个与麻黄汤药理学作用有关的作用靶点,这些靶点主要与舒张血管作用、肾上腺素样作用和促进平滑肌收缩作用有关(有的靶点可能会发挥多重作用),详见表2(表中,HTR2A:羟色胺受体2A;NOS2:一氧化氮合成酶2型;NOS3:一氧化氮合成酶3型;PTGS1:前列腺素内过氧化物合酶1;PTGS2:前列腺素内过氧化物合酶2;PDE3A:磷酸二酯酶3A;NR3C1:核受体亚家族3C组成员1;ADRA1A:肾上腺素能受体α1A;ADRA1B:肾上腺素能受体α1B;ADRA1D:肾上腺素能受体α1D;ADRA2A:肾上腺素能受体α2A;ADRA2B:肾上腺素能受体α2B;ADRA2C:肾上腺素能受体α2C;ADRB1:肾上腺素受体β1;ADRB2:肾上腺素受体β2;PLAU:尿激酶型纤溶酶原激活因子;CHRM3:毒蕈碱型胆碱受体M3;PPARG:过氧化物酶体增殖物激活受体γ)。
3 讨论
3.1 关于口服生物利用度预测和类药性分析
在药物研发的过程中,化合物的化学结构和性质是决定其能否具有药效的关键因素[12]。口服是药物吸收进入循环系统的主要方式,药物的口服生物利用度由药物在胃肠道中的化学稳定性、胃肠道的吸收过程和肝代谢等多种因素影响[13]。口服生物利用度是衡量药物稳定性和胃肠道吸收的重要参数,因此本研究将其作为麻黄汤中的活性化合物筛选的主要指标之一。类药性是指候选化合物中包含的功能基团与已知药物或类药性化合物的相似程度[14]。在候选化合物筛选时进行类药性分析能够提前筛除一些无活性的化合物,从而节省研究人力和物力。因此,本研究选择类药性作为麻黄汤中的活性化合物筛选的第2个主要指标。
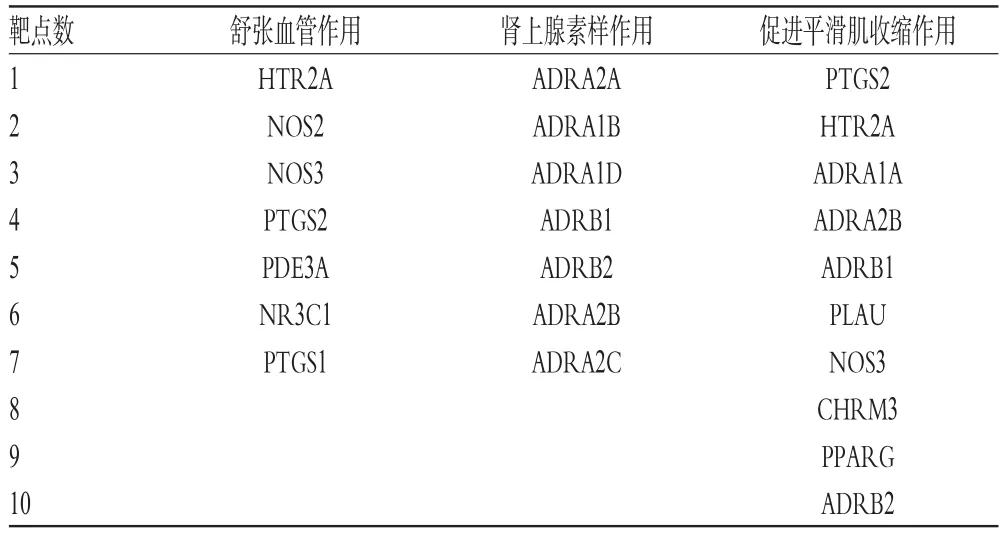
表2 麻黄汤中的活性化合物相关作用靶点Tab 2 Related targets of active compounds of Mahuang decoction
在麻黄汤中,麻黄约含有236个化合物,其中口服生物利用度>30%的化合物占62.4%,类药性>0.18的化合物占14.2%,口服生物利用度和类药性两个指标均符合的化合物有山奈酚、草皮素、槲皮素、桑色素、辣薄荷醇和原矢车菊素等;桂枝约含有115个化合物,其中口服生物利用度>30%的化合物占60.1%,类药性>0.18的化合物占16.5%,口服生物利用度和类药性两个指标均符合的化合物有黄杉素、β-谷甾醇和表儿茶素等,这3个化合物已被证实具有良好的生物学活性[15-17];甘草约含有287个化合物,其中口服生物利用度>30%的化合物占51.0%,类药性>0.18的化合物占20.5%,口服生物利用度和类药性两个指标均符合的化合物有甘草苷、光甘草定、异甘草素、甘草查尔酮B、菜豆素和新甘草酚等,前4个已被证实具有良好的生物学活性[18-19];杏仁约含有85个化合物,其中口服生物利用度>30%的化合物占40.0%,类药性>0.18的化合物占38.5%,口服生物利用度和类药性两个指标均符合的化合物有鲨烯、谷甾醇、胆固醇和二十碳二烯酸等。此外,一些未同时满足口服生物利用度和类药性要求的化合物也被归为活性化合物,主要有两个方面的原因:(1)有些化合物如麻黄碱、伪麻黄碱、去甲麻黄碱、去甲伪麻黄碱和甲基麻黄碱等并不满足类药性指标的要求,但其在麻黄中的含量较大,可达到2.1%~2.4%,由此可弥补其在类药性方面的不足[20]。(2)有些化合物虽然口服生物利用度较低,但其代谢产物却具有较好的生物利用度,如苦杏仁苷的口服生物利用度只有7%,但其水解产物扁桃腈的生物利用度达47%[21]。因此,通过口服生物利用度和类药性计算机模拟预测和筛选,结合化合物在药材中的含量及其代谢转化特征,本研究在麻黄汤所含化合物中筛选出43个活性组分。
3.2 关于靶点预测
本研究根据筛选出的麻黄汤中的43个活性化合物,通过靶点预测和分析得到与其药理学作用有关的18个作用靶点,这些靶点均与发汗、解热作用相关。槲皮素、山奈酚和黄杉素为共有成分,其中槲皮素能够作用于肾上腺素受体,可促进汗腺分泌[22];山奈酚也可促进发汗[23];黄杉素具有舒张血管、降血压和发汗作用[24]。因此,推测这3个活性化合物在伤寒证的治疗中具有十分重要的作用。
通过对相关作用靶点的分析发现,麻黄汤治疗伤寒证的分子药理学机制主要包括以下几方面:(1)血管舒张作用。有 7个预测靶点(HTR2A、NOS2、NOS3、PTGS2、PDE3A、NR3C1和PTGS1)与该作用相关,因此推断麻黄汤可作用于这些靶点促进血管舒张而发挥解热作用。(2)肾上腺素样作用。有7个预测靶点(ADRA2A、ADRA1B、ADRA1D、ADRB1、ADRB2、ADRA2B和ADRA2C)与该作用相关,因此推测麻黄汤可作用于这些靶点产生促肾上腺素效应而促进汗腺分泌,达到发汗的目的。(3)促进平滑肌收缩作用。有10个预 测 靶 点(PTGS2、HTR2A、ADRA1A、ADRA2B、ADRB1、PLAU、NOS3、CHRM3、PPARG 和 ADRB2)与该作用相关,因此推测麻黄汤可作用于这些靶点促进平滑肌收缩,导致机体发热,而产生发汗作用。
4 结论
中药复方是作为整体发挥作用的,可系统地治疗某种疾病。但中药复方多组分多靶点的特性对阐明其分子药理学机制造成了极大困难,使其发展遇到了瓶颈。本研究结合了计算机口服生物利用度预测、类药性分析和靶点预测等方法对麻黄汤的分子药理学机制进行了系统性探索,明确了麻黄汤中的活性化合物是通过舒张血管、促肾上腺素效应和促平滑肌收缩等作用发挥治疗伤寒证的功效,能够为其临床研究和应用提供理论依据。
[1]袁钟瑜,黄千千,蒋岚,等.麻黄汤类方证治规律浅析[J].云南中医中药杂志,2016,37(4):32-33.
[2]朱莹洁.麻黄汤方证研究[D].北京:北京中医药大学,2007.
[3]胡亚男,张建英.麻黄汤发汗作用的实验研究方法概况[J].中国中医药科技,2014,21(2):223-224.
[4]刘国清,贺丰,莫志贤,等.麻黄汤对正常小鼠肛温的影响[J].时珍国医国药,2005,16(12):1199-1200.
[5]林祝山,刘宇聪,林晓春,等.麻黄汤超微饮片与传统饮片药效学剂量对比研究[J].时珍国医国药,2013,24(11):2667-2668.
[6]候养彪,杨涛,张再良.谈对麻黄汤发汗问题的认识[J].长春中医药大学学报,2012,28(1):183-185.
[7]李松蔚,包英.支气管哮喘给予黄芪粉及射干麻黄汤的辅助治疗效果评价[J].现代诊断与治疗,2016,27(7):1177-1179.
[8]郭胜红,柳林伟.中西医结合治疗慢性喘息性支气管炎临床研究[J].中医学报,2016,31(10):1468-1471.
[9]陈月嫦.厚朴麻黄汤加减治疗慢性支气管炎的临床研究[J].大家健康:学术版,2015,9(5):44-45.
[10]Chen ML,Shan V,Patnaik R,et al.Bioavailability and bioequivalence:an FDA regulatory overview[J].Pharmaceutical Research,2001,18(12):1645-1650.
[11]Willett P,Barnard JM,Downs GM.Chemical similarity searching[J].Journal of Chemical Information and Computer Sciences,1998,38(6):983-996.
[12]Leucuta SE.Selecting oral bioavailability enhancing formulations during drug discovery and development[J].Expert Opinion on Drug Discovery,2014,9(2):139-150.
[13]Yoshida F,Topliss JG.QSAR model for drug human oral bioavailability[J].Journal of Medicinal Chemistry,2000,43(13):2575-2585.
[14]Walters WP,Murcko MA.Prediction of“drug-likeness”[J].Advanced Drug Delivery Reviews,2002,54(3):255-271.
[15]Gupta MB,Nath R,Srivastava N,et al.Anti-inflammatory and antipyretic activities of beta-sitosteol[J].Planta Medica,1980(39):157-163.
[16]Trouillas P,Marsal P,Siri D,et al.A DFT study of the reactivity of OH groups in quercetin and taxifolin antioxidants:the specificity of the 3-OH site[J].Food Chemistry,2006,97(4):679-688.
[17]Schroeter H,Heiss C,Balzer J,et al.(-)-Epicatechin mediates beneficial effects of flavanol-rich cocoa on cascular function in humans[J].Proceedings of the National Academy of Science of the United States of America,2006,103(4):1024-1029.
[18]Furusawa J,Funakoshi-Tago M,Mashino T,et al.Glycyrrhiza inflate-derived chalcones,licochalcone A,licochalcone B and licochalcone D,inhibit phosphorylation of NF-κB p65 in LPS signaling pathway[J].International Immunopharmacology,2009,9(4):499-507.
[19]Rauchensteiner F,Matsumura Y,Yamamoto Y,et al.Analysis and comparison of radix glycyrrhizae(licorice)from Europe and China by capillary-zone electrophoresis(CZE)[J].Journal of Pharmaceutical and Biomedical Analysis,2005,38(4):594-600.
[20]Andraws R,Chawla P,Brown DL.Cardiovascular effects of ephedra alkaloids:a comprehensive review[J].Progress in Cardiovascular Disease,2005,47(4):217-225.
[21]Rauws AG,Moyer TP,Kovach JS,et al.Pharmacology of amydalin(laetrile)in cancer patients[J].Cancer Chemotherapy and Pharmacology,1981,6(1):51-57.
[22]孙怡,顾君.槲皮素抑制乳腺癌细胞迁移侵袭及分子机制研究[J].中国中药杂志,2015,40(6):1144-1150.
[23]Sanli S,Lunte C.Determination of eleven flavonoids in chamomile and linden extracts by capillary electrophoresis[J].Analytical Method,2014,6(11):3858-3864.
[24]丁豪,杨海燕,辛志宏.昆仑雪菊黄酮类化合物的抗氧化相互作用研究[J].食品科学,2015,36(21):26-32.
