微生物发酵床中黄腐酸生产菌株的筛选及其鉴定
2018-01-17冀颐之赵有玺程艳玲刘涛杨昊龚平
冀颐之,赵有玺,程艳玲,刘涛,杨昊,龚平
(北京联合大学生物化学工程学院生物质废弃物资源化利用北京市重点实验室,北京100023)
纤维素是世界上产量最大的一类可降解、可再生的能源物质,它存在于各种有机固体废弃物中,如秸秆、谷壳、水果渣中。我国秸秆资源丰富,发改委和农业部2015年联合公布的数据,全国秸秆理论资源量为10.4亿吨,可收集资源量为9亿吨[1]。畜禽粪便是另一类产量巨大且纤维素含量丰富的有机固体废弃物。据行业统计,全国每年产生38亿吨畜禽粪污,综合利用率不到60%[2-3]。我国食品工业每年产生大量的水果副产物,如苹果渣、菠萝渣等富含木质纤维素的果渣[4-5]。利用这些有机废弃物生产附加值较高的黄腐酸,可实现农作物、水果副产物的资源化利用,产生巨大的社会效益和经济效益。
腐植酸(humic acid,HA)是生物有机质在微生物的分解转化下,经由长期的反应和积累,而得到的一类结构功能十分复杂的混合物[6]。按照不同的溶解性,将腐植酸分为三大类:溶于酸、碱和水的为黄腐植酸;溶于乙醇、碱的为棕腐植酸;只溶于碱的为黑腐植酸[7-8]。其中黄腐酸(fulvic acid,FA)是最具活性的一种成分,与腐植酸其他成分相比,具有分子量小,渗透能力强,易被生物吸收利用,功能团含量多,生物活性大等特点[9]。作为改良土壤剂[10]、促进植物生长发育剂[11]、植物生长调节剂[12]、饲料添加剂[13]等在农业领域中获得了迅速的推广和应用,具有重要发展潜力。提高腐植酸中黄腐酸的含量,可提升堆肥品质,是一条资源化利用的高效途径。目前,国内生物腐植酸的研究与生产还处于初级阶段,生物腐殖酸的发酵主要是人工堆建发酵法[14],而性能优良的黄腐酸生产菌株的筛选对于缩短发酵周期、提升堆肥品质起着关键的作用。
发酵床养殖是近几年国家大力推广的一种现代化生态养殖模式。利用微生物,在以木屑等构成的发酵床中,高效分解畜禽排泄的粪尿、消除恶臭,并最终将粪尿转化形成人工腐植质,同时实现了禽畜养殖污染的原位微生物治理和废弃物的资源化利用,是一种全新的环境养殖方式[15]。发酵床在自然发酵过程中富集了丰富的土著微生物资源,其中垫料主要是由椰糠、谷壳、木屑等高纤维材料构成,在发酵后期,可形成大量的腐植酸[16]。特定的生存环境为筛选高效降解木质纤维素生产黄腐酸的菌株提供了可靠来源[17-18]。
本论文以北京京郊奶牛养殖场发酵床土著微生物为基础,分离筛选黄腐酸生产菌株,为采用微生物技术进行农业和食品业有机固体废弃物的资源化利用,提升产品品质,实现循环农业和低碳经济提供奠定一定的技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种分离来源
发酵床样品:北京京郊某奶牛养殖场。
1.1.2 培养基
细菌分离培养基:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂 20 g/L,pH 7.2~7.4。
放线菌分离培养基:可溶性淀粉20 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,KNO31 g/L,NaCl 0.5 g/L,FeSO40.01 g/L,琼脂 20 g/L,pH 7.2~7.4。使用前每升培养基中加入3%重铬酸钾溶液3.3 mL。
霉菌分离培养基:葡萄糖10 g/L,蛋白胨5 g/L,K2HPO41 g/L,MgSO4·7H2O 0.5 g/L,孟加拉红 33.4 mg/L,pH自然。灭菌后每升培养基中加入1%链霉素3 mL。
种子培养基:酵母浸粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH 自然。
玉米秸秆固态培养基:40目玉米秸秆粉20 g,(NH4)2SO40.5 g,麸皮1 g,蔗糖 0.15 g配料时加水混匀,物料水分以手捏混合料能成块,指尖有水渗出但不滴落为宜,装入500 mL三角瓶中,121℃灭菌20 min。
1.2 仪器与设备
生化培养箱(LRH-150型):上海一恒科学仪器有限公司;高温高压灭菌锅(GI54T型):致维仪器有限公司;单人单面净化工作台(SW-CJ-1FD型):苏州净化有限公司;凝胶成像系统(GelDoc2000型):美国伯乐(Bio-RAD)公司;PCR扩增仪(ABI9700型):美国应用生物系统公司。
1.3 方法
1.3.1 耐高温菌株的筛选
称取10 g发酵床样品,放入盛有100 mL无菌水并带有玻璃珠的锥形瓶中,振摇10 min后,分别吸取菌液进行梯度法稀释,并取适宜稀释度的液体分别涂布于细菌分离培养基、放线菌、霉菌分离培养基平板,倒置于45℃恒温箱中培养。挑取平板上生长良好,且形态特征不同的单菌落,进一步纯化后,转接于斜面培养,并置于冰箱4℃条件下保存。
1.3.2 黄腐酸生产菌株的筛选
将初筛菌株以10%的接种量接入玉米秸秆固态培养基中,45℃生化培养箱培养20 d。发酵过程每天补充无菌水5 mL,以补充蒸发的水分。
1.3.3 黄腐酸生产菌株的分类鉴定
1.3.3.1 形态学特征
将纯化后的菌株接种于LB固体平板培养基上,37℃培养24 h后观察其菌落生长情况和形态。挑取单个菌落制成玻片,革兰氏染色[19],置于光学显微镜下,400×,观察各菌株的显微形态。
1.3.3.2 分子生物学鉴定
采用细菌菌株的通用引物:正向引物27F 5’-AGAGTTGATCCTGGCTCAG-3’;反向引物 1492R:5’-GGTTACCTTGTTACGACTT-3’;进行菌落 PCR,扩增16srDNA。
PCR反应体系:10×Buffe(r含Mg2+)2 μL,dNTP(各2.5 mmol/L)2 μL,F(10 μmol/L)2 μL,R(10 μmol/L)2 μL,Taq DNA 聚合酶 0.5 μL,加双蒸水至 20 μL。
PCR扩增程序为:95℃预变性5 min;95℃变性30 s,53℃退火30 s,72℃延伸 90 s,25个循环;72℃修复延伸7 min;最后4℃终止反应。
扩增产物用0.8%的琼脂糖凝胶电泳回收,纯化后的产物测序后获得的16SrDNA序列,登录http://blast.ncbi.nlm.nih.gov/Blast.cgi网站,用Blast程序进行序列比对分析,选取与之相似性高的菌16SrDNA序列,使用MEGA 5.0软件比对、分析、构建系统发育树,Bootstrap 1000次进行稳定性验证。
1.3.4 纤维素、半纤维素及木质素的测定
参考侯勇等[20]的方法,进行纤维素、半纤维素及木质素的测定。
其中降解率计算公式为:
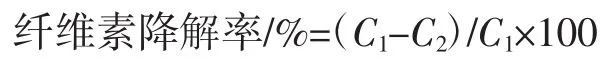
式中:C1为发酵前纤维素含量,g;C2为发酵后纤维素含量,g。

式中:H1为发酵前半纤维素含量,g;H2为发酵后半纤维素含量,g。
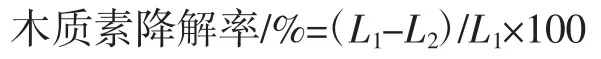
式中:L1为发酵前木质素含量,g;L2为发酵后剩余木质素含量,g。
1.3.5 黄腐酸的测定
采用重铬酸钾氧化法进行黄腐酸测定[20]。
其中黄腐酸产量计算公式为:
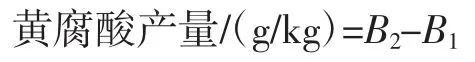
式中:B1为发酵前体系中黄腐酸含量,g/kg;B2为发酵后体系中黄腐酸含量,g/kg。
2 结果与分析
2.1 耐高温菌株的筛选
生化黄腐酸发酵通常采用高温好氧发酵工艺,发酵中期温度会上升至45℃以上进入高温发酵阶段,嗜温微生物生长繁殖受到抑制[21-22],因此黄腐酸发酵需要筛选嗜热性微生物。从奶牛养殖场发酵床中采样,通过平板稀释法涂布于细菌分离培养基、放线菌、霉菌分离培养基平板上,45℃培养4 d。试验发现,放线菌、霉菌分离培养基上并未有菌落生长。从细菌分离培养基上选取生长良好的嗜热性微生物,并根据不同菌种形态特征,最终筛选出7株菌,分别编号为:DLS01、DLS02、DLS03、DLS04、DLS05、DLS06、DLS07 作为本研究初筛耐高温发酵菌株,用于后续试验。
2.2 黄腐酸生产菌株的筛选
2.2.1 分离菌株黄腐酸产量的测定
将初筛获得的7株耐高温菌株接种于玉米秸秆固态培养基中,45℃发酵20 d,测定其黄腐酸含量。分离菌株的黄腐酸产量见图1。
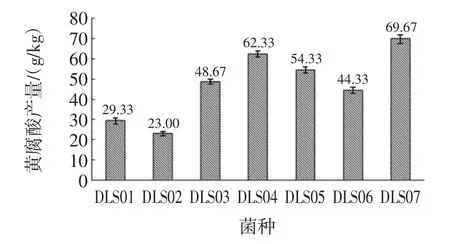
图1 分离菌株的黄腐酸产量Fig.1 The fulvic acid production of the isolated strains
从图1可知,7株菌均能生产黄腐酸,其中DLS07号菌黄腐酸含量最高,达到69.67g/kg,具有较好的黄腐酸生产性能。利用有机固体废弃物生产黄腐酸,其原料中木质纤维素含量较高,难以利用,大大的限制了发酵的进程[23],生产菌株木质纤维素降解能力对发酵有着非常重要的影响,因此同时考察了7株黄腐酸生产菌对木质纤维素的降解能力。
2.2.2 分离菌株木质纤维降解率的测定
将以上7株菌接入玉米秸秆固态培养基中,45℃发酵20 d,测定其对木质纤维素的降解率,结果如图2所示。
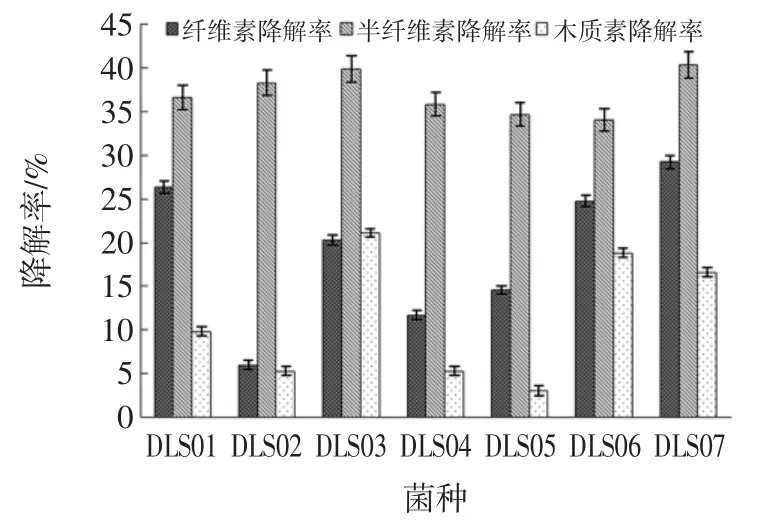
图2 分离菌株的木质纤维素降解率Fig.2 The degradation rate of cellulose,hemi cellulose and lignin by the isolated strains
从图2中可以看出纤维素降解率最大的为菌株DLS07,降解率为29.26%。其次为菌株DLS01和DLS06,纤维素降解率分别为26.4%和24.77%;半纤维素降解能力最强的菌株仍是DLS07,其半纤维素降解率可达到40.33%,其余菌株半纤维素降解能力相差不大,在34%~40%左右;通过微生物发酵,各试验组木质素降解幅度在3%~21%之间,由图2可知,降解木质素能力最强的菌株是DLS03,其降解率为21.11%,而DLS07对木质素的降解能力表现一般,仅为16.6%。
天然木质纤维素中纤维素同半纤维素交联,并被与半纤维素共价相连的木质素所包裹,从而形成了一个高度有序的致密结构,难以处理和利用[24-25]。在自然状态下,纤维素、半纤维素和木质素的分解是多种微生物协同作用的结果。采用多菌株混合发酵,利用不同菌种间酶的多样性,可提高纤维素的转化率[24]。菌株DLS07具有良好的黄腐酸生产性能及纤维素、半纤维素降解能性能,而木质素降解性能一般。菌株DLS03具有良好的木质素降解能性能。两株菌又同为养殖场发酵床土著微生物,可形成稳定的复合体系,因此选择DLS3和DLS07进行复合菌剂发酵试验。
2.2.3 黄腐酸复合菌剂发酵试验
选择DLS03和DLS07,1∶1进行复配,在玉米秸秆固态培养基中进行黄腐酸发酵试验,20 d后测定其生化黄腐酸含量,复配试验组生化黄腐酸含量达到了76.73 g/kg,较DLS03、DLS07单菌发酵的黄腐酸产量47.93、69.63 g/kg分别高出37%、9%,说明复合发菌剂发酵可以更为有效的降解有机固体废弃物中的木质纤维素,将其转化为具有生物活性物质黄腐酸,使其变废为宝,现实生态循环。复合菌剂和单菌发酵的木质纤维素降解率见图3。
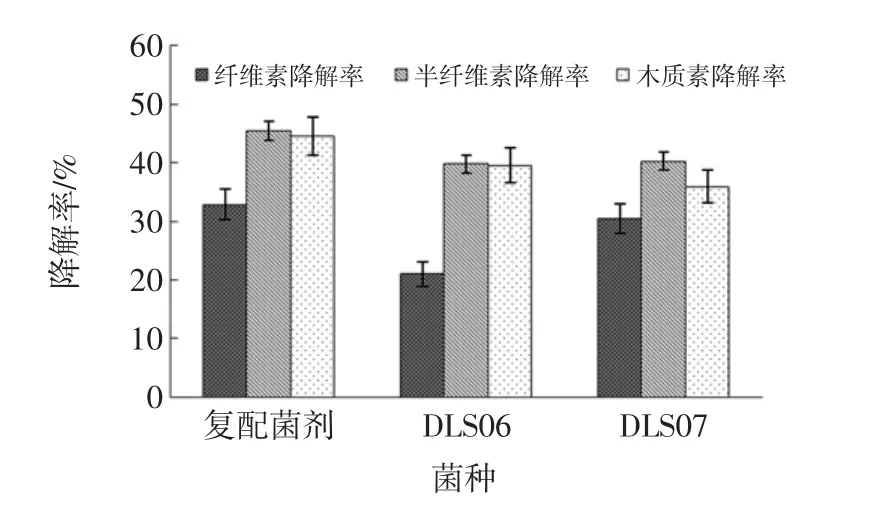
图3 复合菌剂和单菌发酵的木质纤维素降解率Fig.3 The degradation rate of cellulose,hemi cellulose and lignin by the mixed cultures and single strain
复合菌剂的木质纤维素降解率测定结果表明,微生物经过复配之后,对纤维素、半纤维素、木质素的降解率均有所提高,结果如图3所示,分别达到32.87%、45.46%、44.55%,比降解率较好的单菌发酵试验组分别提高了7%、11%、11%。木质纤维素降解是腐植质发酵过程中的限速步骤[23],在复合菌剂在微生物的共同作用下,增强了底物的降解效率,为黄腐酸的合成提供了更多的前体物质,进一步提高了黄腐酸产量。
2.3 菌株DLSO3、DLS07的鉴定及进化树构建
2.3.1 菌落形态特征观察
37℃培养24 h后对菌株DLS03、DLS07进行菌落形态及显微特征的观察,对应的菌落特征和显微特征结果见表1。

表1 菌株菌落形态及显微特征Table 1 Colonial and microscopic characteristics of the isolatedstrains
2株菌均属于细菌,电子显微镜下观察革兰氏染色后个体形态图如图4所示,DLS03、DLS07均为革兰氏阳性菌,显微下两种菌均呈杆状。

图4 菌株DLS03和DLS07的革兰氏染色观察Fig.4 Gram staining of strain DLS03 and DLS07
菌株DLS03和DLS07的菌落形态观察见图5。
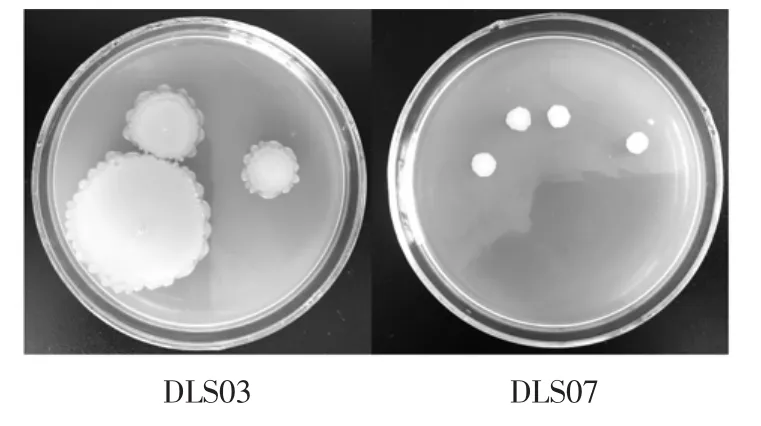
图5 菌株DLS03和DLS07的菌落形态观察Fig.5 Colonial characteristics of strain DLS03 and DLS07
2.3.2 分子生物学鉴定
菌株DLS03和DLS07的16S rDNA PCR扩增结果见图6。
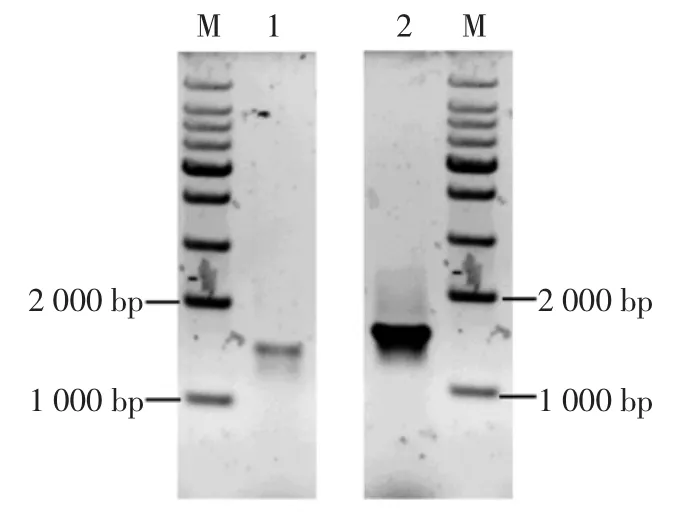
图6 菌株DLS03和DLS07的16S rDNA PCR扩增结果Fig.6 Electrophoresis of PCR amplification products of bacterial 16S rDNA from DLS03 and DLS07
分析了菌株DLS03、DLS07的16S rRNA基因序列,其片段长度均为1 456 bp,经基因序列比对分析,发现DLS03与Bacillus subtillis strain ccm9相似度最高为100%,DLS07与Bacillus liDLSeniformis strain CGMCC 2876相似度最高为99%,基于它们的16S rRNA基因序列所构建的系统发育进化树如图7、8。根据试验结果,初步确认DLS03为枯草芽孢杆菌,DLS07为地衣芽孢杆菌。
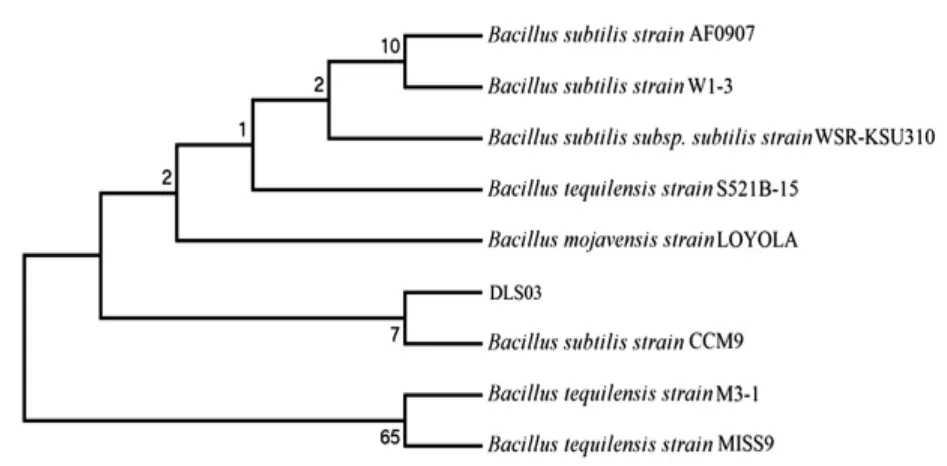
图7 菌株DLS03 16S rDNA系统发育树Fig.7 Phylogenetic tree of strain DLS03 based on 16S rDNA sequence

图8 菌株DLS07的16S rDNA系统发育树Fig.8 Phylogenetic tree of strain DLS07 based on 16S rDNA sequence
3 结论
以北京京郊奶牛养殖场发酵床土著微生物为基础,经分离筛选获得7株45℃条件下生长良好的耐高温菌株,其中DLS03和DLS07菌株是具有良好木质素纤维素降解能力的黄腐酸生产菌株,经16S rDNA基因序列分析,初步确认DLS03为枯草芽孢杆菌,DLS07为地衣芽孢杆菌。这一结果和相关文献报道基本一致[14-15,26]。研究发现,发酵床垫料中存在着种类多样的芽孢杆菌,是主要的土著菌种。芽孢杆菌生长迅速,承担了发酵菌群中高温发酵的工作,可分解复杂有机物,具有木质纤维素分解能力[15,26]。而黄腐酸的形成与木质纤维素的降解存在的一定的关系,其中腐殖酸形成的多酚学说认为微生物将秸秆等降解成酚类和氨基酸类,化学氧化后,两者聚合形成腐殖质[28]。微生物发酵床主要成分为椰糠和谷壳等高纤维材料,所构建出的生存环境适合于能降解纤维的微生物生存[14],选取发酵床作为菌种来源,有利于高效利用木质纤维素的黄腐酸生产菌株的发现,目前还未见此类报道。
目前,越来越多的研究表明,高纤维固体废弃物的降解,主要依赖于纤维素、半纤维素、木质素分解菌株的协同作用,多菌混合发酵,可提高纤维素的转化率[27,29]。因此,选择将筛选所得能较好降解纤维素、半纤维素的黄腐酸生产菌株DLS07与木质素降解能力较好的菌株DLS03进行1∶1复配,发酵生产黄腐酸,研究表明,复合菌剂试验组纤维素、半纤维素、木质素的降解率及黄腐酸产量均高于单菌发酵。目前,黄腐酸发酵菌剂的复配多采用降解木质纤维素的真菌与黄腐酸产量较高的细菌共同混合的方式[30-31],而芽孢杆菌相比霉菌、酵母等真菌具有更好的高温耐受性[32]。本论文所筛选的复配菌株DLS03和DLS07均为芽孢杆菌,具有耐高温,耐受不良环境等特点,将其开发为复配菌剂资源化利用有机固体废弃物生产黄腐酸更具发展潜力,为腐植酸产业发展提供了有利的技术支撑。
[1]中华人民共和国发展改革委员会,农业部.关于编制“十三五”秸秆综合利用实施方案的指导意见[Z].2016
[2]王宇波,张珍.集约养殖粪污能源工程的经济性分析[J].可持续发展,2016,6(3):223-230
[3]张海滨,孟海波,沈玉君,等.好氧堆肥微生物研究进展[J].中国农业科技导报,2017,19(3):1-8
[4]耿乙文,靳婧,李庆鹏,等.不同产地苹果渣营养成分差异性分析研究与评价[J].核农学报,2016,30(2):0288-0294
[5]罗萍,陈永辉,贺军军,等.菠萝渣纤维素降解菌的筛选及鉴定[J].核农学报,2011,31(2):39-42
[6]刘洋,张娟,陈丙波.腐植酸类物质的生物学特性及应用研究进展[J].畜禽业,2015(5):18-20
[7]赵世翔,于小玲,李忠徽,等.不同温度制备的生物质炭对土壤有机碳及其组分的影响:对土壤腐殖物质组成及性质的影响[J].环境科学,2017,38(2):769-782
[8]Zhou Y,Selvam A,Wong JW.Evaluation of humic substances during co-composting of food waste,sawdust and Chinese medicinal herbal residues[J].Bioresource Technology,2014,168(3):229-234
[9]汪善锋,汪海峰,陈安国,等.生化黄腐酸的应用效果与作用机理[J].中国饲料,2004(22):12-13
[10]周爽,其力莫格,谭钧,等.腐植酸提高土壤氮磷钾养分利用效率的机制[J].腐植酸,2015(2):1-8
[11]周爽,倪志强,张卫红,等.腐植酸钾生产工艺及其在农业中的应用[J].腐植酸,2016(6):9-15
[12]梁太波,王振林,王汝娟,等.腐植酸钾对生姜根系生长发育及活性氧代谢的影响[J].应用生态学报,2007(4):813-817
[13]王艳辉,王素梅,王润霞.生化黄腐酸的作用机理及在动物生产中的应用效果[J].饲料博览,2015(4):39-42
[14]赵莹,邱宏端,谢航,等.发酵蔗渣产黄腐酸菌种的筛选及应用[J].福建农业学报,2012,27(8):883-887
[15]胡海燕,于勇,张玉静,等.发酵床养猪废弃垫料的资源化利用评价[J].植物营养与肥料学报,2013,19(1):252-258
[16]刘国红,刘波,王阶平,等.养猪微生物发酵床芽胞杆菌空间分布多样性[J].生态学报,2017,37(20):1-19
[17]秦竹,周忠凯,顾洪如,等.发酵床生猪养殖中菌种与垫料的研究进展[J].安徽农业科学,2012,40(30):14771-14774,14822
[18]毕泗伟,吴祖芳,虞耀土.16S rDNA基因文库技术分析发酵床细菌群落的多样性[J].宁波大学学报(理工版),2013,26(1):18-22
[19]沈萍,范秀容,李广武.微生物学实验[M].3 版.北京:高等教育出版社,1999:28-30
[20]侯勇.秸秆发酵制取生化腐殖酸过程中的理化特性及微生物学特性研究[D].雅安:四川农业大学,2013
[21]Ishii K,Fukui M,Takii S.Microbial succession during a composting process as evaluated by denaturing gradient gel electrophoresis analysis[J].Journal of Applied Microbiology,2001,89(5):768-777
[22]Karadag D,Ozkaya B,Olmez E,et al.Profiling of bacterial community in a full-scale aerobic composting plant[J].International Biodeterioration&Biodegradation,2013,77:85-90
[23]张晶.基于发酵床养猪废弃垫料的纤维素分解菌筛选及其堆肥理化特性的研究[D].南昌:江西农业大学,2012
[24]文少白,李勤奋,侯宪文.微生物降解纤维素的研究概况[J].中国农业科学,2010,26(1):231-236
[25]Weimer PJ,Lopez-Guisa JM,French AD.Effect of cellulose fine structure on kinetics of its digestion by mixed ruminal microorganisms in vitro[J].Applied and Environmental microbiology,1990,56(8):2421-2429
[26]张学峰,周贤文,陈群,等.不同深度垫料对养猪土著微生物发酵床稳定期微生物菌群的影响[J].中国兽医学报,2013,33(9):1458-1462
[27]Souichiro Kato,Shin Haruta,Zong Jun Cui,et al.Effective cellulose degradation by a mixed-culture system composed of a cellulolytic Clostridium and aerobic non-cellulolytic bacteria[J].FEMS Microbiology Ecology,2004,51(1):133-142
[28]李学垣.土壤化学[M].北京:高等教育出版社,2001:46-47
[29]吕志伟,呼晓明.利用菌群LCM9发酵玉米秸秆生产生化黄腐酸及其应用研究[J].安徽农业科学,2010,38(35):20466-20468
[30]刘陶.利用甜高梁秸秆汁发酵生化黄腐酸复合生物液肥及其应用的研究[D].西安:西北大学,2005
[31]惠有为,赵亚玲,赵健,等.果渣固体发酵生产黄腐酸[J].西北大学学报(自然科学版),2005,35(6):746-750
[32]Cahyani V R,Matsuya K,Asakawa S,et al.Succession and phylogenetic profile of eukaiyotic communities in the composting process of rice straw estimated by PCR-DGGE analysis[J].Biology and fertility of soils,2004,40(5):334-344
