大孔树脂纯化酸浆果实多酚及其生物活性研究
2018-01-17王艳丽许惠芳郭瑜王晓闻
王艳丽,许惠芳,郭瑜,王晓闻
(山西农业大学食品科学与工程学院,山西太谷030801)
酸浆 [Physalis alkekengi L.var.franchetii(Mast)Makino)]为一种茄科酸浆属,野生性强且营养价值较丰富的水果蔬菜[1]。其中含有丰富的生物活性成分,有研究证明酸浆具有降血糖[2]、降血脂[3]、抗氧化[4]、抗癌[5]、抗炎[6]、抑菌[7]等生物活性,具有药食两用的价值。
酚类物质是植物的主要次生代谢产物之一,已被研究证实多酚类化合物具有抗氧化、抗肿瘤[8]、抗炎[9]、抗病毒、抗血栓形成和抗动脉硬化[10]等重要作用。
目前对酸浆的研究主要集中在苦素类[11]、多糖类[12-13]、皂苷类[6-7]、黄酮类[1]、生物碱类[14]等生物活性的分析。从现已发表的文章资料来看,国内外对酸浆果实中酚类化合物的研究较少,以及其在体外的抗氧化活性和酶抑制活性尚未见报道。
因此本实验以乙醇为溶剂提取酸浆果实多酚,针对酸浆果实多酚的性质特点选择合适的大孔树脂进行初步纯化,来探讨酸浆果实多酚在体外的抗氧化活性以及对酶活性的抑制作用,为进一步研究酸浆果实多酚在体内对糖、脂代谢的影响提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
酸浆:原料采自山西省大同市阳高县。
树脂:ADS-17、AB-8、D101、NKA、NKA-9、NKAII、HP-20、XAD-16和HPD-826均购自沧州宝恩吸附材料科技有限公司,各树脂的物理特性见表1。

表1 9种大孔吸附树脂的物理特性Table 1 Physical characteristics of nine macroporous resins
1.1.2 试剂
Folin-Ciocalteu、没食子酸(索莱宝试剂有限公司)、DPPH、Trolox、2,4,6-三吡啶基三嗪(2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ)、Tris-HCI缓冲液、二甲基亚砜(Dimethyl sulfoxide,DMSO)、4-硝基苯基-β-D-吡喃葡萄糖苷(4-Nitrophenyl β-D-glucopyranoside,PNPG)、4-硝基苯基棕榈酸酯(4-Nitrophenyl palmitate,PNPP)、胰脂肪酶、α-淀粉酶、α-葡萄糖苷酶均购自sigma公司。
1.1.3 仪器
JYZ-D51榨汁机:九阳股份有限公司;ST3100 pH计:奥豪斯仪器有限公司;ELx800酶标仪:美国宝特BIo-TeK公司;UV-1200紫外可见分光光度计:上海美谱达仪器有限公司;LD5-10低速离心机:北京雷勃尔离心机有限公司。
1.2 实验方法
1.2.1 样品的制备
将酸浆果实洗净,去梗,用榨汁机破碎,根据实验室前期的研究,按照一定条件对酸浆果实多酚进行提取。
1.2.2 总多酚含量的测定
采用Folin-Ciocalteu法测定[15]。得到吸光度值Y与没食子酸标准溶液浓度X(μg/mL)之间的回归方程为:Y=0.045 8X+0.012 1;R2=0.992 9。
1.2.3 大孔树脂对酸浆果实多酚的初步纯化
参考王若兰[16]、冯进[17]和甘芝霖等[18]的方法。
1.2.3.1 大孔吸附树脂对酸浆果实多酚的静态吸附、解析实验
称取已处理好的各树脂2.0 g于三角瓶中,加入30 mL一定浓度的酸浆果实多酚提取液,于恒温振荡器中(室温,180 r/min)静态吸附24 h,每间隔一定时间检测上清液多酚含量,由公式(1)、(2)计算吸附量和吸附率。将静态吸附24 h后的各树脂进行过滤,用一定量的蒸馏水清洗树脂,再过滤,将其转入三角瓶中,加入40 mL 70%的乙醇溶液,于恒温振荡器中(室温,180 r/min)静态解析24 h,每间隔一定时间检测上清液多酚含量,由公式(3)计算解析率。

式中:Q1为吸附量,mg/g;Q2为吸附率,%;P 为解析率,%;C0为吸附前酸浆果实多酚起始质量浓度,mg/mL;Cr为平衡质量浓度,mg/mL;V1为吸附溶液体积,mL;m为树脂质量,g;C为解析后溶液中总酸浆果实多酚质量浓度,mg/mL;V2为解析液体积,mL。
酸浆果实多酚提取液浓度对吸附率的影响:选用处理好的理想型树脂对不同浓度的样液于恒温振荡器中(室温,180 r/min)静态吸附,24 h后检测上清液多酚含量,由公式(2)计算吸附率。
酸浆果实多酚提取液pH值对吸附率的影响:选用处理好的理想型树脂对不同pH值的样液于恒温振荡器中(室温,180 r/min)静态吸附,24 h后检测上清液多酚含量,由公式(2)计算吸附率 。
不同体积分数的乙醇对解析率的影响:将静态吸附24 h后的树脂进行过滤,用一定量的蒸馏水清洗树脂至无提取液残留,将其转入三角瓶中,加入70%乙醇溶液40 mL,置于恒温振荡器中(室温,180 r/min)静态解析,24 h后检测上清液多酚含量,由公式(3)计算解析率。
1.2.3.2 大孔吸附树脂对酸浆果实多酚的动态吸附、解析实验
将用预处理好的理想型大孔树脂湿法装柱,用去离子水平衡2 h,将适当浓度的酸浆果实多酚提取物用不同的流速上柱,每10 mL收集一管,检测每管流出液的多酚浓度,当流出液的吸光值达到上样液吸光值的1/10时,吸附达到饱和,停止上样,用2 BV去离子水洗去杂质,再用80%的乙醇溶液以一定流速洗脱,以每10 mL收集一管,检测每管流出液的多酚浓度。
1.2.4 酸浆果实多酚的抗氧化活性测定
1.2.4.1 酸浆果实多酚对DPPH·清除能力的测定
参考张瑞妮等[19]的方法稍作改进。各组溶液反应如下:
实验组:40 μL 不同浓度的样品液+160 μL 0.1 mmol/L DPPH 工作液(A1);空白组:40 μL 80%甲醇溶液+160 μL 0.1 mmol/L DPPH 工作液(A0);对照组:40 μL 不同浓度的样品液+160 μL 80%甲醇溶液(A2)。
将以上3组溶液使用96孔板置于暗处反应30 min,于517 nm下测其吸光值,根据公式(4)计算出各待测样品的清除率:
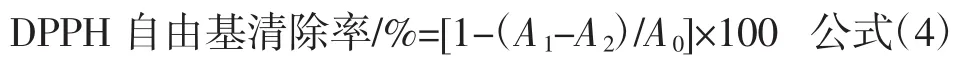
1.2.4.2 酸浆果实多酚对·OH基清除能力的测定
参考邢佳等[20]的方法稍作改进。各组溶液反应如下:
实验组:50 μL不同浓度的样品液+50 μL 6 mmol/L FeSO4溶液+50 μL 6 mmol/L H2O2溶液+50 μL 6 mmol/L水杨酸溶液(A1);空白组:50 μL 6 mmol/L FeSO4溶液+50 μL 6 mmol/L H2O2溶液+50 μL 6 mmol/L 水杨酸溶液+50 μL 80%甲醇溶液(A0);对照组:50 μL 不同浓度的样品液+50 μL 6 mmol/L FeSO4溶液+50 μL 6 mmol/L水杨酸溶液+50 μL 80%甲醇溶液(A2)。
将以上3组溶液置于96孔板中,37℃水浴加热30 min,于510 nm下测其吸光值,根据公式(5)计算出各待测样品的清除率:

1.2.4.3 酸浆果实多酚对Fe2+还原能力的测定
参考王毕妮等[21]的方法稍作修改。
溶液配制:FRAP试剂为0.3 mol/L醋酸缓冲溶液(pH=3.6)∶10mol/LTPTZ(溶于 40mmol/L 盐酸)∶20mmol/L三氯化铁=10∶1∶1(体积比),现配现用。
标样配制:用80%甲醇将1mmol/LTrolox标准溶液稀释,浓度为 0.025、0.100、0.150、0.200、0.500、1 mmol/L,得到以吸光值与Trolox质量浓度之间的回归方程为:Y=0.000 6X-0.012 3;R2=0.996 4。
实验组:50 μL 不同浓度的样品液+245 μLFRAP工作液。
对照组:50 μL不同浓度的各样品液+245 μL80%甲醇溶液。
将以上两组溶液置于96孔板中,37℃反应10min,于593 nm下测其吸光值。样品对Fe2+还原能力以达到同样吸光度所需的Trolox的量表示。
1.2.5 酸浆果实多酚的酶抑制活性测定
1.2.5.1 酸浆果实多酚对胰脂肪酶活性抑制率的测定
参考张丽娜[22]和Paulina Worsztynowicz等[23]的方法稍作改进。各组溶液反应如下:
实验组:100μL不同浓度的样品液+50μL1.2mg/mL PPL+50 μL PNPP(A1);空白组:50 μL 1.2 mg/mL PPL+50 μL PNPP+100 μL 50 mmol/L 缓冲液(A0);对照组:100μL不同浓度的样品液+50μLPNPP+50μL50mmol/L缓冲液(A2)。
将溶液置于96孔板中,混匀后37℃反应5 min,于405 nm处测定其吸光值。根据公式(6)计算出各待测样品的抑制率:

1.2.5.2 酸浆果实多酚对α-淀粉酶活性抑制率的测定
参考袁娟等[24]的方法稍作改进。各组溶液反应如下:
实验组:50 μL 不同浓度的样品液+25 μL 5 mg/mL α-淀粉酶溶液+50 μL 1% 底物+100 μLDNS 溶液(A1)。
空白组:25 μL 5 mg/mL α-淀粉酶溶液+50 μL 1%底物+100 μLDNS 溶液+50 μL 0.02 mol/L 缓冲液(A0)。
对照组:50 μL不同浓度的各样品液+50 μL1%底物+100 μLDNS 溶液+50 μL 0.02 mol/L 缓冲液(A2)。
将不同浓度的各样品液与α-淀粉酶溶液置于96孔板中,混匀后37℃反应20 min,随后加入淀粉溶液,37℃再反应8 min,最后将DNS溶液加入其中,且立即沸水浴5 min以终止反应试验。于540 nm处测定其吸光值。根据公式(7)计算出各待测样品的抑制率:

1.2.5.3 酸浆果实多酚对α-葡萄糖苷酶活性抑制率的测定
参考李波等[25]的方法稍作改进。各组溶液反应如下:
实验组:30μL不同浓度的样品液+50μL0.1mg/mL α-葡萄糖苷酶溶液+50 μL 3 mmol/L PNPG 溶液+100 μL 0.1 mol/L Na2CO3溶液(A1);空白组:30 μL 0.1 mol/L 缓冲液+50 μL 0.1 mg/mL α-葡萄糖苷酶溶液+50 μL 3 mmol/L PNPG 溶液+100 μL 0.1 mol/L Na2CO3溶液(A0);对照组:30 μL 不同浓度的样品液+50 μL 0.1 mol/L缓冲液+50 μL 3 mmol/L PNPG 溶液+100 μL 0.1 mol/L Na2CO3溶液(A2)。
将以上3组溶液的前3种试剂置于96孔板中,37℃水浴加热10 min,最后加入Na2CO3溶液,于540 nm下测其吸光值,根据公式(8)计算出各待测样品的抑制率:

2 结果与讨论
2.1 大孔树脂对酸浆果实多酚的初步纯化
2.1.1 不同大孔树脂对酸浆果实多酚的静态吸附、解析性能
9种大孔树脂对酸浆果实多酚的静态吸附、解析结果见表2、图1。

表2 9种大孔树脂对酸浆果实多酚的静态吸附与解析结果Table 2 Results of static adsorption and desorption rates of nine macroporous resins on Physalis fruit polyphenols

图1 各树脂对酸浆果实多酚的静态吸附曲线Fig.1 Static adsorptive dynamics curves of different types of resins on Physalis fruit polyphenols
从表2可以看出,不同型号的大孔吸附树脂对酸浆果实多酚的吸附和解析效果不同。9种树脂中NKA-9、HPD-826、NKA、AB-8 和 HP-20 的吸附量较大,吸附量可达0.130 0 mg/mL以上,D101树脂和XAD-16树脂的吸附量次之,ADS-17树脂和NKA-II树脂的吸附量最小;吸附率最高的是HP-20树脂,AB-8树脂次之,二者都达到了75%以上,但是AB-8树脂的解析率远远大于HP-20树脂。
从图1的静态吸附曲线中可以看出,9种树脂对酸浆果实多酚的吸附呈先快速上升后平稳型,随着时间的增加各树脂的吸附速率降低,各树脂渐渐达到饱和。
综上考虑,AB-8树脂的吸附量、吸附率和解析率都较高,所以选用AB-8树脂作为纯化酸浆果实多酚的最优树脂。
2.1.1.1 酸浆果实多酚提取液浓度、pH值对AB-8树脂吸附率的影响
AB-8树脂对不同浓度、pH值酸浆果实多酚提取液的吸附性能结果见图2、图3。

图2 酸浆果实多酚浓度对AB-8树脂吸附率的影响Fig.2 Effects of Physalis fruit polyphenols concentration on adsorption capacity of AB-8 resin

图3 样品液pH值对AB-8树脂吸附率的影响Fig.3 Effects of pH value on adsorption capacity of AB-8 resin
从图2可以看出,随着样品液质量浓度的增大,AB-8树脂对样品液的吸附率呈先上升后下降趋势,当样品液的浓度为0.3 mg/mL时,AB-8树脂的吸附率达到最大,吸附饱和,而样品液浓度在0.3 mg/mL~0.4 mg/mL范围时,AB-8树脂的吸附率逐渐下降,因为随着样品液质量浓度的增大,样品液中杂质的量也增加,使得树脂与样品液中多酚物质的有效接触面积下降,因此,选用样品液质量浓度在0.3 mg/mL左右时较为适合。
AB-8树脂对相同浓度不同pH值的样品液进行吸附,从图3中看出,不同样品液pH值对AB-8树脂的吸附率不同。当样品液的pH值为4时,AB-8树脂的吸附率达到最大,而pH值为3和7时,AB-8树脂的吸附效果都较差。因此得出,酸浆果实多酚在中性和强酸性条件下不易被吸附,可能原因是在强酸和中性条件下酸浆果实多酚的性质发生了改变,从而导致样液的吸附率下降。经试验测得,原样品液的pH值约为4.7,所以在进行后续实验中选用样品原液本身的pH值即可。
2.1.1.2 不同体积分数乙醇对AB-8树脂解吸率的影响
将浓度大约为0.3 mg/mL的样品液加入AB-8树脂中进行吸附,待树脂吸附饱和后,用适量的蒸馏水洗去未吸附的样液和杂质,抽滤后向吸附饱和的AB-8树脂中加入相同体积不同体积分数的乙醇溶液进行解析,解析效果见图4。

图4 不同体积分数乙醇对AB-8树脂解析率的影响Fig.4 Influence of ethanol concentration on static desorption percentage of AB-8 resin
从图4可以看出,不同体积分数的乙醇对AB-8树脂的解析率不同。乙醇体积分数为80%时,解析率最大,可达70%以上。乙醇体积分数在60%~80%之间时,解析率的增幅较快,乙醇体积分数在80%以上时,解析率逐渐减小。可能是酸浆果实中的多酚有一小部分为水溶性物质,当乙醇体积分数过高时,水溶性的酸浆果实多酚较难溶出;乙醇体积分数过低时,有机溶剂的含量较少,溶于有机溶剂中的酸浆果实多酚较难溶出,二者都会影响解析效果。所以选用80%乙醇作为最佳的解析溶剂。
2.1.2 AB-8树脂对酸浆果实多酚类物质的动态吸附
2.1.2.1 动态吸附性能曲线
以1mg/mL上样速度为例,将浓度大约在0.3mg/mL的样品液加入装有AB-8树脂的层析柱中,直到流出液的吸光值是原上样液吸光值的1/10时,则停止上样,检测树脂的动态吸附性能,其结果见图5。

图5 AB-8型树脂对酸浆果实多酚的动态吸附曲线Fig.5 Dynamic adsorption curve of AB-8 resin on Physalis fruit polyphenols
从图5可以看出,随着样品液的不断加入,流出液的酸浆果实多酚含量逐渐增大,动态吸附曲线接近理想的S形,并且当上样体积达200 mL时,流出液的质量浓度接近原上样液的质量浓度的1/10,此时AB-8树脂已吸附饱和。
2.1.2.2 上柱流速对吸附效果的影响
将pH值约为4.7、浓度约为0.3 mg/mL的样品液以上柱流速分别为1、2、3、4 mL/min通过AB-8层析柱,流出液每10 mL为单位收集一管,检测上柱流速对AB-8树脂吸附酸浆果实多酚的影响,结果见图6。

图6 上样流速对动态吸附的影响Fig.6 Effect of loading flow rate on dynamic adsorption
从图6可以看出,上样流速为1、2、3、4 mL/min时,随着上样量的增加,AB-8树脂对其吸附的动态效果呈平稳增长型,收集液体积分别在190、170、140 mL和130 mL左右时出现了泄漏点,出现泄漏点最晚的是1 mL/min的上样流速,因为上样流速较慢时,AB-8树脂对酸浆果实多酚的吸附时间较为充分,能够发挥树脂的最大吸附效果,所以选用流速为1 mL/min的上样速度较为合适。
2.1.2.3 洗脱剂流速对洗脱效果的影响
以 80%的乙醇作为洗脱剂,选用 1、2、3、4 mL/min的洗脱速度分别对吸附饱和的AB-8树脂进行洗脱,其洗脱效果见图7。

图7 洗脱剂流速对洗脱效果的影响Fig.7 Desorption curve of Physalis fruit polyphenols from AB-8
从图7可以看出,洗脱速度为3mL/min和4mL/min时,峰形较宽,有明显的拖尾现象,因为洗脱速度过快,洗脱性能不充分,会有拖尾现象;洗脱速度为1 mL/min和2 mL/min时,峰形集中,无拖尾现象,但是二者相比之下,洗脱速度为1 mL/min时,洗脱效果更好。因此,洗脱流速选择1 mL/min较为合适。
2.2 酸浆果实多酚的抗氧化活性测定
2.2.1 酸浆果实多酚对DPPH·清除能力的测定
不同浓度酸浆果实多酚溶液及其对应的DPPH·的清除率,结果见图8。

图8 酸浆果实多酚对DPPH自由基的清除作用Fig.8 Scavenging effects of Physalis fruit polyphenols on DPPH radical
从图8可以看出,随着酸浆果实多酚溶液浓度的增加,对DPPH自由基的清除能力也增强。当酸浆果实多酚溶液浓度在 0.25 mg/mL~4 mg/mL范围时,对DPPH自由基的清除能力呈上升趋势,在4 mg/mL时,酸浆果实多酚对DPPH自由基的清除率达到了60%以上;当清除率达到50%时所对应的酸浆果实多酚浓度为2.262 mg/mL。表明酸浆果实多酚对DPPH自由基有一定的清除作用。
2.2.2 酸浆果实多酚对羟自由基清除能力的测定
不同浓度酸浆果实多酚溶液及其对应的羟自由基清除率,结果见图9。

图9 酸浆果实多酚对羟自由基的清除作用Fig.9 Scavenging effects of Physalis fruit polyphenols on hydroxyl radical
从图9可以看出,随着酸浆果实多酚溶液浓度的增加,对羟自由基的清除能力也增加。当酸浆果实多酚溶液浓度在0.25 mg/mL~2 mg/mL范围时,对DPPH自由基的清除能力呈直线上升趋势;在8 mg/mL时,酸浆果实多酚对DPPH自由基的清除率达到了80%以上;当清除率达到50%时所对应的酸浆果实多酚浓度为0.604 4 mg/mL。表明酸浆果实多酚对羟自由基有一定的清除作用。
2.2.3 酸浆果实多酚对Fe2+还原能力的测定
测定不同浓度的酸浆果实多酚溶液对Fe2+的还原能力,结果见图10。

图10 酸浆果实多酚对Fe2+的还原能力Fig.10 The reduction ability of Physalis fruit polyphenols on Fe2+
酸浆果实多酚的还原能力通过Trolox来表示。从图10可以看出,酸浆果实多酚浓度与其还原亚铁离子的能力呈良好的依赖关系。随着酸浆果实多酚浓度的增加,还原能力也在不断增强。在试验范围内,其还原力在最高浓度时相当于Trolox的量为544.39 μmol/L。表明酸浆果实多酚有一定的还原能力。
2.3 酸浆果实多酚的酶抑制活性测定
2.3.1 酸浆果实多酚对胰脂肪酶活性抑制率的测定
不同浓度酸浆果实多酚溶液及其对应的胰脂肪酶的抑制率,结果见图11。

图11 酸浆果实多酚对胰脂肪酶的抑制作用Fig.11 Inhibitory effect of Physalis fruit polyphenols on pancreatic lipase
在体内脂肪水解过程中胰脂肪酶起到了关键作用,若抑制胰脂肪酶的活性,即可抑制机体对脂肪的水解和消化吸收,减少肥胖的发生[26]。从图11可以看出,随着酸浆果实多酚溶液浓度的增加,对胰脂肪酶的抑制作用也在增强。在试验范围内,对胰脂肪酶的抑制率在最大浓度时为90%,对胰脂肪酶的半数抑制浓度为0.826 2 mg/mL。表明酸浆果实多酚对胰脂肪酶有一定的抑制效果。
2.3.2 酸浆果实多酚对α-葡萄糖苷酶活性抑制率的测定
不同浓度酸浆果实多酚溶液及其对应的α-葡萄糖苷酶的抑制率,结果见图12。

图12 酸浆果实多酚对α-葡萄糖苷酶的抑制作用Fig.12 Inhibitory effect of Physalis fruit polyphenols on αglucosidase
α-葡萄糖苷酶是引起餐后血糖水平提高的关键酶,也是引起Ⅱ型糖尿病发生的关键酶[27]。从图12可以看出,随着酸浆果实多酚溶液浓度的成倍增加,对α-葡萄糖苷酶的抑制作用也在逐渐增强。在试验范围内,对α-葡萄糖苷酶的抑制率在最大浓度时为80%,对α-葡萄糖苷酶的半数抑制浓度为1.011 mg/mL。表明酸浆果实多酚对α-葡萄糖苷酶有一定的抑制效果。
2.3.3 酸浆果实多酚对α-淀粉酶活性抑制率的测定
不同浓度酸浆果实多酚溶液及其对应的α-淀粉酶的抑制率,结果见图13。

图13 酸浆果实多酚对α-淀粉酶的抑制作用Fig.13 Inhibitory effect of Physalis fruit polyphenols on αamylase
α-淀粉酶也是引起餐后血糖水平提高的关键酶,同时也是引起Ⅱ型糖尿病发生的关键酶[26]。从图13可以看出,随着酸浆果实多酚溶液浓度的成倍增加,对α-淀粉酶的抑制作用也在逐渐增强。当酸浆果实多酚溶液浓度在0.25 mg/mL~4 mg/mL范围时,对α-淀粉酶的抑制作用呈直线上升趋势,在4 mg/mL时,酸浆果实多酚对α-淀粉酶的抑制作用达到了90%以上,其对α-淀粉酶抑制率达到一半时的浓度为0.817 8 mg/mL。表明酸浆果实多酚对α-淀粉酶有很好的抑制效果。
3 结论
通过静态、动态的吸附和解析试验,从9种大孔树脂中筛选出的纯化酸浆果实多酚的最适大孔吸附树脂为AB-8树脂,该树脂对酸浆果实多酚有较好的吸附和解析性能,并且进一步研究了AB-8树脂吸附和解析酸浆果实多酚的最佳条件:以样液浓度为0.3 mg/mL、pH为样品本身的pH值、流速为1mL/min上样200mL;用300 mL体积分数为80%的乙醇,以1 mL/min的流速进行洗脱。
在此条件下,研究酸浆果实多酚的抗氧化作用和酶活性抑制作用。得出酸浆果实多酚具有一定还原能力,对羟自由基和DPPH自由基有清除作用,其IC50值分别为0.604 4 mg/mL和2.262 mg/mL,并对胰脂肪酶、α-淀粉酶和α-葡萄糖苷酶有抑制作用,半抑制浓度(IC50)分别为0.826 2、0.8178 mg/mL 和 1.011 mg/mL。因此,酸浆果实多酚具有抗氧化作用,对胰脂肪酶、α-淀粉酶和α-葡萄糖苷酶的活性有抑制作用,这为进一步研究酸浆果实多酚在体内对糖、脂代谢的影响提供了科学依据。
[1]王家东,王晓闻.酸浆营养成分的分析[J].山西农业大学学报(自然科学版),2005,25(4):376-379
[2]刘雅丽,韩书影,赵后,等.锦灯笼宿萼皂苷降血糖作用研究[J].东北师大学报(自然科学版),2010,42(2):105-109
[3]刘敏,徐斌,杜鹃,等.酸浆水提物对高脂模型大鼠血脂水平的影响[J].江苏农业科学,2014,42(10):310-313
[4]张岚,葛红娟,温武略,等.酸浆宿萼总黄酮体外对羟基自由基的抑制作用[J].时珍国医国药,2011,22(8):1936-1937
[5]孔静.酸浆醇提物抑制食管癌EC-1.71细胞增殖和诱导其凋亡的实验研究[D].镇江:江苏大学,2011:20-27
[6]孟庆然.酸浆宿萼总皂苷对巨噬细胞炎症反应的调控作用[D].晋中:山西农业大学,2014:50-51
[7]孟庆然,李立博,王晓闻.酸浆宿萼总皂苷体外抑菌效果研究[J].食品科学,2013,34(19):84-87
[8]何雪梅,孙健,李丽,等.蔗梢多酚类化合物抗氧化与抗肿瘤活性的研究[J].食品工业科技,2015,36(23):343-346
[9]金星玉.植物多酚类化合物在巨噬细胞中抗炎作用机制的研究[D].延吉:延边大学,2006:7-10
[10]金亚倩,马雪豪,白元生,等.葡多酚生物学功能研究进展[J].中国草食动物科学,2015,35(3):44-47
[11]Ji L,Yuan Y,Luo L,et al.Physalins with anti-inflammatory activity are present in Physalis alkekengi var.franchetii and can function as Michael reaction acceptors[J].Steroids,2012,77(5):441-447
[12]Tong H,Liang Z,Wang G.Structural characterization and hypoglycemic activity of a polysaccharide isolated from the fruit of Physalis alkekengi L.[J].Carbohydrate Polymers,2008,71(2):316-323
[13]Yu G,Duan Y F,Fang G Z,et al.Polysaccharides from fruit calyx of Physalis alkekengi var.francheti:Isolation,purification,structural features and antioxidant activities[J].Carbohydrate Polymers,2009,77(2):188-193
[14]郭颖,刘静,聂黎行,等.锦灯笼的研究进展[J].中药材,2012,35(12):2039-2045
[15]田树革,魏玉龙,刘宏炳.Folin-Ciocalteu比色法测定石榴不同部位总多酚的含量[J].光谱实验室,2009,26(2):341-343
[16]王若兰,田志琴,孔祥刚,等.大孔吸附树脂纯化小米酚类化合物的工艺条件研究[J].中国粮油学报,2011,26(10):35-39
[17]冯进,李敏,曾晓雄,等.大孔树脂纯化蓝莓叶多酚及其组成分析[J].食品科学,2013,34(10):86-91
[18]甘芝霖,倪元颖,郭悦,等.大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J].农业工程学报,2015,31(24):298-304
[19]张瑞妮.红枣多酚的提取分离及体外抗氧化活性研究[D].西安:陕西师范大学,2013:37-38
[20]邢佳,陆文娟,赵云霞,等.石榴叶多酚的纯化及抗氧化活性研究[J].南京师大学报(自然科学版),2015,38(3):84-90
[21]王毕妮,黄庆瑗,高慧,等.不同极性红枣多酚的抗氧化活性比较[J].食品与发酵工业,2014,40(10):142-145
[22]张丽娜.水翁花对胰脂肪酶和α-淀粉酶抑制活性及作用机制初步探讨[D].上海:华东理工大学,2012:22-23
[23]Worsztynowicz P,Napierala M,Bialas W,et al.Pancreatic α-amylase and lipase inhibitory activity of polyphenolic compounds present in the extract of black chokeberry(Aronia melanocarpa L.)[J].Process Biochemistry,2014,49(9):1457-1463
[24]袁娟,卫娜,徐勇,等.白豆提取物对α-淀粉酶和α-葡萄糖苷酶活性研究[J].食品与发酵科技,2014,50(3):12-15
[25]李波,包怡红,高峰,等.红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].食品工业科技,2015,36(1):63-69
[26]张忠.茶多酚对胰脂肪酶活性的抑制作用[J].食品工业,2013,34(8):168-170
[27]彭冰洁,宋卓,刘云龙,等.多酚类化合物对糖脂代谢影响的研究进展[J].食品科学,2015,36(17):270-273
