蛋白酶对蟹壳的脱蛋白作用研究
2018-01-17武小芳张建旭耿晓杰王勃颖郭润芳孙纪录
武小芳,张建旭,耿晓杰,王勃颖,郭润芳,孙纪录,*
(1.河北农业大学食品科技学院,河北保定071001;2.河北农业大学现代科技学院,河北保定071001)
近年来,随着螃蟹加工量的增加,蟹壳的产生量也大幅增加,造成了严重的环境污染。蟹壳是甲壳素生产的主要原料之一[1-2]。甲壳素又称为几丁质,是第二丰富的自然生物质资源,在食品、医药、化工、纺织、污水处理等领域皆有广泛应用。蟹壳由甲壳素与蛋白质交织形成的致密基质构成,这些基质通过矿物盐的沉积加固,这些矿物盐主要是碳酸钙。为了获得甲壳素,必须脱除矿物质和蛋白质[3]。甲壳素的传统生产方法是在高温下利用强酸和强碱分别脱矿物质和蛋白质。这种方法会产生废物处理问题,严重污染生态环境;同时可能造成甲壳素的部分脱乙酰基和水解,导致产品的生理特性不一致。随着对环境关注度的增加,使用微生物发酵和蛋白酶处理技术,替代传统生产甲壳素的方法引起广泛重视。
微生物发酵法相对简单,并且不太昂贵,克服了化学处理的缺点。发酵上清液中包含了大量的蛋白水解物(氨基酸和多肽),可以将他们收集作为其它微生物的培养基以降低污水处理的成本[4-6]。但是由于其发酵周期长,微生物培养条件要求严格,目前,尚停留在实验室研究阶段,未能大规模投入生产。利用酶法脱蛋白,反应条件温和,环境污染小,操作简单,对反应仪器设备要求低,水解产物丰富且可回收利用,避免了传统方法中使用强碱造成的甲壳素质量降低的问题。目前,对甲壳类动物脱蛋白质使用的蛋白酶种类有碱性蛋白酶、酸性蛋白酶、菠萝蛋白酶、胰蛋白酶、中性蛋白酶等。岁姗姗等将胰蛋白酶和木瓜蛋白酶组合对黄粉虫进行酶解脱蛋白质提取甲壳素,反应温度对蛋白质的脱除程度影响最大,蛋白质水解液中氨基酸丰富[7]。王红等利用中性蛋白酶对虾废料进行脱蛋白质试验,处理时间对酶解液的水解度影响效果最明显[8]。
本研究拟使用蛋白酶对蟹壳脱蛋白质。以蟹壳粉为原料,蛋白质脱除率为主要评价指标,筛选最适蛋白酶种类,然后对蛋白酶添加量、蟹壳粉粒径、反应温度、保温处理时间和pH值进行优化,以期研发一种替代传统的NaOH碱法脱蛋白的方法。
1 材料与方法
1.1 仪器与设备
AISITE高速万能粉碎机、WGL-125B鼓风干燥箱:天津市泰勒斯特仪器有限公司;SHA-C恒温水浴振荡器:常州国宇仪器制造有限公司;721G可见分光光度计:上海仪电分析仪器有限公司;3K15低温冷冻离心机:SIGMA德国公司。
1.2 材料与试剂
碱性蛋白酶(3.57×105U/g)、菠萝蛋白酶(1.23×105U/g)、木瓜蛋白酶(2.85× 104U/g)、福林(Follin)试剂(分析纯):Biotopped Science公司;三氯乙酸(分析纯):国药集团化学试剂有限公司;四硼酸钠(分析纯):天津市天力化学试剂有限公司;磷酸氢二钠(分析纯)、磷酸二氢钠(分析纯):天津市福晨化学试剂厂;醋酸(分析纯):天津市风船化学试剂科技有限公司;柠檬酸(分析纯):天津市鼎盛化工材料厂;盐酸(分析纯):北京化工厂。
蟹壳:来自河北省黄骅市产梭子蟹。蟹壳粉的制备:将蟹壳水煮1 h,然后清洗,60℃下干燥12 h,将干燥的蟹壳粉碎过筛,过筛目数分别为40、80、120、160目。
1.3 方法
1.3.1 蛋白酶种类的选择
将蟹壳粉(120目)按料液比 1∶5(g/mL)加入适宜的缓冲溶液,搅拌均匀。按酶底比7.75 U/mg分别加入碱性蛋白酶、菠萝蛋白酶和木瓜蛋白酶,混匀。然后,于恒温水浴摇床中酶解处理6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重[9]。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率。
1.3.2 蟹壳粉粒径对脱蛋白质的影响
将目数为 40、80、120、160目的蟹壳粉按料液比1∶5(g/mL)与pH值为10.5的硼砂缓冲溶液混合,按酶底比7.75 U/mg添加碱性蛋白酶,混匀。然后,于45℃恒温水浴摇床中保温处理6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率。
1.3.3 酶底比对脱蛋白质的影响
将160目蟹壳粉按料液比1∶5(g/mL)与pH值为10.5的硼砂缓冲溶液混合,分别按酶底比为4、8、12U/mg添加碱性蛋白酶,混匀。然后,于45℃恒温水浴摇床中保温处理6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率[10]。
1.3.4 温度对脱矿物质和脱蛋白质的影响
将160目蟹壳粉按料液比1∶5(g/mL)与pH值为10.5的硼砂缓冲溶液混合,按酶底比4 U/mg加入碱性蛋白酶,混匀。然后,分别于 30、40、45、50、60 ℃恒温水浴摇床中保温处理6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率[10]。
1.3.5 保温处理时间对脱蛋白质的影响
将160目蟹壳粉按料液比1∶5(g/mL)与pH值为10.5的硼砂缓冲溶液混合,按酶底比4 U/mg加入碱性蛋白酶,混匀。然后,于45℃恒温水浴摇床中分别保温处理至2、4、6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率[10]。
1.3.6 pH值对脱蛋白质的影响
将160目蟹壳粉按料液比1∶5(g/mL)与pH值分别为9.6、10.0、10.5、11.0的缓冲溶液混合,按酶底比4 U/mg加入碱性蛋白酶,混匀。然后,于45℃恒温循环水浴中分别保温处理6 h。离心,用蒸馏水洗涤残渣至pH值为7左右,将残渣恒温干燥至恒重。采用福林酚法测定上清液中蛋白质含量,凯氏定氮法测定残渣中蛋白质含量,计算杂质脱除率。
1.3.7 蛋白质含量的测定
1.3.7.1 固体残渣中蛋白质含量测定
采用凯氏定氮法[11]。
1.3.7.2 L-酪氨酸标准曲线
参考GB/T 28715-2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》测定[12]。
以酪氨酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线,见图1。

图1 酪氨酸标准曲线Fig.1 The standard curve of tyrosine
1.3.7.3 上清液中蛋白质含量测定
用蛋白酶水解蟹壳蛋白质后,通过福林酚显色测定酶解上清液中蛋白质含量。取1 mL稀释至一定倍数的上清液,加入5 mL碳酸钠溶液和1 mL福林酚试剂,混匀,于40℃恒温水浴锅中显色反应20 min。待显色完成后,迅速冷却,测定680 nm波长下吸光值。根据酪氨酸标准曲线,计算酶解过程中上清液中蛋白质含量[12]。
1.3.8 数据统计分析
本研究利用SPSS 17.0软件对各单因素试验数据进行分析,差异显著水平为0.05。
2 结果与分析
2.1 蛋白酶种类的选择
不同种类的蛋白酶对蟹壳粉的脱蛋白质效果见图2。
由图2可知,碱性蛋白酶对蟹壳的蛋白质脱除率为71.35%,显著高于菠萝蛋白酶处理(58.45%)和木瓜蛋白酶处理(54.40%)(P<0.05)。经碱性蛋白酶、菠萝蛋白酶和木瓜蛋白酶对蟹壳脱蛋白质后,上清液中蛋白质含量分别为(5 826.04±239.55)、(4 506.80±190.95)、(2 344.50±531.05)μg/mL,碱性蛋白酶处理后上清液中蛋白质含量也显著高于其它两种蛋白酶处理(P<0.05)。因此,碱性蛋白酶较适宜对蟹壳脱蛋白质。

图2 不同种类的蛋白酶对蟹壳粉的脱蛋白质效果Fig.2 The efficacy of deproteinization of crab shell powder by different proteases
2.2 蟹壳粉粒径对脱蛋白质的影响
碱性蛋白酶对不同粒径的蟹壳粉的脱蛋白质效果见图3。

图3 碱性蛋白酶对不同粒径的蟹壳粉的脱蛋白质效果Fig.3 The efficacy of deproteinization of crab shell powders withdifferent granularity by alkaline protease
由图3可知,随着蟹壳粉粒径的增大,蛋白质脱除率增加,蟹壳粉目数为160目时蛋白质脱除率为82.25%,显著高于蟹壳粉目数为40目(58.59%)、80目(68.38%)和120目(73.23%)(P<0.05)。蟹壳粉粒径越大,蛋白酶分子与蟹壳粉的接触面积增大,因此,能够促进蛋白酶水解蟹壳中的蛋白质。分别采用目数为40、80、120、160目的蟹壳粉进行酶解脱蛋白后,上清液中的蛋白质含量分别为(2623.90±93.02)、(3158.40±3.40)、(4 397.47±239.55)、(6 778.42±68.61)μg/mL,上清液中蛋白质含量与蛋白质脱除率变化相符。因此,选择蟹壳粉目数为160目较适宜。
2.3 酶底比对脱蛋白质的影响
不同酶底比下蟹壳粉的脱蛋白质效果见图4。

图4 不同酶底比下蟹壳粉的脱蛋白质效果Fig.4 The efficacy of deproteinization of crab shell powder under different enzyme/substrate ratio
由图4可知,随着蛋白酶添加量的增加,蟹壳粉的蛋白质脱除率先升高后降低,当酶底比达到8 U/mg时,蛋白质脱除率达到最高。但是,经单因素方差分析,酶底比为4 U/mg和8 U/mg差异不显著(P>0.05)。在酶底比为4、8、12 U/mg时,蟹壳经蛋白酶处理后,上清液中蛋白质含量分别为(5 921.57±42.35)、(6 790.57±142.35)、(5 758.01±239.55)μg/mL,变化趋势与蛋白质脱除率趋势基本一致。因此,综合经济成本考虑,选择酶底比为4 U/mg较适宜。
2.4 温度对脱蛋白质的影响
不同温度下蟹壳粉的脱蛋白质效果见图5。
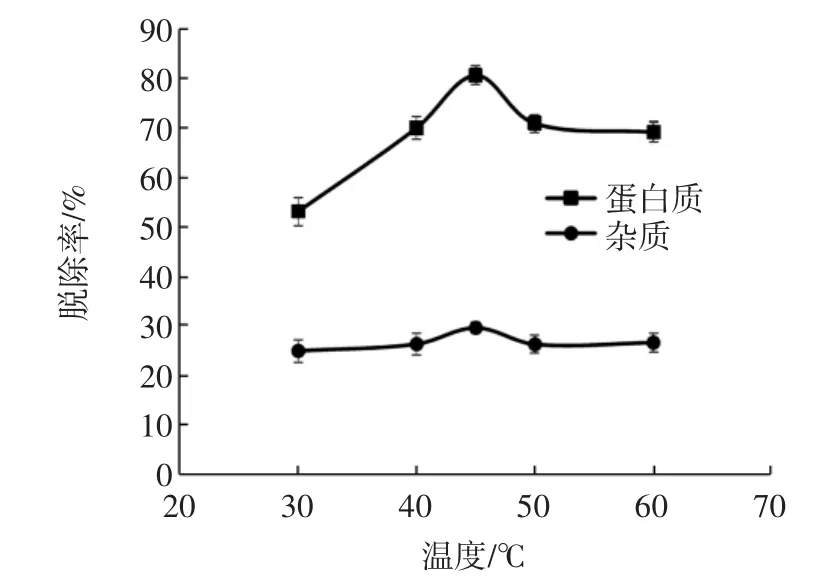
图5 不同温度下蟹壳粉的脱蛋白质效果Fig.5 The efficacy of deproteinization of crab shell powder under different temperatures
由图5可知,随着温度的升高,蟹壳的蛋白质脱除率呈先升高后下降趋势;当温度达到45℃时,蛋白质脱除率为80.72%,达到最高,与其他处理差异显著(P<0.05)。与之对应,30、40、45、50、60 ℃下酶解处理液的上清液中,蛋白质含量分别为(3 912.97±348.82)、(5 080.02±36.43)、(6 850.57±42.35)、(5 163.41±73.89)、(5 180.02±17.50)μg/mL,变化趋势与蛋白质脱除率变化一致。因此,选择45℃为最适温度。
2.5 保温处理时间对脱蛋白质的影响
不同保温处理时间下蟹壳粉的脱蛋白质效果见图6。
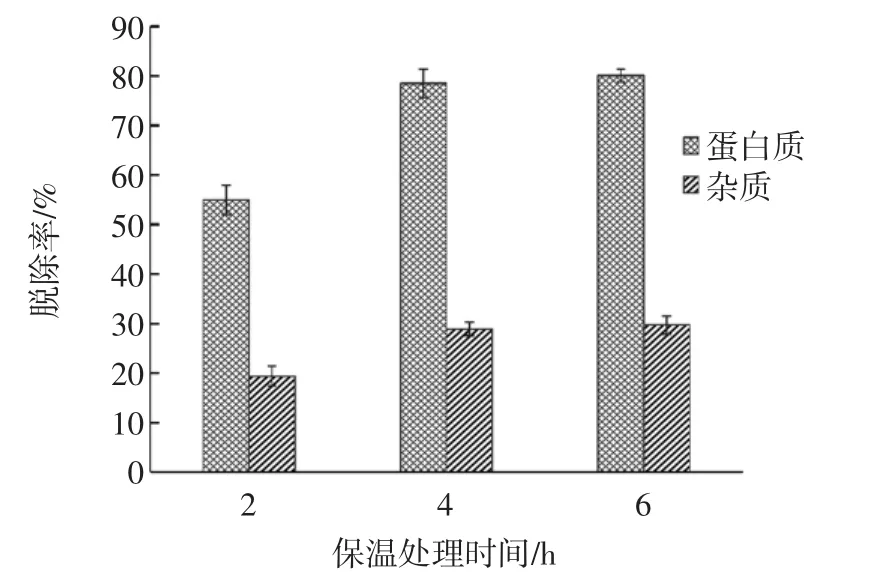
图6 不同保温处理时间下蟹壳粉的脱蛋白质效果Fig.6 The efficacy of deproteinization of crab shell powder during different incubation time
由图6可知,随着反应时间的延长,蛋白质脱除率逐渐增加,当反应时间超过4 h,蛋白质脱除率基本趋于稳定。经单因素方差分析,反应4 h与6 h差异也不显著(P>0.05)。在反应时间为 2、4、6 h时,上清液中蛋白质含量分别为(3 109.81±45.15)、(5 034.78±31.05)、(5 150.63±93.75)μg/mL,变化趋势与蛋白质脱除率的变化趋势基本一致。因此,为了节约反应时间,综合蛋白质脱除效果,选择4 h为最佳保温处理时间。
2.6 pH值对脱蛋白质的影响
不同pH值下蟹壳粉的脱蛋白质效果见图7。
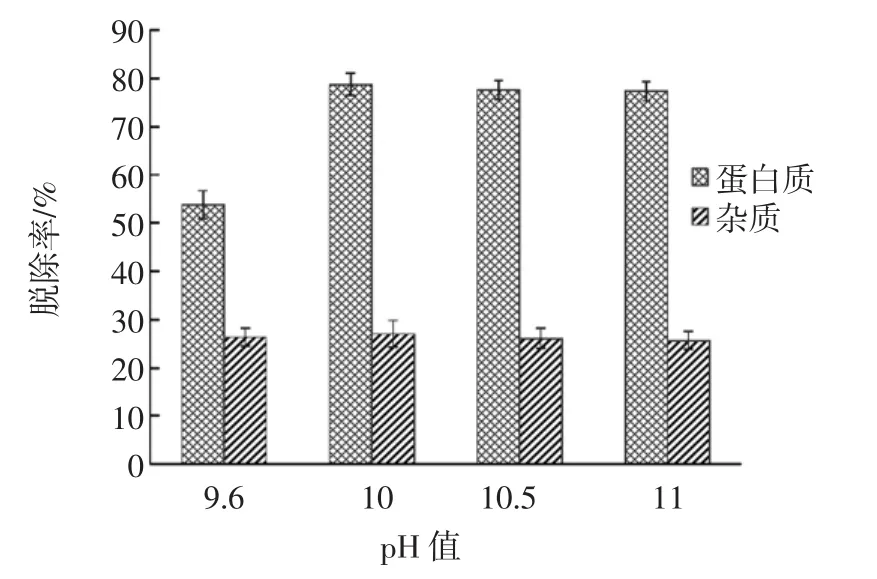
图7 不同pH值下蟹壳粉的脱蛋白质效果Fig.7 The efficacy of deproteinization of crab shell powder under different pH
由图7可知,pH从9.6到10.0,蛋白质脱除率升高;从10.0到11.0,蛋白质脱除率变化不明显。经单因素方差分析,pH 9.6与其它pH相比,杂质脱除率差异显著(P<0.05),在 pH 10.0、10.5和 11.0 下,蛋白质脱除率差异不显著(P>0.05)。在 pH 9.6、10.0、10.5 和 11.0下对蟹壳脱蛋白质后,上清液中蛋白质含量分别为(3 842.85±232.55)、(3823.42±358.89)、(3779.68±47.91)、(3 742.85±57.62)μg/mL,上清液中蛋白质含量变化不明显。因此,综合比较,pH 10.0到11.0为蛋白酶处理蟹壳脱蛋白质的最适pH范围。
3 结论
在甲壳素提取过程中,脱蛋白质工序通常采用稀碱法,即利用稀氢氧化钠溶液在高温条件下进行。使用强碱易腐蚀设备,且会降低提取的甲壳素的脱乙酰度和分子量,反应结束后脱除的蛋白质无法回收利用,造成化学污染。与之相比,酶促反应条件温和、无污染、水解产物丰富、对反应设备要求较低、对环境污染小[13]。
在本研究中,使用蛋白酶对蟹壳脱蛋白质替代传统方法。结果表明,碱性蛋白酶适宜于蟹壳脱蛋白。其最适脱蛋白质条件为:碱性蛋白酶添加量4 U/mg、蟹壳粉目数160目、反应温度45℃、保温处理时间4 h、pH值10.5,在此条件下,蟹壳粉的蛋白质脱除率为78.54%。本试验结果为单批次蟹壳粉研究结果,综合所有批次试验结果可知,在最优试验条件下,蟹壳粉的蛋白质脱除率约为80%。因此,碱性蛋白酶可以通过酶促反应水解蟹壳中蛋白质,是替代氢氧化钠脱蛋白质的一种选择。但是,使用蛋白酶成本较高,将其固定化后利用是较优的选择,这仍需进一步深入研究。
[1]Valdez-Peña A U,Espinoza-Perez J D,Sandoval-Fabian G C,et al.Screening of industrial enzymes for deproteinization of shrimp head for chitin recovery[J].Food Science and Biotechnology,2010,19(2):553-557
[2]Abdelrahman R M,Hrdina R,Abdelmohsen A M,et al.Chitin and chitosan from Brazilian Atlantic Coast:Isolation,characterization and antibacterial activity[J].International Journal of Biological Macromolecules,2015,80:107-120
[3]Sayari N,Sila A,Abdelmalek B E,et al.Chitin and chitosan from the Norway lobster by-products:Antimicrobial and anti-proliferative activities[J].International Journal of Biological Macromolecules,2016,87:163-171
[4]Jo G H,Jung W J,Kuk J H,et al.Screening of protease-producing Serratia marcescens FS-3 and its application to deproteinization of crab shell waste for chitin extraction[J].Carbohydrate Polymers,2008,74(3):504-508
[5]Ghorbel-Bellaaj O,Hmidet N,Jellouli K,et al.Shrimp waste fermentation with Pseudomonas aeruginosa A2:optimization of chitin extraction conditions through Plackett-Burman and response surface methodology approaches[J].International Journal of Biological Macromolecules,2011,48(4):596-602
[6]Giyose N Y,Mazomba N T,Mabinya L V.Evaluation of proteases produced by Erwinia chrysanthemi for the deproteinization of crustacean waste in a chitin production process[J].African Journal of Biotechnology,2010,9(5):702-707
[7]岁姗姗,周祥,周楷.正交试验法优化黄粉虫甲壳素提取新工艺[J].海南大学学报(自然科学版),2015,32(2):147-151
[8]王红.南美白对虾加工废弃物制备壳聚糖关键技术研究[D].保定:河北农业大学,2015
[9]Younes I,Ghorbel-Bellaaj O,Nasri R,et al.Chitin and chitosan preparation from shrimp shells using optimized enzymatic deproteinization[J].Process Biochemistry,2012,47(12):2032-2039
[10]Younes I,Hajji S,Rinaudo M,et al.Optimization of proteins and minerals removal from shrimp shells to produce highly acetylated chitin.[J].International Journal of Biological Macromolecules,2016,84:246-253
[11]中华人民共和国卫生部.GB 5009.5-2010食品安全国家标准食品中蛋白质含量的测定[S].北京:中国标准出版社,2010
[12]全国食品工业标准化技术委员会工业发酵分技术委员会.GB/T 23527-2009,蛋白酶制剂[S].北京:中国标准出版社,2009
[13]Younes I,Hajji S,Frachet V,et al.Chitin extraction from shrimp shell using enzymatic treatment.Antitumor,antioxidant and antimicrobial activities of chitosan[J].International Journal of Biological Macromolecules,2014,69(8):489-498
