秦川牛和郏县红牛GBP2基因拷贝数变异检测及其对生长性状的效应分析
2018-01-17张桂民宋成创曹修凯文逸凡逯倩倩雷初朝黄永震
张桂民,贺 花,郑 立,宋成创,曹修凯,文逸凡,逯倩倩,雷初朝,陈 宏,黄永震*
(1.西北农林科技大学动物科技学院,陕西杨凌 712100;2.西北农林科技大学动物医学学院,陕西杨凌 712100;3.河南牧业经济学院动物科技学院,河南郑州 450046)
牛肉是人类重要的蛋白食物来源。近年来,随着国民生活水平的不断提高,对牛肉的消费的数量和质量都大大提高。我国拥有丰富的黄牛品种资源,而秦川牛和郏县红牛作为中原牛的典型代表,对我国肉牛产业的发展起着举足轻重的作用,但与国外优良品种相比还存在前期生长慢、后躯欠发达等不足,因此,进一步研究其生长性状和遗传改良就显得十分必要。
拷贝数变异(Copy Number Variation,CNV)是指在基因组上发生50 bp到几Mb片段的插入、缺失、复制等,因其比SNPs(Single Nucleotide Polymorphisms)和Indels覆盖范围更广,遗传效应更大。随着牛全基因组测序的完成[1],大量的拷贝数变异区域(Copy number Variation Regions,CNVRs)在牛上被检测出来。Liu等[2]在牛的染色体上检测到177个CNVRs区域,覆盖了约占全基因组序列 1.07%的约28.1 Mb 序列。而且很多位于与免疫、泌乳、繁殖等重要性状相关的基因上。Hou等[3]在21个牛品种的539头个体中发现了682个CVNs位点,总共覆盖基因组 139.9 Mb。
GBP2基因是GBP家族中的重要成员,其编码的蛋白质为GTP酶,将GTP水解为GDP,该蛋白质可以起到鳞状细胞癌的标志物的作用。目前揭示的GBPs家族成员的功能主要与细胞增殖[4]和病原体感染[5]有关。关于GBP2基因的功能,在人和小鼠上的研究发现其对细胞生长的调控以及抗病性上有重要影响[4],但在牛上的报道较少。为了研究GBP2基因与牛的生长性状的关系,本研究对其拷贝数变异与中国黄牛的生长性状进行关联分析,为进一步研究其功能提供依据。
1 材料与方法
1.1 样品采集与体尺测量 本研究所用的110份血样包括80头秦川母牛(陕西省秦川牛良种繁育中心,陕西扶风)、30头郏县红牛基础母牛(河南省郏县)。采集血样的同时测量并记录体高、体长、体重、十字部高、胸围等体尺数据,测定时记录年龄。
DNA样品采集时用ACD抗凝,冰盒迅速带回实验室,-80℃保存备用。用Sonstegard等[6]描述的方法提取基因组DNA,分光光度计测定浓度后,用灭菌蒸馏水稀释至标准浓度10 ng/μL,-20℃保存待用。
1.2 方法
1.2.1 引物设计和RT-PCR扩增 以NCBI数据库(http://www.ncbi.nlm.nih.gov/)公布的牛GBP2基因序列(Gen Bank Accession No. NC_007301.6)为参考序列,利用Primer 5.0(PREMIER Biosoft International,California,USA)设计实时荧光定量PCR引物(表1),检测GBP2基因拷贝数变异,引物由生工生物工程(上海)股份有限公司合成。
1.2.2 引物检测 随机选取50个稀释到10 ng/μL的秦川牛个体的DNA样,从中各抽取1 μL混池,用DNA混合池通过普通PCR检测引物。
普通 PCR 反应体系:2×Taq PCR Star Mix 5 μL,上、下游引物各5 pmol,DNA模板 10 ng,加ddH2O至10 μL。普通PCR反应条件:95℃预变性10 min ;95℃变性30 s,60℃退火并延伸30 s,40个循环;72℃延伸10 min,4℃保存。
将普通PCR反应后的产物进行琼脂糖凝胶电泳检测:取6 μL产物,选用3%的(w/v)的琼脂糖凝胶,电泳40~50 min,照相分析。
1.2.3 定量检测 Realtime-PCR反应体系:2×TaqTMII 6.25 μL,上、下游引物各 5 pmol,DNA 模板 10 ng,加ddH2O至12.5 μL。Realtime-PCR反应条件:95℃预变性10 min;95℃变性15 s,60℃退火并延伸1 min,40个循环;72℃延伸10 min,4℃保存。
1.3 统计分析 用Excel2010软件处理实时荧光定量PCR的结果,用SPSS 20.0对GBP2基因不同拷贝数类型(Loss,Median,Gain)与体尺性状进行关联分析。结果表示为平均值±标准误。
2 结果与分析
2.1 引物检测结果 如图1所示,用于检测GBP2基因拷贝数的引物特异性较高,可用于下一步实验。
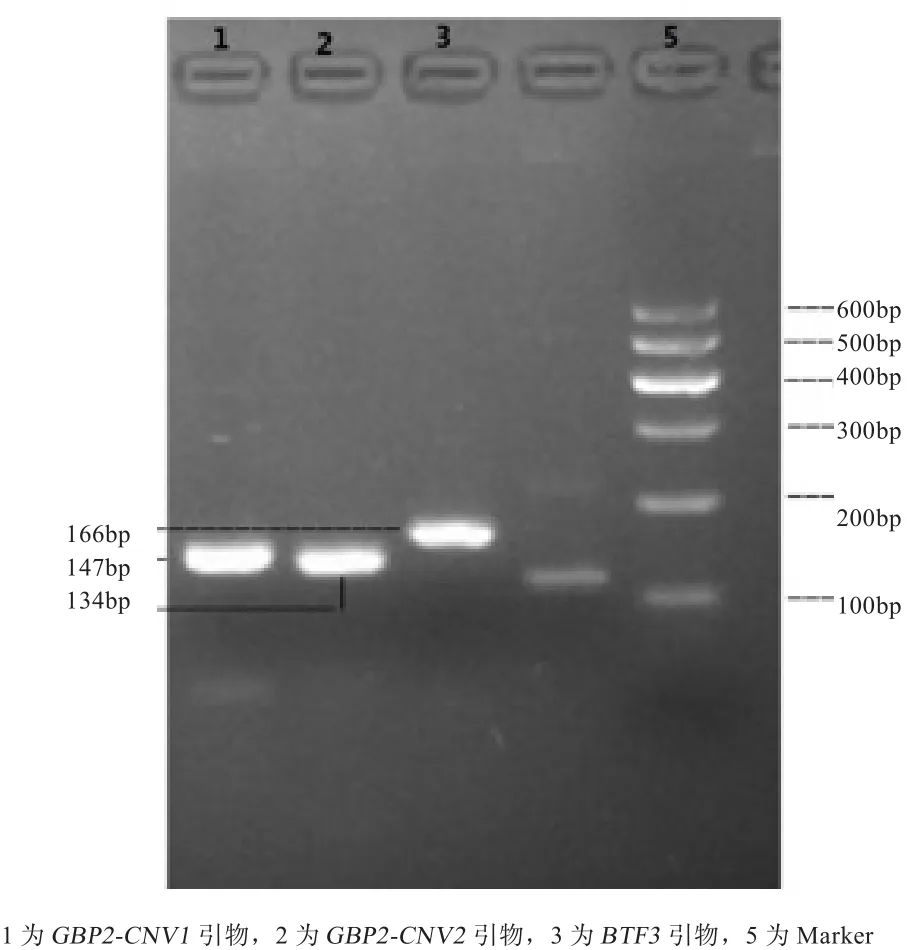
图1 引物检测结果
2.2GBP2基因不同拷贝数类型在黄牛中分布差异 如图2所示,CNV1在2个品种的拷贝数分布比较均衡;CNV2在秦川牛中Gain型较多,郏县红牛Loss型个体数量较少,而且郏县红牛个别个体拷贝数很少,品种间差异也不显著(P>0.05),表明GBP2基因的拷贝数变异在2个不同品种间差异较小,具有一定的相似性(表2)。
2.3GBP2基因的不同拷贝数与黄牛生长性状的关联分析 根据实时荧光定量PCR的结果,通过Log22-ΔΔCt计算出不同个体的拷贝数,并按照不同的拷贝数将其分为 3 种类型:拷贝数增加(Log22-ΔΔCt> 0.5,Gain)、拷贝数减少(Log22-ΔΔCt< -0.5,Loss)和拷贝数不变(-0.5< Log22-ΔΔCt<0.5,Median)。 将 不 同 类 型 个 体与体尺性状进行关联分析,秦川牛GBP2基因CNV1和CNV2拷贝数变异与生长性状的关联性分析如表3和表4所示。在秦川牛中,Loss型在体长、体重、胸围等重要生长性状显著优于Gain/Median型(P<0.05);郏县红牛CNV1在腰角宽、坐骨端宽等生长性状上也表现为Loss型个体显著优于Gain/Median型(P<0.05)(表5);郏县红牛CNV2拷贝数变异Loss型体高显著高于Median型(P<0.05)(表6)。

表1 实时荧光定量PCR的引物信息
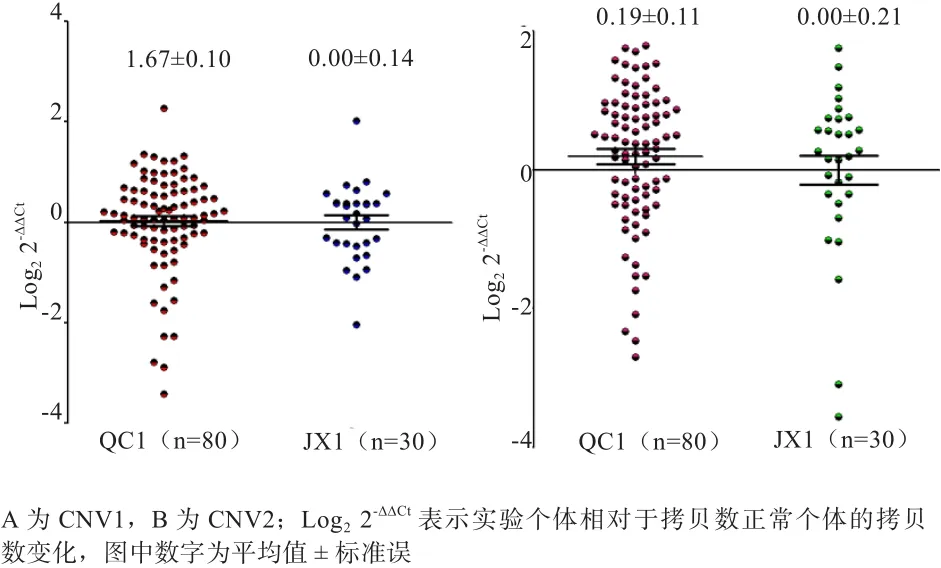
图 2 GBP2基因在2个牛群中的拷贝数分布图
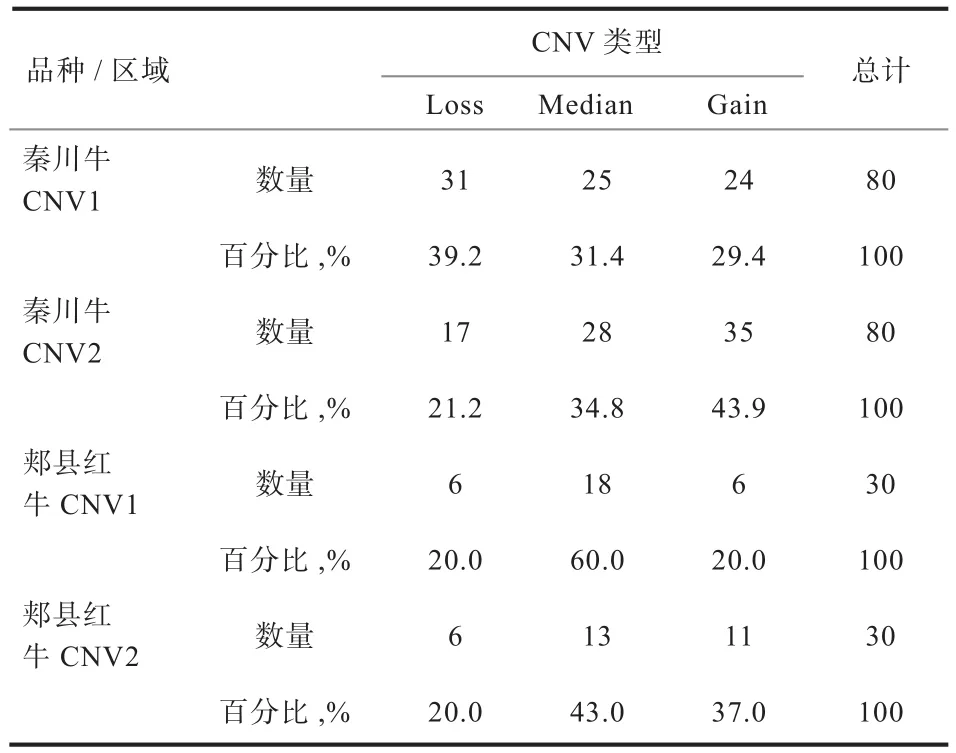
表2 秦川牛和郏县红牛不同拷贝数类型分布的个体数量及其比例
3 讨 论
近年来,大量关于SNPs和Indels的研究发现,不论是单个碱基的突变或是小片段的插入缺失都会对生长性状产生重要影响[8-9],而拷贝数变异是比SNPs和Indels更为广泛的遗传变异,所以也具有更大的遗传效应,对其进行研究也十分必要。在畜禽中,CNV的变化也会是导致一些表型的变化。Fontanesi等[10]研究发现,ASIP基因的拷贝数的变异和错义突变导致了羊出现了不同的毛色;Dominic等[11]发现,鸡SOX5基因第1内含子拷贝数的增加导致鸡出现豆冠表型。

表3 秦川牛GBP2基因CNV1拷贝数变异与生长性状的关联性分析

表4 秦川牛GBP2基因CNV2拷贝数变异与生长性状的关联性分析
实时荧光定量PCR(qPCR)技术因其准确、简便、快捷而被广泛用于各种实验,尤其是在分析基因表达等方面。基因的拷贝数变异是基因大片段的插入缺失,也就是某一片段发生数量上的变化。因此,对这一片段进行定量就能准确地检测出其拷贝数的变化,对不同变化的拷贝数与生长性状进行关联分析,找出其与生长性状的关系,可为分子标记辅助选择育种提供新的依据。

表5 郏县红牛GBP2基因CNV1拷贝数变异与生长性状的关联性分析
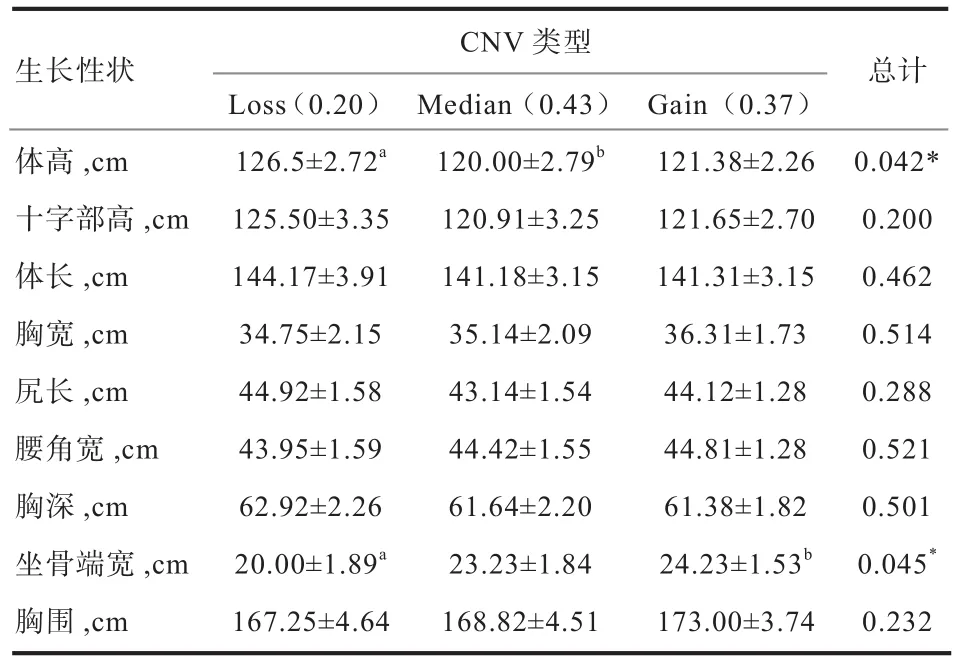
表6 郏县红牛GBP2基因CNV2拷贝数变异与生长性状的关联性分析
本研究将qPCR技术用于GBP2基因的拷贝数变异研究,在拷贝数变异区域内设计引物,另外通过单拷贝的基因进行矫正来检测不同牛的拷贝数变化。GBP2基因的2个拷贝数变异CNV1和CNV2在秦川和郏县红牛2个群体中分布较为相似,但秦川牛个体间拷贝数差异较大,而郏县红牛相对较小,在2个品种中,Median类型都较其他类型多,GBP2基因的CNV1和CNV2拷贝数变异在2个黄牛品种中表现出较强的一致性,与石涛[12]研究结果不矛盾。石涛[12]研究发现,拷贝数变异在不同牛品种中存在较大的差异,但也有分布相似的品种。
通过GBP2基因拷贝数与生长性状的关联分析发现,不同类型的拷贝数变异对黄牛的生长性状影响显著。而GBP2基因对细胞增殖、分化和迁移等有重要影响[4],另外,GBP2基因还具有抗病原体的作用[5,7]。在牛上对其进行研究,可对我国黄牛品种的遗传改良提供依据。然而,因为我国地域辽阔,黄牛品种多样丰富,且不同地区的黄牛品种在适应性、抗逆性以及生长性状等方面都存在有较大差异。本研究只选择其中2个品种进行研究并不能代表所有品种,尤其是高原地区以及其他一些杂交改良形成的有突出特点的品种,应当进一步进行大量研究。但本研究结果初步发现,GBP2基因CNV1和CNV2 2个拷贝数变异区域不同的拷贝数类型对秦川牛和郏县红牛生长性状影响显著,可作为其遗传育种的分子辅助标记,为进一步对其功能进行研究打下基础。
[1] Consortium B H. Genome-wide survey of SNP variation uncovers the genetic structure of cattle breeds[J]. Science,2009, 324:528-532.
[2] Liu G E, Hou Y, Zhu B,et al. Analysis of copy number variations among diverse cattle breeds[J]. Genome Res, 2010,20:693-703.
[3] Hou G Y, Yuan Z R, Zhou H L,et al. Association of thyroglobulin gene variants with carcass and meat quality traits in beef cattle[J]. Mol Bio Rep, 2011, 7:4705-4708.
[4] Guenzi E, Topolt K, Cornali E,et al. The helical domain of GBP-1 mediates the inhibition of endothelial cell proliferation by in flammatory cytokines[J]. EMBO J, 2001, 20:5568-5577.
[5] Degrandi D, Konermann C, Beuter-Gunia C,et al. Extensive characterization of IFN-induced GTPase mGBP1 to mGBP10 involved in host defense[J]. J Immunol, 2007, 179:7729-7740.
[6] Sonstegard T S, Garrett W M, Ashwell M S,et al. Comparative map alignment of BTA27 and HSA4 and 8 to identify conserved segments of genome containing fat deposition QTL[J]. Mamm Genome, 2000, 11:682-688.
[7] Carter C C, Gorbacheva V Y, Vestal D J. Inhibition of VSV and EMCV replication by the interferon-induced GTPase, mGBP-2:differential requirement for wild-type GTP binding domain [J].Arch Virol, 2005, 150: 1213-1220.
[8] 陈广凤, 陈建省, 田纪春. 小麦株高相关性状与SNP标记全基因组关联分析[J]. 作物学报, 2015 (10):1500-1509.
[9] 闫奕源. 鸡基因组遗传变异的检测分析和蛋鸡基因组选择的研究[D]. 北京: 中国农业大学, 2017.
[10] Fontanesi L, Beretti F, Riggio V,et al. Copy Number variation and missense mutations of the agouti protein(ASIP) gene in goat breeds with different coat colors[J]. Cytogenet Genome Res, 2009, 126:333-347.
[11] Dominic W, Henrik B, Meadows J R S,et al. Copy number variation in intron 1 of SOX5 causes the Pea-comb phenotype in chickens[J]. PLOS Genet, 2009, 5:98-111.
[12] 石涛. 黄牛LEPR基因拷贝数变异及基因启动子活性研究[D]. 杨凌: 西北农林科技大学, 2016.
