电化学示意图题破解策略
2018-01-16张洲铭
张洲铭


【摘 要】本文以例讲解电化学示意图题的解题策略,重视基础知识,过好基础知识关,养成按一定程序进行思维的习惯,抓住示意图的两个关键点,找出应对策略,清理解题思路,从而破解难题。
【关键词】电化学 示意图题 破题策略
【中图分类号】G 【文献标识码】A
【文章编号】0450-9889(2017)10B-0158-03
关于电化学示意图题,每次考试,失分率都是较高的,从学生的角度看,笔者也曾经很困惑。一是主观上认为示意图题很难,看到示意图就怕,心理上产生畏难情绪;二是遇到这种题型总是理不出头绪,找不到破解方法;三是效率不高,即使费了九牛二虎之力做对了,损失时间可不少,更不会变通,下次遇到同样的问题时,还是不会做。经过不断的琢磨并向老师请教,笔者有了一些感悟,总结出一些经验,供大家参考。
一、要重视基础知识,过好这个关
示意图题属于综合性考查,对基础要求较高。在平时的练习中,总搞不清错在哪里。经过分析总结,发现最常犯的是基础性错误。如对氧化还原反应基本原理理解不透彻,物质得、失电子与发生的是氧化反应还是还原反应搞不清楚;没能按离子方程式的书写原则完成电极反应式;分析外电路中电子和电解质溶液中阴、阳离子的运动方向有困难,等等。这样,即使把示意图读懂了,也是完成不好答题过程。如果死缠烂打,必然导致时间上的损失,很不合算。
因此,一定要重视基础知识,过好这个关。基础牢固了,才谈得上综合应用。
二、养成按一定程序进行思维的习惯,从心理上解决对示意图题的畏惧感
(一)要有对电化学示意图进行分类的思想
电化学示意图有电池类、电解类及腐蚀与防护类。通过必要的针对性练习,不管图形如何变化,区分是哪一类还是不难的,关键是要养成对图进行分类的思维习惯,才不至于在解题时犯原则性错误。如图 1 和图 2 所示,电池类示意图没有外接电池,电解类示意图有外接电源。而图 3 属于外加电流的金属防护问题,利用原电池原理向钢管通电子,强迫钢管不能失电子而腐蚀,阳极高硅铸铁仅作导体,不存在有损耗的问题。
经过对示意图的分类练习,可以解决陌生感,心里就有了底气,信心倍增,也就不会犯方向性错误。
(二)要按一般流程进行思考
区分清楚示意图是电池类还是电解类后,后面的工作就是按流程进行思考。
对于电池类来说,一般的基本思维程序是:
分析自发的氧化还原反应中元素电子得失情况(或通过示意图,直接分析两极反应物和产物的化合价升降情况)→找出××在负极失电子,××在正极得电子→按要求答题。
对于电解池来说,一般的思维程序是:
分析阳极材料的活性→如果阳极是活性材料,则阳极失电子,否则,分析电解质溶液中所有的阴、阳离子→按阴、阳离子放电能力排序→完成电极反应等工作。
认识到以上流程的重要性还不够,务必按流程进行针对性练习。通过必要的练习和体验后,按流程进行思考的习惯也就养成了。
〖例 1〗用阴离子交换膜控制电解液中 OH- 的浓度制备纳米 Cu2O,反应为 2Cu+H2O Cu2O+H2↑,如图 4 所示。该电解池的阳极反应式为________。
〖解析〗无论从题目还是从示意图看,都可看出这是一个电解池,铜失去电子生成 Cu2O,所以示意图中 Cu 电极是阳极,阳极区溶液呈中性,这一极的电极反应式用 OH- 平衡电荷:。
三、抓住示意图的两个关键点,找出应对策略,清理解题思路
(一)审图关键点之一是弄清题意
审图关键点之一是弄清题意,为此要严格按照一定的审题步骤,找到解决问题办法。这个审题步骤是:
① 审明白示意图中外电路中电子的流向 →② 分析两极反应 →③ 解决题目给出的问题。
原电池和电解池的反应原理都是氧化还原反应,只不过原电池中的氧化还原反应是自发的,电解池中的是非自发的。通过理解示意图并综合题干,分析元素化合价的变化情况,不难破解两极电子的流向、电解质溶液中的离子流向等关键性难点。
图 5 所示,为用铁(Fe)去除水体中的硝酸盐(NO3-),没有外接电池,显然是属于原电池。图中圆铁外环由细变粗,表示中间的 Fe→Fe3O4,铁元素化合价升高,失电子,所以中间的铁是电池的负极。而 NO3- 在 Fe3O4 表面转变为 NH4+,氮元素化合价降低,得电子,因此 Fe3O4 为电源的正极。
图 6 是 CO2 电催化还原为 CH4 的工作原理示意图。属于电解类示意图,左池为 ,C 元素化合降低,得电子,铜电极是阴极,不参与电极反应。右池溶液中离子失电子的能力由大到小的顺序为 OH->SO42-,这一极发生的反应为 4OH--4e-=2H2O+O2↑,阴离子减少,多余的阳离子 K+ 通过盐桥进入左池平衡电荷。左池溶液有 CO2,碳元素主要以 HCO3- 形式存在,可理解成这边池子里碳酸氢钾不断增加。
如果是有机物参与电极反应,根据两极元素(一般是碳元素)化合价的升降情况,一样可以理清外电路中电子的运动方向,并搞清两极的反应原理。
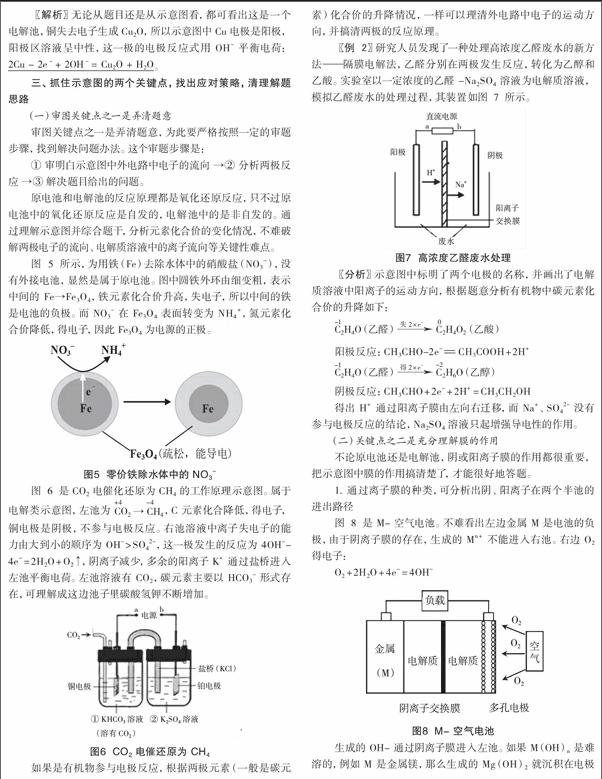
〖例 2〗研究人员发现了一种处理高浓度乙醛废水的新方法——隔膜电解法,乙醛分别在两极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛 -Na2SO4 溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图 7 所示。
得出 H+ 通过阳离子膜由左向右迁移,而 Na+、SO42- 没有参与电极反应的结论,Na2SO4 溶液只起增强导电性的作用。
(二)关键点之二是充分理解膜的作用
不论原电池还是电解池,陰或阳离子膜的作用都很重要,把示意图中膜的作用搞清楚了,才能很好地答题。
1.通过离子膜的种类,可分析出阴、阳离子在两个半池的进出路径
图 8 是 M- 空气电池。不难看出左边金属 M 是电池的负极,由于阴离子膜的存在,生成的 Mn+ 不能进入右池。右边 O2 得电子:
O2+2H2O+4e-=4OH-生成的 OH- 通过阴离子膜进入左池。如果 M(OH)n 是难溶的,例如 M 是金属镁,那么生成的 Mg(OH)2 就沉积在电极上,这种电池就不能持续供电,必须把阴离子膜换成阳离子膜。
2.图中离子通过膜的方向,告知我们外电路中电子的流向
图 9 为用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可循环再生 NaOH,同时得到 H2SO4,电极材料为石墨。阴离子在电解质溶液中的方向与外电路中电子运动方向形成闭合电路,阳离子在电解质溶液中的方向与外电路中电流运动方向形成闭合电路。通过图中离子通过离子膜的方向,就可知道 a 接电源的负极,左池为阴极区,右池是阳极区。
四、充分理解两个电极分别发生的反应原理
忽视示意图中两个电极发生反应原理的分析,有时候会给解题带来很大的麻烦。
答案为 D。
其实,教材中铅蓄电池,铅元素也只在两电极内进行价态的转换,并没有进入电解质溶液中,与此题相同。
这是笔者摸索、体验、总结出电化学示意图题的破解策略,希望对大家有帮助。
(责编 卢建龙)endprint
