肉苁蓉提取物对H2O2致兔肾小管上皮细胞损伤的影响
2018-01-16张健飞杨晓琴俸婷婷
张健飞,管 静,赵 丹,杨晓琴,周 英,俸婷婷
(1.贵州大学药学院,贵州 贵阳 550025;2.贵州大学医学院,贵州 贵阳 550025;3.贵州大学生命科学学院学院,贵州 贵阳 550025;4.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;5.贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025;6.贵州省药食两用资源应用开发工程实验室,贵州 贵阳 550025)
前 言
肉苁蓉又名疆芸、寸芸、苁蓉、查干告亚,为列当科植物肉苁蓉CistanchedeserticolaY.C.Ma或管花肉苁蓉Cistanchetubulosa(Schenk) Wight的干燥带鳞叶肉质茎[1]。具有补肾阳、益精血、润肠通便的功效,传统用于肾阳不足、精血亏虚、阳痿不孕、腰膝酸软、筋骨无力、肠燥便秘,为历代使用频度最高的补肾阳药物。H2O2作为一种活性氧形式,具有强烈引发脂质过氧化的作用,几乎可与任何细胞成分发生反应,引起链式脂质过氧化反应,造成细胞的凋亡和功能失调[2,3]。实验主要通过研究肉苁蓉提取物对H2O2致兔肾小管上皮细胞增殖抑制和损伤的影响,初步探讨其对肾小管上皮细胞的保护作用。
1 材料与方法
1.1 试验药物
肉苁蓉购自四川省川南药业有限公司(批号151201)。
1.2 动物
新西兰大白兔,雄性,20日龄,购自贵州省畜牧研究所实验基地,动物许可证号:SCXK(黔)2012-001。
1.3 试剂
DMEM/F-12(1:1),Gbico公司;胎牛血清,浙江天杭生物科技有限公司;二甲亚砜(DMSO),北京鼎国昌盛生物技术有限公司;H2O2,四川金山制药有限公司;胰蛋白酶,Amresco公司;噻唑蓝(MTT),Genview公司;非放射性细胞毒性检测试剂盒,Promega公司;无水乙醇,天津富宇精细化工有限公司。
1.4 仪器
CO2培养箱,3111型,Thermo Fisher Scientific;酶标仪,1510型,Thermo Fisher Scientific;超净工作台,SW-CJ-1FD,苏州净化设备有限公司;倒置荧光显微镜,宁波舜宇;旋转蒸发器,RE-52AA,上海亚荣生化仪器厂;冷冻干燥机,LGJ-12,北京松源华兴科技发展有限公司。
1.5 方法
1.5.1肉苁蓉提取物的制备 取肉苁蓉干药材粉碎,精密称取两份药粉各100 g,分别加入10倍量蒸馏水和75%乙醇加热回流提取3次,第一次3 h,第二次1.5 h,第三次1 h,合并3次滤液,减压浓缩至浸膏,计算提取物得膏率分别为水提物22.30%,醇提物21.70%,挥去残醇,冷冻干燥机制得肉苁蓉水、醇提取物,密封干燥避光保存待用。
1.5.2细胞培养 参照赵丹等[4]所述方法构建肾小管上皮细胞模型,分离培养20日龄的兔原代肾小管上皮细胞,待细胞生长至铺满培养皿90%以上,胰酶消化。用含1%胎牛血清的DMEM/F-12完全培养基以每孔1.2×104个细胞接种于96孔板,37℃,5%CO2条件下培养。
1.5.3H2O2致兔肾小管上皮细胞损伤模型的建立 参照1.5.2接种细胞,待细胞稳定培养48h后,采用H2O2进行损伤。设置实验组和空白对照组,每组设置4个复孔,重复三次。实验组:更换含有不同浓度H2O2的完全培养基,H2O2的浓度分别为550、500、450、400、350 μmol·L-1,空白对照组:更换完全培养基,37℃,5%CO2条件下继续培养24 h,镜检,采集图片。采用MTT[5]法测定H2O2作用后细胞的增殖情况,于490 nm处测定吸光度值(OD值)。采用非放射性细胞毒性检测试剂盒测定H2O2作用后细胞LDH释放量的变化,LDH释放量(%)=上清液LDH量/(上清液LDH量+裂解液LDH量)×100%。
AO/EB荧光染色[6]:分别取100 μg/mL AO溶液和100 μg/mL EB溶液各100 μL,混匀后每孔加入10 μL,立即置于倒置相差荧光显微镜上观察,5 min内保持观察视野不变,分别在450±10 nm的蓝光和532±10 nm的绿光下采集图片,采用荧光采集系统进行荧光合成,获得荧光染色图片。
1.5.4肉苁蓉提取物对H2O2致兔肾小管上皮细胞损伤的影响 按照1.5.2接种细胞,待细胞稳定培养24 h后,每孔加入含肉苁蓉提取物完全培养基200 ul对细胞进行预保护培养24 h。设置实验组,模型组及空白对照组,每组3个复孔,重复三次。实验组和模型组:更换含有400 μmol·L-1H2O2的完全培养基;空白对照组:为完全培养基。继续培养24 h。采用MTT法测定细胞增殖情况,采用非放射性细胞毒性检测试剂盒测定细胞LDH释放量的改变。
1.6 统计学处理
数据结果以x±s表示,使用SPSS 19.0统计软件进行统计分析,多组间比较采用单因素方差分析,组间的多重比较采用LSD法,P<0.05表示有统计学意义。
2 结果与分析
2.1 H2O2致兔肾小管上皮细胞形态的改变
不同浓度的H2O2作用兔肾小管上皮细胞24h后,显微镜下观察兔肾小管上皮细胞形态,如图1,随着H2O2浓度的增加,形态改变的细胞数量逐渐增多,贴壁细胞数量逐渐减少,部分细胞变长,细胞光泽度减小,体积缩小,H2O2浓度达550 μmol·L-1,轴突消失,胞膜破裂,细胞皱缩,细胞间隙增大,成片细胞间出现空白。

空白对照组350μmol·L-1400μmol·L-1450μmol·L-1500μmol·L-1550μmol·L-1图1 不同浓度H2O2对兔肾小管上皮细胞形态的影响(100×)Fig1 EffectofH2O2concentrationonmorphologyofrabbitRTECs(100×)
2.2 H2O2对兔肾小管上皮细胞增殖作用的影响
分别使用350、400、450、500、550 μmol·L-1H2O2作用兔肾小管上皮细胞24 h,采用MTT法测定吸光度,结果为不同浓度的H2O2对兔肾小管上皮细胞的增殖均有抑制作用,IC50值为439.07 μmol·L-1,500 μmol·L-1的H2O2作用24h对细胞增殖的抑制作用可达到50%以上,因此选用该浓度作于后续研究。
2.3 H2O2对兔肾小管上皮细胞LDH的释放量的影响
H2O2作用兔肾小管上皮细胞24 h后,采用非放射性细胞毒性检测方法测定细胞上清液及细胞裂解液中LDH反应的OD值,计算细胞LDH释放量,结果见表1。不同浓度的H2O2会引起兔肾小管上皮细胞LDH释放量的增加,且H2O2浓度越高,LDH释放量越大,呈浓度依赖性。H2O2在浓度400 mmol·L-1时引起细胞LDH释放量超过空白组50%以上,造成细胞重度损伤。
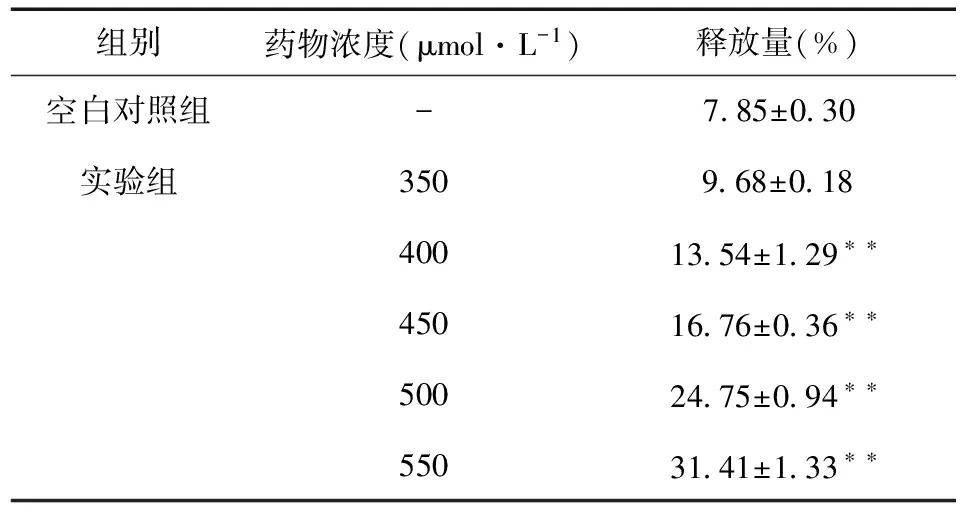
表1 H2O2对兔肾小管上皮细胞LDH释放量的影响(x±s,n=4)Tab.1 Effects of H2O2 on LDH release from rabbit RTECs
注:与空白对照组比较*P<0.05;**P<0.01
2.4 H2O2作用兔肾小管上皮细胞后AO/EB荧光染色结果
H2O2作用兔肾小管上皮细胞24 h后,对细胞进行AO/EB荧光染色,如图2,初步判断H2O2对兔肾小管上皮细胞的作用机制以引起细胞坏死为主。不同浓度的H2O2会引起兔肾小管上皮细胞不同程度的坏死,H2O2浓度小于400 μmol·L-1时,核染色质着绿色收缩成圆形,判断主要以细胞早期凋亡为主,随着H2O2浓度升高,大于450 μmol·L-1时,呈橘红非圆珠状,坏死细胞数量增多,呈浓度依赖性。
2.5 肉苁蓉对H2O2致兔肾小管上皮细胞增殖作用的影响
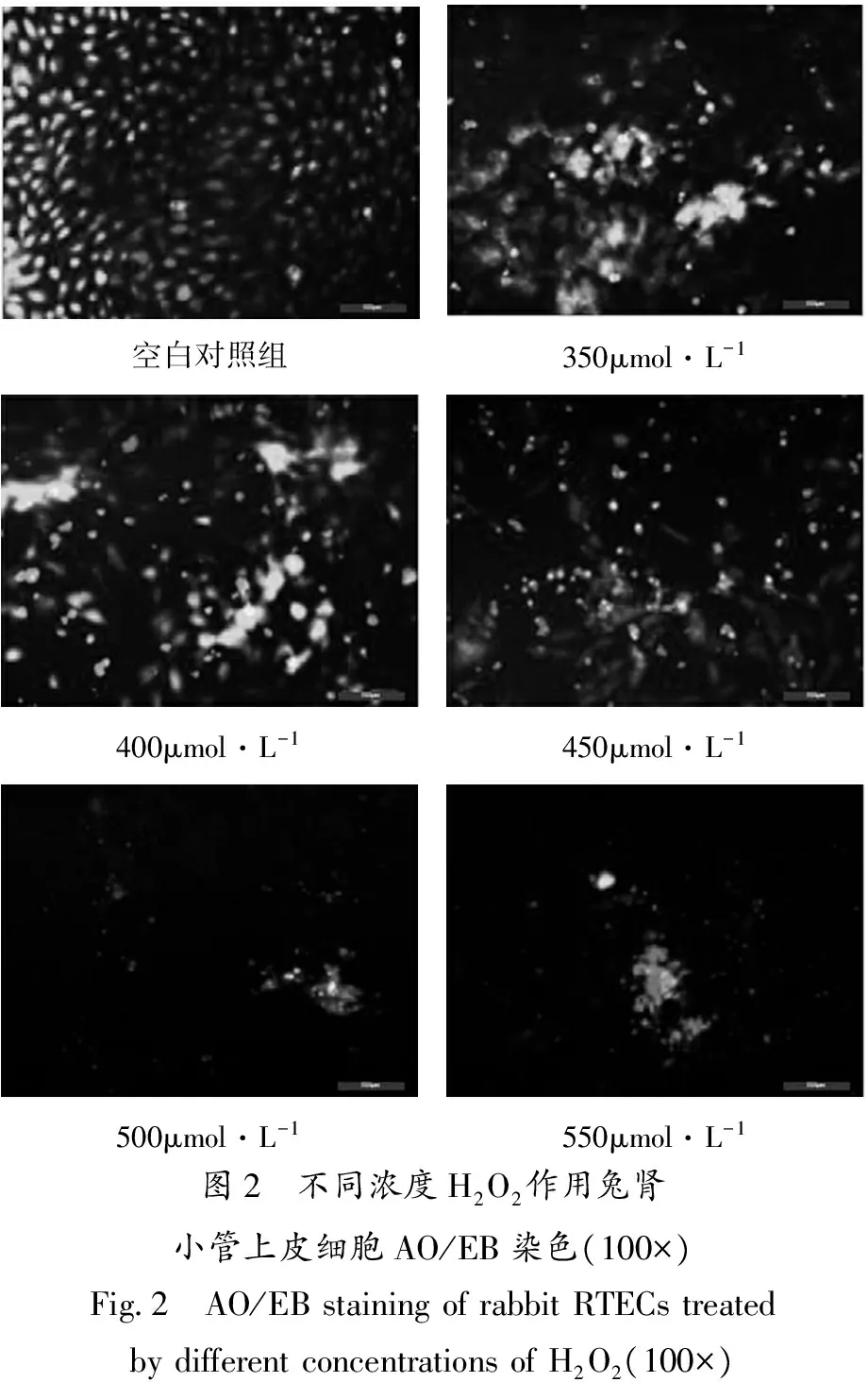
空白对照组350μmol·L-1400μmol·L-1450μmol·L-1500μmol·L-1550μmol·L-1图2 不同浓度H2O2作用兔肾小管上皮细胞AO/EB染色(100×)Fig2 AO/EBstainingofrabbitRTECstreatedbydifferentconcentrationsofH2O2(100×)
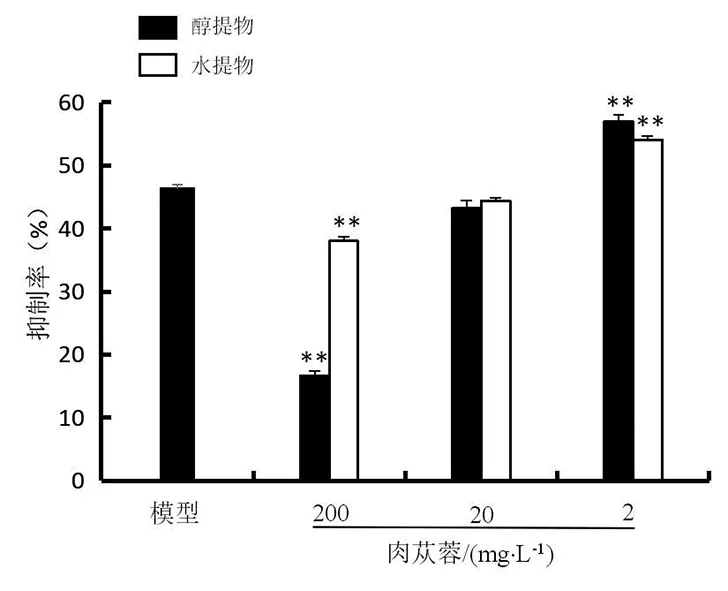
注:与模型组比较,*P<0.05,**P<0.01
2.6 肉苁蓉对H2O2致兔肾小管上皮细胞损伤的影响
对细胞LDH释放量的影响结果如图4,肉苁蓉醇提物和水提物的高、中、低浓度组均使得H2O2作用后兔肾小管上皮细胞LDH释放量极显著低于模型组LDH的释放量(P<0.01),结果呈浓度依赖性,浓度越高,细胞LDH释放量越低。

注:与模型组比较,*P<0.05,**P<0.01
3 讨 论
有“沙漠人参”之美誉的肉苁蓉具有极高的药用价值,是中国著名的补益中药。《神农本草经》[7]将上品药描述为:“上药……主养命以应天,无毒,多服,久服不伤人……”肉苁蓉即被列为上品药,味甘,微温。《名医别录》[8]指出肉苁蓉“味酸、咸,无毒”。之后历代本草对肉苁蓉性味归经的记载基本一致,其性微温,味甘、酸、咸,归肾、大肠经。传统用于肾阳不足、腰膝酸软、筋骨无力等,其药理作用及机制一直是研究重点。现代药理研究表明,肉苁蓉具有抗衰老、提高学习记忆能力、调节免疫功能。广泛用于中医临床处方、中成药和保健产品。
氧化应激是某些重大疾病的关键诱因,是由于体内活性氧在形成和清除之间出现失衡,造成组织细胞面临一定程度的氧化损伤。因而对应激反应机制进行深入研究,能够探寻有效预防、改善甚至完全消除应激性疾病的合理途径。氧化应激能够导致体内多种细胞及蛋白质过氧化[9],研究选用H2O2作为损伤的外源物之一。具有强烈引发脂质过氧化的作用,引起链式脂质过氧化反应,造成细胞的凋亡和功能失调。目前研究这种外源物的肾毒性及拮抗其肾毒性作用主要是通过建立动物模型,建立体外模型进行相关研究的文献报道相对较少。与肾毒性动物模型比较,体外肾毒性细胞模型具有作用靶点明确,用药周期短,用药量少等优点。
通过细胞形态学的改变、外源物对细胞增殖的抑制作用及细胞LDH释放量的改变对外源物诱导的体外肾毒性细胞模型进行研究。不同浓度的H2O2对细胞的形态改变均有明显的影响,随着外源物浓度的增加,发现细胞变形的数量增多。MTT实验是检测活细胞数量的常用方法,在不同浓度肉苁蓉保护兔肾小管上皮细胞免受 H2O2损伤的实验中,不同浓度的肉苁蓉明显降低了H2O2对兔肾小管上皮细胞的抑制率,且具有浓度依赖性,当细胞胞膜损伤时,胞内的LDH会释放到培养液中,细胞培养液中LDH含量是检测细胞死亡的一个重要指标。本研究发现H2O2致兔肾小管上皮细胞损伤的模型组细胞培养液中LDH水平明显增加,而经不同浓度肉苁蓉处理之后的实验组细胞培养液中LDH水平明显减少,且存在浓度依赖性。研究结果提示,通过建立H2O2致兔肾小管上皮细胞损伤模型,初步探讨肉苁蓉提取物对肾小管上皮细胞的保护作用,不仅为氧化应激导致的细胞损伤相关研究奠定基础,也为肉苁蓉的开发利用提供基础数据。
[1] Ch.P(2015)Vol Ⅰ(中国药典2015年版.一部)[S]. 2015:135.
[2] Kim JH, Choi W, Lee JH,etal. Astaxanthin inhibits H2O2-mediated apoptotic cell death in mouse neural progenitor cells via modulation of p38 and MEK signaling pathways[J].MicrobiolBiotechnol, 2009, 19(11):1355-1363.
[3] Siu PM, Wang Y, Alway SE.Apoptotic signaling induced by H2O2-mediated oxidative stress in differentiated C2Cl2myotubes[J].LifeSci, 2009, 84(13):468-481.
[4] 赵 丹,张 雪,管 静,等.几种中药材对兔原代肾小管上皮细胞增殖作用影响的研究[J]. 山地农业生物学报,2017,36(4):76-79.
[5] 陈丽珍,俸婷婷,黄俊飞,等.依普黄酮对破骨细胞活性及成骨细胞增殖分化作用的研究[J]. 山地农业生物学报,2015,34(3):042-047.
[6] 陈 萌,李华涛,李 响,等.AO/EB双重染色法检测紫杉醇体外诱导犬乳腺肿瘤细胞凋亡[J]. 广东畜牧兽医科技,2011,36(1):39-42.
[7] Gu G G, Yang P J.Shen Nong Ben Cao Jing[M]. Beijing:XueyuanPress, 2013:73.
[8] Tao H J, Shang Z J.Ming Yi Bie Lu[M]. Beijing:People’s Medical Publishing House, 1986:51.
[9] Cash T P, Pan Y, Simon M C.Reactive oxygen species and cellular oxygen sensing[J].FreeRadicBiolMed, 2007, 43(9):1219-1225.
