苦参碱对杀菌剂抗山核桃干腐病的增效作用1)
2018-01-15潘佳亮姚翰文耿征葛康康郝昕张平李朝阳马玲
潘佳亮 姚翰文 耿征 葛康康 郝昕 张平 李朝阳 马玲
(东北林业大学,哈尔滨,150040)
山核桃(Caryacathayensis)是一种广泛分布于浙江省的经济树种,由于其果实富含多种营养物质,在市场上广受欢迎,具有很高的经济价值和市场前景[1-3]。山核桃干腐病(Botryosphaeriadothidea)是山核桃树的重要病害之一,导致山核桃的减产(10%~50%)并严重影响树势,造成严重的经济损失[4-5]。当前对于山核桃干腐病的田间防治主要依赖于化学防治,但化学农药的大量使用会导致农药残留、病原菌产生抗药性及环境污染等问题[6-7]。目前,随着人们对于绿色食品的关注度越来越高,具有低毒,低残留等特点的植物源农药越来越受到人们的关注,然而植物源农药用量大,成本高等问题也制约着其广泛应用,将植物源农药与化学农药复配提高药效并减少化学农药的使用也逐渐成为了科学界研究的重点。目前将植物源农药与化学杀菌剂复配防治山核桃干腐病尚无报道。
苦参碱是由苦参干燥根茎中提取的一种主要活性成分[8-9]。目前国内外关于苦参碱的研究主要集中在其杀虫效果[10],也有报道称苦参碱具有抑制大肠杆菌、羊毛状小孢子菌、白色念珠菌等微生物的生物活性[11-12]。近年来,关于苦参碱对植物病原菌抑菌效果的研究也逐渐增多[13-14]。Yang et al.[15]研究了苦参碱对几种林木病原真菌孢子萌发和菌丝生长的抑制效果,发现苦参碱对杨褐斑病菌(Marssoninabrunnea)和龙竹材霉变菌(Cladosporiumoxysporum)抑菌效果较强。
农药复配效果评价目前主要应用的有Bliss法、Finney法、Mansour法[16]、孙云沛法[17]和等效线法等。由于孙云沛法可以定量的计算复配增效效果,常应用于农药复配配方筛选中。但孙云沛法操作繁琐,在多个药物复配中工作量远大于Mansour法且浪费药物。Mansour法相对于孙云沛法省工省力,在大量筛选中应用较多,但此方法仅能定性分析增效作用,不能定量。所以,笔者综合利用不同方法的优势,先采用Mansour法对复配药剂进行定性分析,筛选出复配效果较好的组合,再用孙云沛法对这些组合进行定量分析,筛选出效果最好的配比进行下一步试验,以期获得理想的复配农药配方。
1 材料与方法
1.1 试验材料
试剂:98%苦参碱、99%戊唑醇、95%恶醚唑、99%喹啉铜、98%代森锰锌、98%嘧菌酯、95%苯醚甲环唑、98%百菌清、99%甲基托布津均购于上海源叶生物有限公司。
菌种:山核桃干腐病菌(Botryosphaeriadothidea)由东北林业大学森林保护学实验室保藏,所有菌种于冰箱中4 ℃保藏,每3个月转接活化一次,使用前在马铃薯培养基上25 ℃恒温培养备用。
1.2 方法
1.2.1 单剂对山核桃干腐病抑菌效果测定
药剂配置:将98%苦参碱用无菌去离子水配置成500 g/L母液;99%戊唑醇、98%代森锰锌、98%嘧菌酯、95%苯醚甲环唑、98%百菌清、99%甲基托布津用丙酮配置成20 g/L母液;95%恶醚唑、99%喹啉铜用丙酮配置成10 g/L母液。
毒力回归方程和EC50值:将融化后的PDA培养基冷却至55~60 ℃,加无菌药剂母液充分混匀。根据不同药剂配置成5个不同浓度的带药培养基,等量溶剂加入PDA培养基中作为对照组,倒入灭菌培养皿中冷却至室温凝固。取活化72 h的山核桃干腐病真菌,用5 mm灭菌打孔器在菌落边缘打孔,倒放至带药平板中央,25 ℃培养72 h,用十字交叉法测量菌落直径,通过计算菌落直径平均值,按下面的公式计算苦参碱对菌落生长的抑制率。每个试验重复3次。
抑制率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌柄直径)×100%。
1.2.2 增效作用评价
采用Mansour法[16]测定苦参碱与8种化学农药的共毒因子,将供试药剂用不同溶剂溶解,按照单剂EC50值进行六等分法,即假设A、B两种药物的EC50值分别为Ca和Cb,则将A、B两种药物母液用PDA培养基稀释成(Ca/6+5Cb/6)、(Ca/3+2Cb/3)、(Ca/2+Cb/2)、(2Ca/3+Cb/3)、(5Ca/6+Cb/6),等量溶剂加入培养基中作为对照组,每组重复3次。按照各单剂独立回归曲线计算该浓度的抑菌率,将2种药剂抑菌率相加与合剂实际抑菌率相比较,共毒因子大于20为增效作用,小于-20为拮抗作用,在-20~20为相加作用。共毒因子计算公式如下:
共毒因子=(合剂实际抑菌率-药物A理论抑菌率-药物B理论抑菌率)/(药物A理论抑菌率+药物B理论抑菌率)×100。
采用孙云沛法[17]测定苦参碱与甲基托布津的联合毒力。按孙云沛法将供试药剂用不同溶剂溶解,按照EC50值进行十等分(参照六等分法),用等量溶剂配置成对照组,每组重复3次。用下列公式计算其联合毒力:
混合药剂实际毒力指数=(标准药剂EC50/混合药剂EC50)×100;
混合药剂理论毒力指数=A药剂毒力指数×A药剂在混剂中所占比例+B药剂毒力指数×B药剂在混剂中所占比例;
共毒系数=(混合药剂实际毒力指数/混合药剂理论毒力指数)×100;
共毒系数>120时为增效作用,共毒系数<80为拮抗作用,80<共毒系数<120为相加作用;其中A、B药剂在混剂中所占比例为质量比。
2 结果与分析
2.1 单剂的毒力回归方程和EC50值
8种化学农药对山核桃干腐病的毒力回归方程和EC50值见表1。从表1中可知,恶醚唑和苯醚甲环唑抑菌效果较好,EC50值分别为0.331、0.601 mg/L,其次为戊唑醇、甲基托布津,其EC50值为1.093、1.653 mg/L,这4种杀菌剂对山核桃干腐病均具有较好的抑菌效果,而代森锰锌、喹啉铜和百菌清抑菌效果较差,EC50值为13.310、15.11、19.166 mg/L,嘧菌酯抑菌效果最差,EC50值达到549.525 mg/L,抑菌效果与其他供试杀菌剂差异显著。

表1 杀菌剂对山核桃干腐病的毒力回归方程和EC50值
2.2 最佳复配组合的筛选
从表2可知,苦参碱与8种化学农药复配效果差异较大,在40个组合中有8个组合为增效作用,其中以苦参碱和甲基托布津复配效果最好,各配比共毒因子均大于20,在1∶1和2∶1复配时共毒因子最高,可达到118.415和87.343,其次是苦参碱与嘧菌酯在1∶2和5∶1复配时共毒因子为29.329和25.692。另外,苦参碱与苯醚甲环唑1∶1复配时共毒因子也达到了24.711,具有增效作用。而苦参碱与代森锰锌和百菌清复配时毒力因子均低于-20,表现为拮抗作用,与戊唑醇、恶醚唑、喹啉铜和苯醚甲环唑4种化学农药复配呈相加作用。由于嘧菌酯对山核桃干腐病的抑菌效果最差,且根据共毒因子,苦参碱与甲基托布津复配效果要优于苦参碱与嘧菌酯复配效果。因此,选用苦参碱与甲基托布津作为最佳复配组合进行下一步试验。
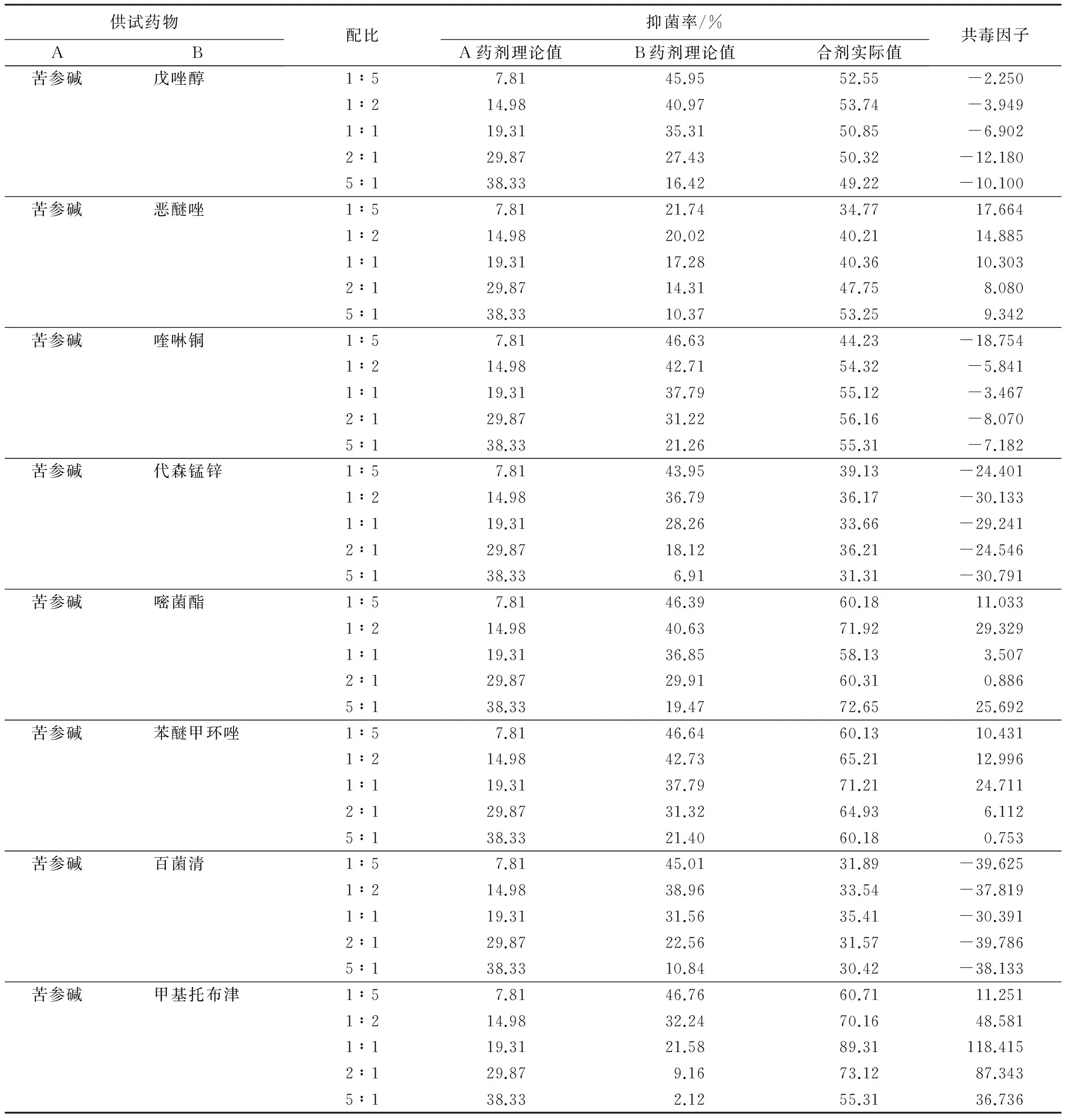
表2 苦参碱与8种化学农药对山核桃干腐病的毒力因子
2.3 苦参碱与甲基托布津最佳复配比例的筛选
由表3可知,不同比例苦参碱与甲基托布津复配均具有抑菌效果,但其结果与毒力因子测定结果的趋势相似,其中复配比例为5∶5时,共毒系数最高,为197.605,其EC50值为383.00 mg/L,其次分别是6∶4、4∶6、7∶3和9∶1,它们的共毒系数分别为186.257、174.254、163.582和159.382,其EC50值分别为327.00、521.00、278.00、95.80 mg/L。
3 讨论
山核桃干腐病是山核桃树主要病害之一,对当地经济造成巨大的损失,针对该病的防治主要以刮除病斑配合涂药的方法进行防控[18-19],但这种方法费时费力,寻找能够高效安全的防治山核桃干腐病的方法已经成为了亟待解决的问题。张传清等[7]通过测定7种化学农药对山核桃干腐病菌丝抑制活性发现苯醚甲环唑和戊唑醇抑菌效果最好,其中甲基托布津对山核桃干腐病的EC50值为2.66 mg/L,与本研究结果相似。本研究结果表明,供试8种药剂的EC50由大到小为恶醚唑、苯醚甲环唑、戊唑醇、甲基托布津、代森锰锌、喹啉铜、百菌清、嘧菌酯,其中甲基托布津EC50值为1.65 mg/L。
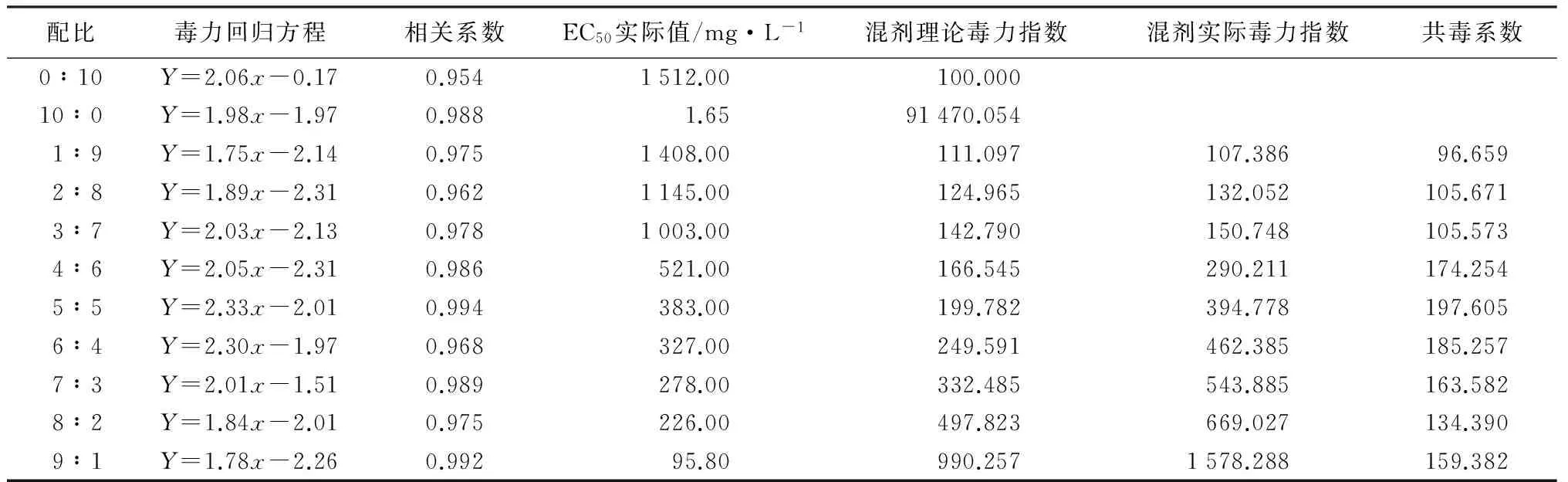
表3 苦参碱与甲基托布津不同配比对山核桃干腐病病原菌的联合毒力
植物源农药是从植物中提取的活性成分,其中很多活性成分具有广谱的抗真菌效果[20]。苦参碱是一种具有多种生物学活性的喹嗪生物碱,Yang et al.发现苦参碱对4种植物病原真菌的抑菌效果,其中对杨褐斑病菌和龙竹材霉变菌抑菌效果较好,同时与氧化苦参碱复配具有一定增效作用[15],但关于苦参碱与化学农药的增效作用目前尚无报道。本研究通过Mansour法和孙云沛法测定苦参碱与8种化学农药复配效果,发现苦参碱对嘧菌酯和甲基托布津复配效果最好,与代森锰锌和百菌清复配时表现为拮抗作用,与戊唑醇、恶醚唑、喹啉铜和苯醚甲环唑4种化学农药复配呈相加作用,这可能与药物抑菌活性机制有关,需要进一步试验和探讨。苦参碱与甲基托布津不同比例复配对其联合毒力影响较大,当复配比例为5∶5和6∶4时,其共毒系数值最高,分别为197.605和186.257,其EC50值分别为383.00、327.00 mg/L,这与Mansour法的测定结果趋势相同,进一步证明Mansour法和孙云沛法联合使用的科学性。
本研究表明,苦参碱与甲基托布津5∶5和6∶4复配对山核桃干腐病抑菌效果较好,抑菌效果远优于单剂使用,具有明显的增效作用,但一个商品化的复配农药还需要进行抑菌谱的测定、田间试验、经济成本核算等综合分析才能最终确定。苦参碱与甲基托布津复配可以增加抑菌活性,减少环境污染和抗药性的产生,为今后田间试验和生产打下坚实基础。
[1] NI L, SHI W Y. Composition and free radical scavenging activity of kernel oil from torreya grandis, carya cathayensis, and myrica rubra[J]. Iran J Pharm Res,2014,13(1):221-226.
[2] HUANG J, ZHANG T, ZHANG Q, et al. The mechanism of high contents of oil and oleic acid revealed by transcriptomic and lipidomic analysis during embryogenesis inCaryacathayensisSarg.[J]. BMC Genomics,2016,17(1):113.
[3] WANG Z, HUANG R, SUN Z, et al. Identification and profiling of conserved and novel microRNAs involved in oil and oleic acid production during embryogenesis inCaryacathayensisSarg.[J]. Functional & Integrative Genomics,2017,17(2/3):365-373.
[4] 郑宏兵,束庆龙,丁之恩.山核桃溃疡病与营养元素的关系[J].经济林研究,2007,25(3):19-23.
[5] 郑宏兵.山核桃抗溃疡病机理及其相关因素的研究[D].合肥:安徽农业大学,2004.
[6] 戴德江,马海芹,沈瑶,等.几种杀菌剂对山核桃干腐病的室内活性筛选与应用[J].农药,2015,54(3):217-219,230.
[7] 张传清,章祖平,孙品雷,等.山核桃干腐病菌对7种杀菌剂的敏感性比较及其对苯醚甲环唑敏感基线的建立[J].农药学学报,2011,13(1):84-86.
[8] 祁彦,汪宝琪.苦参碱和氧化苦参碱的研究概况[J].西北药学杂志,1996,11(1):62-64.
[9] 苗抗立,张建中,董颖,等.苦参的化学成分及药理的研究进展[J].天然产物研究与开发,2001,13(2):69-73.
[10] 郑永权,姚建仁,邵向东.苦参化学成分及农业应用研究概况[J].农药科学与管理,2000,21(1):24-26,30.
[11] 汪长中,程惠娟,官妍,等.苦参碱对体外白念珠菌生物膜抑制作用[J].中国公共卫生,2008,24(12):1491-1492.
[12] 吴岚,周永梅,施琳俊,等.苦参碱对白色念珠菌黏附人口腔黏膜上皮细胞的影响[J].临床口腔医学杂志,2009,25(1):3-5.
[13] 韦平英,梁英,侯美珍.苦参生物碱对几种植物病原菌的抑制作用研究初报[J].广西植保,2003,16(2):1-2.
[14] 严清平,袁善奎,姜辉,等.苦参生物碱对植物病原菌的离休抗菌活性研究[J].农药科学与管理,2007,28(12):46-49.
[15] Yang X Y, ZHAO B G. Antifungal activities of matrine and oxymatrine and their synergetic effects with chlorthalonil[J]. Journal of Forestry Research,2006,17(4):323-325.
[16] MANSOUR N A, ELDEFRAWI M E, TOPPOZADA A, et al. Toxicological studies on theEgyptiancottonleafeorm,Prodenialitura. VI. Potentiation and antagonism of organophosphorus and carbamate insecticides[J]. J Econ Entomol,1966,59(2):307-311.
[17] SUN Y P, JOHNSON E R. Analysis of joint action of insecticides against house flies[J]. J Econ Entomol,1960,53(5):887-892.
[18] 吴志辉,明文平.山核桃溃疡病的化学防治研究[J].安徽农业科学,2006,34(14):3409-3409.
[19] 杨淑贞,丁立忠,楼君芳,等.山核桃干腐病发生发展规律及防治技术[J].浙江林学院学报,2009,26(2):228-232.
[20] DIXON R A. Natural products and plant disease resistance[J]. Nature,2001,411:843-847.
