小PVDF膜转移蛋白印迹及其凝胶电泳玻璃板的改进
2018-01-15马冠英赵起超陈丽洁陈功星
马冠英,赵起超,王 犇,陈丽洁,陈功星
蛋白印迹(western blot)是蛋白质研究的重要技术,也是生物医学基础研究最普通的基因表达研究工具。它结合了电泳分析容量大、分辨率高和免疫分析敏感性高、特异性强的优点,此技术已广泛应用于生物化学、分子生物学、免疫学和医学等领域[1]。自从该技术建立以来,数十年一直在生物学研究领域中发挥着重要的作用[2]。据相关报道,通过对抗体进行改进,降低传统蛋白质免疫印迹法的检测灵敏度增高,重复性好,可用于生物样本中痕量被检测物的测定[3]。该技术的主要步骤是电泳、转膜、杂交、显影,操作过程比较繁琐,时间和资金有一定的耗费,且存在着进一步提升改进的空间。本文通过减少PVDF膜大小,优化了蛋白印迹技术,同时对凝胶电泳玻璃板进行了创造性的改进,使该技术更加精简实用[4]。
1 小膜转移蛋白印迹实验
1.1 实验材料
蛋白提取、预染蛋白标准物(marker)、电泳胶及相关试剂等均购于试剂公司(碧云天生物技术有限公司),PVDF膜(Immuno-Blot PVDF Membrane),考马斯亮蓝染色液为实验室参照文献[5]自配,电泳和转膜设备(bio-rad公司)。
1.2 实验方法
1.2.1 蛋白电泳
1.2.2 切胶剪膜
把整个电泳长短两块玻璃及其内部凝胶,置于装有一定量的转膜缓冲液中,小心撬开长短玻璃,使凝胶一直贴于长玻璃板上,滑动短玻璃板,根据目的蛋白和内参的分子量,参照预染marker位置,以短玻璃板为界尺,用手术刀片切出含目的蛋白和内参的凝胶带,然后在转膜缓冲液平衡30 min。
1.2.3 转膜
剪取比转膜凝胶周边大约2 mm的PVDF膜,用甲醇浸透后约30 s,在转膜缓冲液中平衡15 min;再剪2张滤纸(其大小和PVDF膜一致,亦可略大),用转膜缓冲液浸湿后,备用。安装转膜夹 (膜在正极,胶在负极),在低温恒流250 mA条件下,转膜2 h。
1.2.4 染色与摄像
转膜结束后,PVDF膜浸在染色液中染色1 min,然后将膜浸在脱色液置于摇床上,每1 h换一次液体,反复脱色,直到蛋白条带清晰可见。然后在膜旁放置标尺,进行数码相机摄像,结果通过图形组合显示。
2 实验结果与分析
本实验中使用了两块胶和膜,分别对应于完整的胶和沿着49 KD分子切割的胶,完整的胶从大分子到小分子全部转移到大的膜上(如图1(a)所示),在最大分子标记117 KD以下,蛋白质条带明显,全长在7 cm范围内,而小膜转移蛋白在49 KD~19 KD之间,蛋白条带也明显,整个膜范围在近3 cm内(如图1(b)所示),两张膜的宽度接近,按照电泳玻璃槽的宽度,小膜的面积只有大膜的一半。蛋白印迹分析的转膜实验,一直有相关的研究,分子杂交是可以在凝胶上直接进行的,相关的DNA分子凝胶生物素显色和增色表明了凝胶上的便利[6],曾经有商品化的专用凝胶供应,但是对于免疫结合分子的蛋白印迹实验,存在两个经济上的缺点。首先,该种凝胶价格昂贵,接近SDS-聚丙烯酰胺凝胶的10倍;其次,杂交过程中的抗体浓度达到了膜上杂交浓度的10倍左右,此外凝胶容易破碎,因此,转膜仍然是目前不可缺少的技术手段。当然,印迹膜除了PVDF膜外,还有醋酸纤维膜、尼龙膜,但后两种膜在韧性、吸收蛋白、抗化学处理、保存等综合性能方面不如前者,PVDF膜机械强度高,与蛋白具有较强的界面相互作用[7],无疑在多数实验中是最好的,但也是最昂贵的。所以,PVDF膜使用需要谨慎。转膜常规做法是电泳结束后,根据凝胶的大小,剪裁同样或者略大于凝胶周边的膜。本方法先参照预染Marker分子量,根据目的蛋白和内参蛋白分子量范围,以短玻璃片为界尺,用手术刀片切割。当然塑料小铲也能做到,只是没有手术刀片切割整齐。缩小凝胶大小,然后剪裁PVDF膜,由于缩小了凝胶,所使用的小PVDF膜不到全胶膜的一半 (如图1(b)所示),染色的结果相近。实际上,不管大膜、小膜,最后的结果都显示在膜的很小范围内,因为目的蛋白分子在胶上分布的范围很小。对于目的蛋白与内参分子量相差较大的转膜,可以参照本方法分别切出两条小凝胶及相应大小的PVDF膜。小PVDF膜除了节约膜的使用,在抗体杂交使用量上也要经济。PVDF膜适用于所有的蛋白质、酶的N末端氨基酸序列分析及总氨基酸组成分析,效果十分理想[8]。本方法仅比常规方法多了一个裁胶步骤,对于需大量使用PVDF膜进行蛋白印迹分析的生物医学研究及缺乏western blot使用经验的初始研究工作者和高校实验教学,本方法值得借鉴。
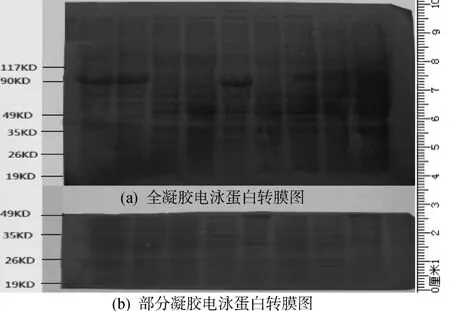
图1 蛋白转移膜考马斯亮蓝染色
3 凝胶电泳刻度玻璃板设计
从上述实验可以看出,凝胶和膜大小参数模糊,是因为现有的凝胶电泳玻璃板上,没有任何标示,配制胶和电泳过程中,电泳相关技术参数(如分离胶的高度、电泳标志物位置和决定凝胶大小等)、凝胶大小和PVDF膜的剪裁难以具体表述,而这些参数对电泳技术及后续的转膜实验操作产生一定的影响,通常是模糊地口口相传,没有具体的大小度量表示和记录,也就限制了研究经验和技术的广泛传播,研究人员沟通方面缺乏客观指标,教学过程不能明确表示,给研究、教学工作带来不便。本文利用AutoCAD软件进行画图,对凝胶玻璃厚板进行创造性的改进,并用photoshop处理完善,生成图片资料 (如图2所示)。在垂直凝胶电泳的长玻璃板外面,设计了纵向刻度标尺和横向刻度标尺。纵向刻度标尺和横向刻度标尺正交,正交中心位于玻璃板的中心,纵向刻度标尺3,位于玻璃板2非凝胶电泳的表面,从下到上蚀刻66个等距离的短线表示 (单位:mm),8个中线和表示单位 (cm) (由1~8阿拉伯数字表示,其中1后面标示cm)的8个长线,构成总长8.3 cm的标尺,其中4 cm处未标示,并位于玻璃板中心位置,上下两边分别标出0.15 cm中的1条短线,刻度和数字均阴文反写于右边。刻度标尺4与刻度标尺3位于同一表面,从右到左依次标示两块垫条玻璃之间的距离8.3 cm,其余情况与刻度标尺3相同。纵向刻度标尺和横向刻度标尺的刻度和符号均为反写,以方便实际操作读数。此设计让使用者可以清楚地观察和交流凝胶电泳过程中,电泳胶配制、电泳标志物位置和后续实验涉及转移膜等大小参数,简单实用,此设计类似于电泳梳的改进[9],都是完善电泳技术而值得发展。该技术有待于进一步地研发,存在一定的社会经济效益。
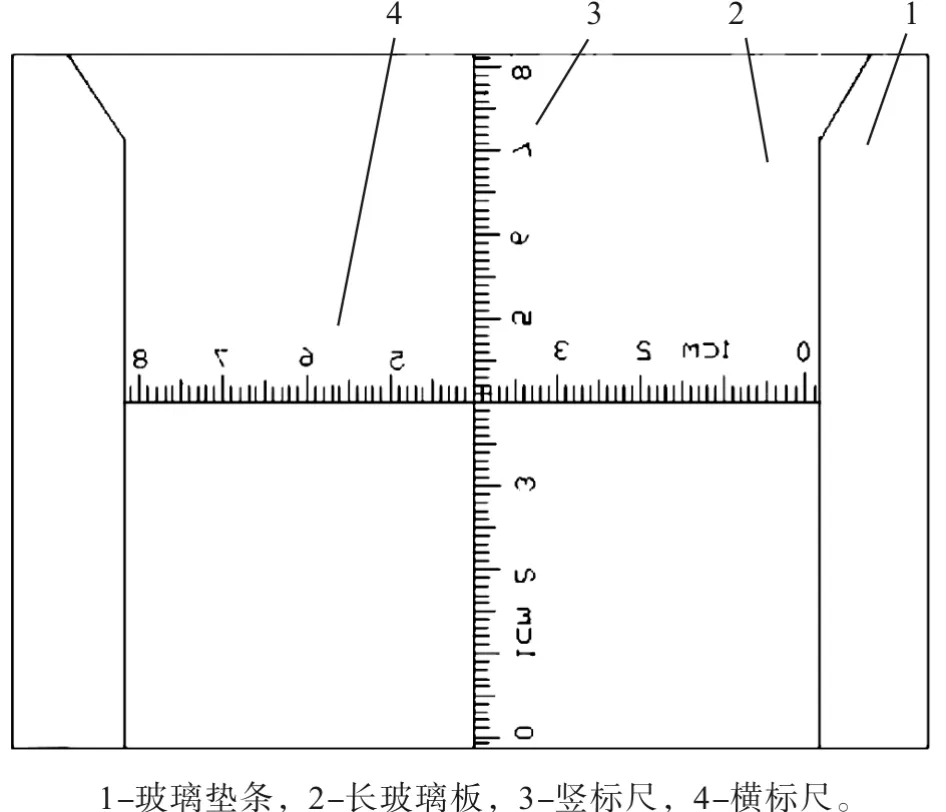
图2 刻度玻璃板外侧面
4 结束语
科学研究在社会经济发展中体现了重要的作用,但多数的科研直接效应并不明显,因此建设和投入不受重视,而科研直接关系着个人和部门的发展,因此实验室成了稀缺资源,条件越好越稀少,实验室资源非常有限[10]。实验室建设除了贵重仪器设备外,在很大程度上依赖于实验技术的改进和提高,尚可在现有条件下,进行一定程度的改进,解决传统实验室面临的设备老化及资源紧缺等问题[11-12]。本文阐述了蛋白印迹分析技术中凝胶电泳和转膜交流表述方面的参数与改进,技术上难度不大,但在此之前,操作过程中存在一定的困难,在高校教学和科研工作中受到了影响,经过查阅资料和实验研究,反复比较,总结成文以飨读者,尤其是在原来基础上对凝胶电泳玻璃板进行创造性的改造,进一步完善了蛋白印迹技术,具有一定的知识产权研发和推广价值。此外,本文对于生物医学基础实验的技术革新和设备建设,也具有一定的参考意义。
[1]王永强,张敬礼.蛋白免疫印迹技术[J].国外医学:临床生物化学与检验学分册,1992,13(3):101-105.
[2]TOWBIN H,STAEHELIN T,GORDON J.Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheet:procedure and some applications[J].Pnas,1979,76(9):4350-4354.
[3]冯爱平,扎拉嘎胡,李威,等.高灵敏的蛋白质免疫印迹新方法用于β-淀粉样蛋白检测[J].生物技术通讯,2014,25(2):245-247.
[4]周毅,别平,孙占平,等.自制和改进实验设备是加强实验室建设的重要途径[J].高校实验室工作研究,2000(1):44-45.
[5]李永明,赵玉琪.实用分子生物学方法手册[M].北京:科学出版社,1998.
[6]黄承汉,胡惠廉,袁恬莹.直接凝胶杂交法的生物素显色与增色[J].生物化学与生物物理进展,1986(6):59-61.
[7]孔令泉,蒲莹晖,马仕坤,等.快慢转法及不同滤膜和显色检测法在western blotting中的应用分析[J].南方医科大学学报,2008,28(1):26-29.
[8]陈丽蓉.PVDF膜在电印迹法中的应用[J].生物技术,1998,8(3):45-46.
[9]韩丁丁.电泳梳的改进[J].生命的化学,2003,23(6):473.
[10]陈功星,王世贵,俞诚,等.普通细胞培养室的建设与管理[J].实验室研究与探索,2011,30(11):151-154.
[11]吴伟哲,韩秀玲.在线虚拟网络实验系统的改进与完善[J].实验室研究与探索,2014,33(1):13-16.
[12]周勇义,黄凯,张黎伟.加强统筹规划建立大型仪器共享保障体系[J].实验技术与管理,2010,27(9):13-15.
