拮抗菌XY1培养条件优化研究
2018-01-12张晓宇高振峰张新宪
张晓宇,高振峰,张新宪
(1.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031;2.山西农业大学农学院,山西 太谷 030801)
在农业生产过程中,每年因病虫草害造成的经济损失巨大[1-2],目前,一般采用化学农药进行防治,但由于化学农药的大量使用,不仅对大气、土壤、水体等造成了严重污染[3-4],影响人们的身体健康,而且病原物的抗药性也在增强[5-6],给病害防治带来困难。用有益生物防治各种作物病虫害是生物防治的一大趋势,近年来,利用拮抗微生物防治芒果炭疽病已取得一定的成效[7-8]。很多试验证明,芽孢杆菌属和假单胞菌属的细菌可作为拮抗微生物,有效防治柑橘青霉病[9]、蒂腐病[10]及绿霉病[11],桃、杏和李的褐腐病[12],樱桃褐腐病[13]。目前,用于病害生物防治的芽孢杆菌主要有短芽孢杆菌(Bacillus brevis),蜡样芽孢杆菌(Bacillus cereus),短小芽孢杆菌(Bacillus pumillus)和多粘芽孢杆菌(Bacillus polymyxa)等,对多种病原菌引起的病害具有防病效果或抑制作用[14]。
本研究首次对从杏叶中筛选出的拮抗菌发酵条件进行优化,旨在为生物抑菌剂的制备奠定一定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株 拮抗菌株Pseudomonas aeruginosa XY1,梨链格孢菌Alternaria alternata和梨尖孢镰刀菌Fusarium oxysporum,由山西省农业科学院农产品贮藏保鲜研究所采后病理实验室分离提供。
1.1.2 培养基 LB培养基:胰蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水 1 000 mL;NB培养基:牛肉膏3 g,蛋白胨 10 g,NaCl 5 g,蒸馏水 1 000 mL;YSP 培养基:酵母膏 5 g,蛋白胨 10 g,蔗糖 20 g,蒸馏水1 000 mL;NYBD培养基:酵母膏 5 g,牛肉膏 8 g,葡萄糖 10 g,蒸馏水1 000 mL;CM培养基:蛋白胨10 g,牛肉膏 3 g,蒸馏水 1 000 mL。
1.1.3 主要仪器及试剂 赛多利斯CP224S型电子天平(德国);DHP-9272型电热恒温培养箱(上海一恒科技有限公司);LS-B50L型立式数显压力蒸汽灭菌锅(江苏江阴滨江医疗器械厂);DHZ-D型恒温摇床(太仓市实验设备厂);UV-5100B型紫外可见分光光度计(上海元析仪器有限公司);GL-20G-Ⅱ型高速冷冻离心机(上海安亭科学仪器厂);PHS-3C型酸度计(上海精科雷磁仪器厂)。试剂均为国产分析纯。
1.2 试验方法
1.2.1 菌体生长量测定 以不接种拮抗菌株的培养基液为空白对照,测定其在波长为600 nm时的发酵液OD值。
1.2.2 抑菌物质积累量的测定 采用抑菌圈法[15],发酵液离心10 min(10 000 r/min)取上清,滤膜过滤后制成无菌滤液。无菌滤液与PDA培养基按照1∶50混匀,待培养基冷却后,将直径为5 mm的梨尖孢镰刀菌和梨链格孢菌菌块接入平板中心,空白对照以无菌水代替无菌滤液。25℃恒温培养,待空白对照将要长满培养皿时,测定病斑菌块的直径,并且计算抑菌率(%)。

1.2.3 种子液制备 挑取新鲜XY1单菌落,接种于20mLNB培养液中,30℃摇床培养 24h(160r/min),制得XY1种子液。
1.2.4 基础培养液筛选 在NB,LB,CM,NYBD,YSP这5种灭菌基础培养液中,按2%的接种量,接种XY1的种子液。28℃黑暗振荡培养72h(160r/min),测定不同基础培养液中XY1菌体生长量(OD600)和抑菌物质的积累量。重复3次。
1.2.5 培养液碳源筛选 分别用麦芽糖、可溶性淀粉、乳糖、蔗糖、糊精和葡萄糖代替上述优化基础培养液中的碳源,将XY1种子液分别接种于培养液中(接种量为2%(V∶V))。28℃黑暗振荡培养72 h(160 r/min),测定不同碳源培养液中XY1菌体生长量(OD600)和抑菌物质的积累量。重复3次。
1.2.6 培养液氮源筛选 将1.2.4和1.2.5筛选到的最佳培养液和最佳碳源为固定培养液和碳源,以蛋白胨、尿素、牛肉膏+蛋白胨、酵母膏+蛋白胨、牛肉膏+酵母膏和胰蛋白胨+酵母膏为氮源制得培养液,将XY1种子液分别接种于培养液中(接种量为2%(V∶V))。28℃黑暗振荡培养 72h(160r/min),测定不同氮源培养液中XY1菌体生长量(OD600)和抑菌物质的积累量。重复3次。
1.2.7 其他培养条件的优化采用正交试验法L16(45)对拮抗菌XY1发酵培养条件中的温度、初始pH值、每250 mL三角瓶装液量和接种量等条件进行5因素4水平优化[16](表1)。在不同的发酵条件下培养成分相同的培养液,测定不同处理培养液的菌体生长量和抑菌物质积累量,同时进行正交试验极差分析。
用1 mol/LHCl和1 mol/L NaOH调节培养液的初始pH。3次重复。

表1 培养条件的正交试验因素和水平
1.3 数据处理
采用Excel对数据进行整理和绘图;采用SPSS 17.0进行正交试验极差分析。
2 结果与分析
2.1 基础培养液对发酵效果的影响
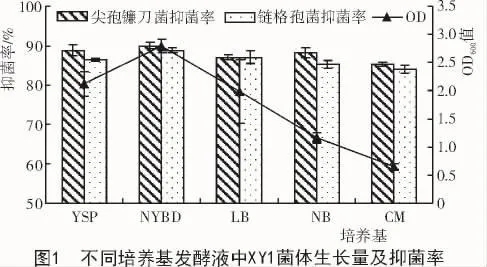
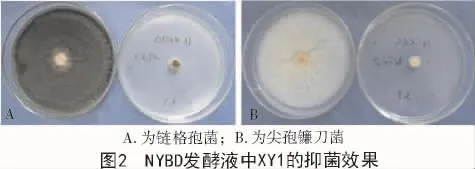
分别用5种不同培养液对拮抗菌株XY1进行72 h培养后,发酵液中的菌体生长量和抑菌物质产生量均存在差异。从图1可以看出,NYBD培养液中XY1菌体生长量最大,CM培养液中XY1菌体生长量最少;比较这5种培养液的无菌滤液对链格孢菌和尖孢镰刀菌的抑菌率后发现,NYBD无菌滤液对链格孢菌和尖孢镰刀菌的抑菌率均比其他培养液抑菌率大(图2)。基于以上试验结果,选择NYBD培养液作为拮抗菌XY1的基础培养液。
2.2 碳源对发酵效果的影响

用6种不同碳源代替NYBD培养基中的葡萄糖,经72 h发酵培养,XY1的菌体生长量和抑菌物质累积量如图3所示。从图3可以看出,XY1菌体生长量在以葡萄糖为碳源的培养液中最多,其次是蔗糖,且二者在0.05水平上差异不显著;比较不同碳源培养液对链格孢菌和尖孢镰刀菌的抑菌率可以发现,蔗糖培养液对链格孢菌和尖孢镰刀菌的抑菌率分别为88.75%和90%。基于以上试验结果,确定蔗糖为菌株XY1发酵最佳碳源。
2.3 氮源对发酵效果的影响
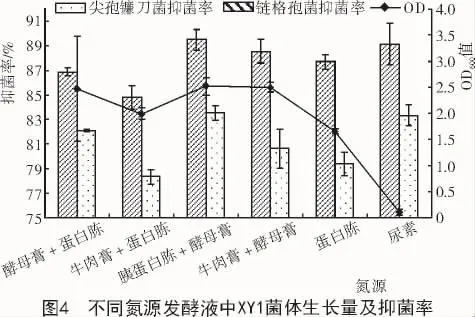
用蔗糖代替NYBD中的葡萄糖、用6种不同氮源代替牛肉膏和酵母膏,72 h发酵培养,XY1的菌体生长量和抑菌物质累积量如图4所示。从图4可以看出,XY1菌体生长量在以胰蛋白胨+酵母膏和牛肉膏+酵母膏为氮源的培养基中较大,且在0.05水平上差异不显著;比较不同氮源培养液对链格孢菌和尖孢镰刀菌的抑菌率可以发现,胰蛋白胨+酵母膏培养液抑菌物质累积最大,对链格孢菌和尖孢镰刀菌的抑菌率分别为89.5%和83.54%。基于以上试验结果,确定胰蛋白胨+酵母膏为菌株XY1发酵最佳氮源。
2.4 正交试验设计优化培养条件

表2 XY1最佳培养条件正交试验结果

续表2
根据上述最佳碳源和氮源的试验结果,按照正交试验设计L16(45)表进行优化条件试验。测定XY1在不同培养条件发酵液的菌体生长量、对链格孢菌和尖孢镰刀菌的抑菌率,采用综合平衡法分析得到培养条件的最佳组合,结果列于表2。
根据平均数k的大小,当试验指标为OD600时,最优水平组合为A3B3C2D4E2;当试验指标为对链格孢菌抑菌效果时,最优水平组合为A2B3C4D1E2;当试验指标为对尖孢镰刀菌抑菌效果时,最优水平组合为A1B3C2D4E2。根据极差大小,当试验指标为OD600时,各因素的主次顺序为B>A>C>E>D;当试验指标为对链格孢菌抑菌效果时,各因素的主次顺序为B>A>D>C>E;当试验指标为对尖孢镰刀菌抑菌效果时,各因素的主次顺序为C>E>B>A>D。根据综合平衡法得到培养条件最佳组合是A2B3C2D1E2,即温度25℃,初始pH值7.0,接种量1%,每250 mL三角瓶装液量40 mL,发酵48 h。在此条件下,与优化前相比,拮抗菌XY1菌体生长量提高6百分点,梨黑斑病抑菌率提高9%,梨枯萎病抑菌率提高10.1百分点(表2)。
3 讨论
本试验系统地研究了拮抗菌株XY1发酵的影响因素,结果表明,菌株XY1发酵的最优培养基配方为:胰蛋白胨8 g,酵母膏5 g,蔗糖9 g,蒸馏水1 000 mL,初始pH值7.0;最优培养条件为:温度25℃,初始pH值7.0,接种量1%、每250 mL三角瓶装液量40 mL,发酵48 h。在此条件下,与优化前相比,拮抗菌XY1菌体生长量提高6百分点,梨黑斑病抑菌率提高9百分点,梨枯萎病抑菌率提高10.1百分点。
拮抗菌发酵条件的优化是菌株中试的基础,鹿秀云等[17]研究结果表明,豆饼粉是拮抗细菌ST-87-14发酵培养基的最适氮源,蔗糖是最适碳源,同时,通过L9(34)正交试验优化了发酵培养条件。朱宏建等[18]对辣椒尖孢炭疽病菌拮抗菌株吸水链霉菌(Streptomyces hygroscopicus)ND045发酵条件进行了优化,菌丝生长抑制率较优化前提高11.01百分点,达到82.61%。闫建芳等[19]对龟裂链霉菌(Streptomyces rimosus)GQ-17的发酵条件和培养基成分进行了优化。邓振山等[20]研究结果表明,对番茄灰霉病菌拮抗菌D6和D10发酵条件优化后,菌株无菌滤液对番茄灰霉病菌的抑制作用增强。李红亚等[21]研究表明,对棉花黄萎病拮抗细菌B.velezensis 6-61进行了发酵条件的优化后,菌株抗菌物质的产量高于通用培养基。姜云等[22]对筛选到的甲基营养型芽孢杆菌(Bacillus methylotrophicus)菌株NJ13进行了发酵培养基配方和培养条件的优化。本研究通过对拮抗菌株XY1发酵条件的优化为后续生防菌剂开发奠定了良好基础。
有报道称,矿质元素及微量元素也可为拮抗菌株提供生长所需营养[23],在今后的发酵培养基筛选时应重视矿质元素及微量元素的作用。
[1]王治明.番茄早疫病暴发成灾原因及防治对策 [J].植物医生,2009(5):23-24.
[2]吕增芳.花椒树蚜虫危害严重的原因及防治建议[J].山西果树,2010(1):39-40.
[3]张小平.化学农药对农业生态环境的污染及防治[J].生态经济,2003(10):166-168.
[4]周文强,樊慧梅.拮抗微生物在生物防治中的研究进展[J].辽宁农业科学,2005(5):32-34.
[5]范永玲,任璐,刘秀英,等.番茄早疫病菌对3种杀菌剂的抗药性监测[J].安徽农业科学,2008,36(26):11431-11433.
[6]吴永官,陆少峰,黄思良,等.华南地区瓜类疫霉对甲霜灵的田间抗药性[J].微生物学报,2011(8):1078-1086.
[7]张荣意,谭志琼,简日明.芒果炭疽病菌生防细菌的筛选、鉴定及生防潜能的初步研究[J].热带作物学报,1998(3):21-27.
[8] BRAVO O N.In vitro effect of Bacillus sp.on growth,sporulation and germination of conidia and spores of new fungi[J].Fitopatologia Colombiana,1993(17):62-72.
[9]詹喜.枯草芽孢杆菌对柑橘采后病害的生物防治及其机理研究[D].杭州:浙江大学,2006.
[10]陈丽锋.柑橘采后蒂腐病菌生物学特性及其拮抗菌研究[D].武汉:华中农业大学,2007.
[11]郝卫宁,李辉,胡美英,等.柑桔绿霉病拮抗细菌的筛选、鉴定及其抑制效果[J].中国生物防治学报,2011,27(2):284-288.
[12] PUSEY P L,WILSON C L.Postharvest biological control of stone fruit brown rot by Bacillus subtilis[J].Plant Diseases,1984,68(2):753-756.
[13] UTKHEDE R S,SHOLBERG P L.In vitro inhibition of plant pathogens by Bacillus subtilis and Enterobacter aerogenes and in vivo control of two postharvest cherry diseases[J].Canadian Journal of Microbiology,1986,32(4):963-967.
[14] VERO S,MONDINO P,BURGUENO J,et al.Characterization of biocontrol activity of two yeast strains from Uruguay against blue mold of apple[J].Postharvest Biology and Technology,2002,26(1):91-98.
[15]汪腾,段雅婕,刘兵团,等.两株香蕉枯萎病拮抗菌在香蕉体内的定殖[J].基因组学与应用生物学,2011,30(3):342-350.
[16]陈志谊,许志刚,高泰东,等.水稻纹枯病拮抗细菌的评价与利用[J].中国水稻科学,2000,14(2):98-102.
[17]鹿秀云,李社增,栗秋生,等.玉米叶斑病拮抗细菌的筛选及其发酵培养基优化[J].中国生物防治,2006,22(Z):47-53.
[18]朱宏建,欧阳小燕,周倩,等.一株辣椒尖孢炭疽病菌拮抗菌株的分离鉴定与发酵条件优化 [J].植物病理学报,2012,42(4):418-424.
[19]闫建芳,刘秋,赵柏霞,等.真菌广谱拮抗菌GQ-17的鉴定、发酵液性质研究及发酵条件优化 [J].沈阳农业大学学报,2012,43(5):534-540.
[20]邓振山,侯改成,孙志宏,等.番茄灰霉病菌拮抗菌D6和D10发酵条件的优化及其抑菌效果[J].西北农林科技大学学报(自然科学版),213,41(9):73-77.
[21]李红亚,李术娜,朱宝成.棉花黄萎病拮抗细菌B.velezensis 6-61拮抗蛋白发酵条件的优化 [J].中国农学通报,2011,27(21):93-99.
[22]姜云,尹望,陈长卿,等.人参内生拮抗细菌NJ13的鉴定及发酵条件[J].农药,2013,52(2):97-101.
[23]石炳兴,赵红,刘春朋,等.抗生素AGPM摇瓶发酵条件的正交试验[J].过程工程学报,2001(4):442-444.
