利用花粉介导法获得油菜RNAi转基因植株
2018-01-12王晓敏王耀辉耿思宇咸栓狮杜春芳王景雪
王晓敏,王耀辉,耿思宇,咸栓狮,杜春芳,王景雪
(1.山西大学生命科学学院,山西 太原 030006;2.山西省农业科学院棉花研究所,山西 运城 044000)
油菜是一种重要的油料经济作物,其产量及质量对其经济价值有着非常重要的影响。油菜不仅是食用植物油的最主要来源,也是潜在的仅次于豆粕的大宗饲用蛋白源,而且还是目前用于解决全球能源危机方向之一的生物柴油的理想原料[1]。目前,油菜的遗传转化研究体系已日趋成熟,用于转化的目的基因也更加多样化,通过将不同优良基因转入油菜,获得转基因植株,从而提高油菜的产量、抗性,改善油菜的品质。吴珣[2]研究表明,将BnSDIR1和BnRab7基因转入甘蓝型油菜提高了植株抗旱、耐盐的能力。BONDARUK等[3]研究表明,将ACP基因转入甘蓝型油菜,提高了油菜种子中不饱和脂肪和硬脂酸的含量。WANG等[4]研究表明,在甘蓝型油菜中导入LRP基因,提高了油菜种子中赖氨酸的含量。LIU等[5]研究表明,将孢子囊和几丁质酶基因导入油菜中,得到的转基因油菜具有很强的抗小菜蛾和核盘菌的能力。ZHU等[6]研究表明,在油菜中转入ThIPK2基因,转基因植株表现出较强的抗盐、抗干旱、抗氧化等非生物逆境的能力。
RNA 干扰(RNA interference,RNAi)是一种经过双链RNA(dsRNA)引发的、过程非常保守的、可以导致同源mRNA特异性降解的现象。RNAi是生物体的一种保护自我的现象,具有重要的生理意义[7]:首先它能够通过降解mRNA来抑制病菌复制[8];其次还能够阻止转座子转座,保证细胞基因组和功能的完整性[9];同时,RNAi还可以使基因沉默,而且是随机的。所以,只要提供与目的基因相对应的dsRNA,就能够达到预想的目的,比基因敲除技术更为方便、快捷。
HKL1是一种己糖激酶类似物,没有催化己糖磷酸化的活性,但在植株的生长发育过程中具有重要作用。HEAZLEWOOD等[10]研究认为,HXK1和HKL1主要位于线粒体上,是植物呼吸过程中必不可少的酶之一。OBAYASHI等[11]研究表明,多种激素与HKL1基因的表达密切相关。己糖激酶(HXK)在植物的生长发育过程中是必不可少的[12]。
杜春芳等[13]的研究主要是对转化方法的研究,杜建中等[14]虽然对转入基因的功能进行了研究,但是也仅限于表型的观察等,更深层次的研究较少。
本试验是第1次采用花粉介导法将RNAi型质粒转入甘蓝型油菜中,并对其基因的表达量等也进行了相应的研究,且外源基因在各代中都稳定遗传。花粉介导法较农杆菌侵染法、PEG法等省去了繁琐的无菌苗组织培养过程,操作更为简单,成本低,实用性更强。
1 材料和方法
1.1 试验材料
试验以甘蓝型油菜品种7B为受体材料,其由山西省农业科学院棉花研究所油菜课题组提供。外源基因为携带有目的基因HKL1的pCaMHKL1-RNAi质粒,质粒线性图谱如图1所示。该质粒中含有GUS标记基因,可用于后续的转基因检测,受35S启动子(CaMV35S)调控。HIndIII和 Xbal为酶切位点。NPTII为新氯霉素转移酶基因,是卡那霉素筛选标记。

1.2 试验方法
1.2.1 质粒DNA的提取 将RNAi质粒转入DH5α感受态细胞,挑取阳性克隆,于LB培养基(Kan 100 mg/L)37℃,180 r/min进行扩大培养后,采用碱裂解法[15]从大肠杆菌中提取质粒DNA,溶于TE溶液,备用。
1.2.2 植物转化 采用花粉介导法[16]进行RNAi质粒的转化。供试材料甘蓝型油菜品种7B种植于山西省农业科学院棉花研究所试验地内,2015年4月初开花。在开花期进行基因转化,转化前将即将开花的主茎或1次分支上的花蕾去雄,第2天上午取当天开花的花粉,置于0.25 mol/L蔗糖溶液中,加入质粒,进行超声波处理。然后,将处理过的花粉授于去雄的雌花柱头上,套袋并标记,同时记录授粉花蕾数。5~6 d后去袋。于当年5月收获种子。
1.2.3 植物DNA提取及PCR转基因鉴定 2015年11月将收获的T0种子播种于温室进行生长。观察幼苗在生长过程中的表型变化,并拍照记录。当植株长出5~6片真叶时,采用CTAB法提取植物的总DNA。由于RNAi质粒携带有GUS标记基因,利用Primer 5.0软件设计GUS基因的上下游引物分别为5′-GTGAATCCGCACCTCTGG-3′和 5′-ATCGCCGC TTTGGACATA-3′。PCR扩增条件为:预变性94℃,3 min;变性 94 ℃,30 s;退火 56 ℃,30 s;延伸 72℃,1 min;终延伸72℃,7 min;30个循环。反应结束后,配置1%的琼脂糖凝胶,进行电泳分析,统计PCR结果。2016年7月将收获的部分T2种子先播种于小花盆,置于4℃,16 h光照、8 h黑暗的生化培养中进行春化处理,后再将其移入温室进行生长。
1.2.4 qRT-PCR检测基因的表达量 qRT-PCR用于检测T2转基因植物和野生型植物中HKL1基因的相对表达量。用Trizol(TaKaRa)从样品中提取植物总RNA,凝胶电泳检测RNA的质量。通过PrimeScript RT gDNA Eraser(TaKaRa) 试剂盒将RNA反转录成cDNA,使用SYBR Premix Ex TaqTM(TaKaRa)试剂进行qRT-PCR试验,将油菜Actin基因的相对扩增作为内部对照。利用Primer 5.0软件分别设计HXK1L和Actin基因的上下游引物HXK1L:5′-TGAAGAAGCAACGAGAAGAGC-3′;5′-ATAGGCAGAGATGGAAGCGGA-3′,Actin:5′-CCCT GGAATTGCTGACCGTA-3′;5′-TGGAAAGTGCTGC TGAGGGATGC。qRT-PCR反应程序为:95℃,15min;95 ℃,10 s;57 ℃,15 s;60 ℃,10 s;72 ℃,20 s;40 个循环。
1.3 数据分析
使用ABI 7500 SDS软件(Applied Biosystems)分析qRT-PCR数据,并用比较Ct法(2-ΔΔCt)处理数据[17]。相关数据统计学分析使用SPSS20.0软件。
2 结果与分析
2.1 花粉介导法获得拟RNAi植株
2015年4月利用花粉介导法进行外源基因转化,于当年5月收获种子,结实率统计如表1所示,T0植株中,去雄总数295个,结果荚数63个,结果荚率为21.36%,收获种子总数为221粒。
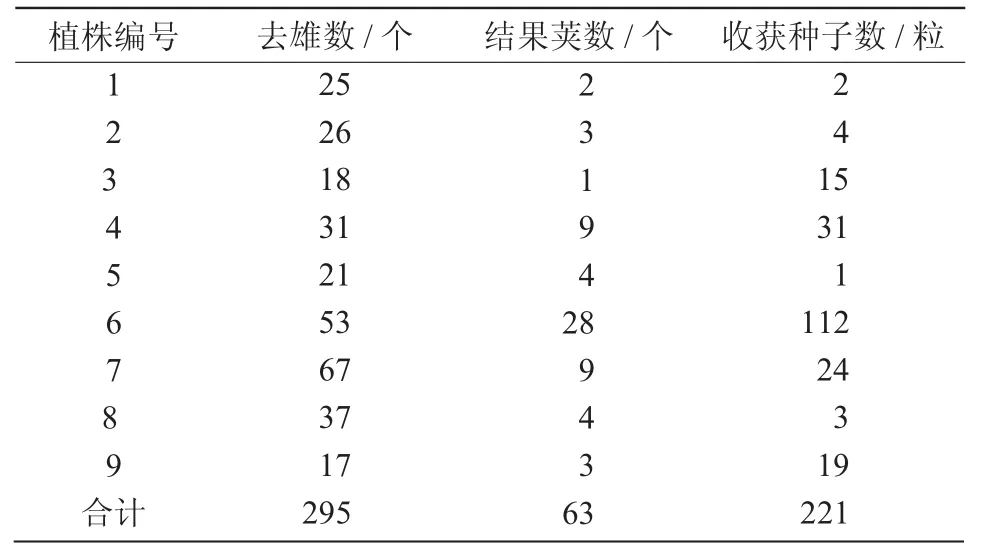
表1 转基因处理后植株结实情况
2.2 转基因植株的鉴定
2015年11月从中选取129粒种子播种于温室,待植物长出5~6片真叶时,提取其基因组DNA(图2),通过PCR扩增检测样品中的GUS标记基因,进行转基因植株鉴定(图3)。结果表明,播种的129粒T1油菜种子,生长过程死亡9棵,剩余的120棵油菜植株中42棵为转基因植物,其中,38棵植株收获T2种子。T2种子在2016年7春化处理后种植于温室,PCR扩增进行转基因植株鉴定。转基因植物中GUS基因的分离比如表2所示。从表2可以看出,转基因植物株系BT2-1,BT2-10和BT2-11中显示出预期的3∶1(转基因∶非转基因植物)的GUS基因的分离比,意味着这些T2转基因株系是杂合子。而在植株株系BT2-9和BT2-12中的T2转基因植株表现为GUS阳性,意味着这些T2转基因株系是纯合子。

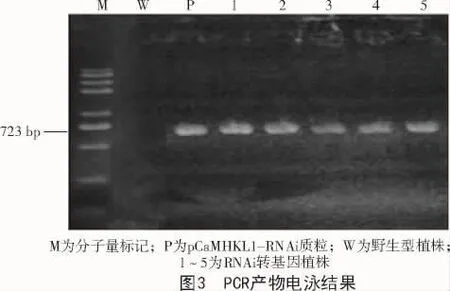
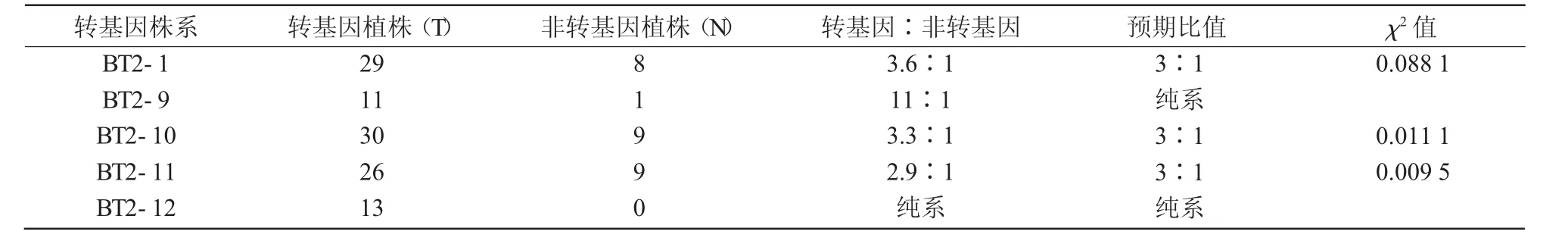
表2 T2转基因油菜植株中GUS基因的分离
2.3 QRT-PCR测定HKL1基因的相对表达量

提取转基因植株的RNA反转录成cDNA进行qRT-PCR试验,利用qRT-PCR试验测定了部分RNAi植株和野生型植株中HKL1基因的相对表达量(图4),结果表明,RNAi植株中HKL1基因的相对表达量为野生型植株的24.6%~67.9%,不同RNAi植株中HKL1基因的表达量各不相同,基因表达量不同是因为其插入位点不同。
2.4 RNAi植株在生长发育过程的表型变化
在T2植株的生长过程中,观察到与野生型植株相比,RNAi型转基因植株真叶长出的时间较晚(图5-A,B),株型也较小(图5-C)。RNA干扰油菜植株中的HKL1基因的表达,会影响植株的生长发育。KARVE等[18]研究表明,在拟南芥中,HKL1负调控植株的生长发育。
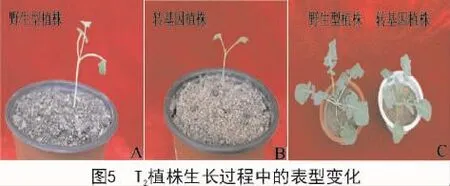
3 讨论
本试验采用花粉介导法进行外源基因转化,相比较于农杆菌侵染、PEG等转化方法省去了繁琐的组织培养过程,操作方便、成本低、实用性强。但是花粉介导法也有其局限性:只有在植物开花期才能采取该方法,有一定的时间局限性;需要人工去雄,将含苞的花蕾剥开摘取雄蕊(这一过程要小心,避免破坏花蕾,影响后期的转化效率);需要超声波辅助将质粒DNA导入花药细胞中,超声时间、功率、次数和每次超声的间隔时间等都会对质粒DNA导入花药细胞和花粉的活力产生较大的影响,而且不同植物的花粉量和花药的活力等不尽相同,要根据具体的试验材料确定其合适的超声参数。所以,利用花粉介导法进行基因转化时,要选择合适的转化条件,提高外源基因的转化率。
本试验是第1次利用花粉介导法将一个RNAi型质粒转入甘蓝型油菜中,旨在探究用花粉介导法转化RNAi型质粒的效率,并简要研究HKL1基因对油菜植株生长和发育的影响。结果表明,利用花粉介导法可以成功地进行RNAi型质粒的转化,而且目的基因可以在后代植株中稳定遗传,其基因分离也符合基本的孟德尔定律。
目前,对己糖激酶(HXK)在植物中的相关研究主要集中在少数模式植物上(如拟南芥、烟草等),TAO等[19]以甘薯为试验材料,研究了其不同组织中HXK的表达量,结果表明,HXK的表达量在甘薯的初始膨大块根中最高,在成熟叶片中最低。KARVE等[20]研究认为,己糖激酶在植物中经常以多基因家族的方式出现。HÄUSLER等[21]研究发现,植物中HXKs可以把叶绿体生成的糖信号传导到细胞核中,调节光合反应中有关基因的表达。KELLY等[22]研究发现,在拟南芥和番茄中过表达HXK1,能够降低拟南芥气孔导度和蒸腾作用。
在甘蓝型油菜中HXKs的研究尚未报道,对油菜中HXK基因表达的时空变化、对非生物胁迫的响应以及在油菜中的作用仍不清楚。所以,研究甘蓝型油菜中的HXK及其功能是有必要的。本试验结果可以为HXKs在植物中的表达情况及其相关的功能研究提供一些理论依据,以完善HXKs在植物方面的相关研究。
[1]曲晓言.农杆菌介导油菜转基因研究[D].昆明:云南农业大学,2012.
[2]吴珣.甘蓝型油菜抗旱耐盐基因BnSDIRl和BnRab7的克隆及功能鉴定[D].武汉:华中农业大学,2013.
[3] BONDARUK M,JOHNSON S,DEGAFU A,et al.Expression of a cDNA encoding palmitoyl-acyl carrier protein desaturase from cat's claw (Doxantha unguis-cati L.) in Arabidopsis thaliana and Brassiea napus leads to accumulation of unusual unsaturated fatty acids and increased stearic acid content in the seed oil[J].Plant Breeding,2007,126(2):186-194.
[4]WANG J,CHEN L,LIU Q Q,et al.Transformation of LRP gene into Brassica napus mediated by agrobacterium tumefaciens to enhance lysine content in seeds[J].Russian Journal of Genetics,2011,47(12):1433-1437.
[5]LIUH B,GUO X,NAEEMM S,et al.Transgenic Brassica napus L.lines carrying a two gene construct demonstrate enhanced resistance against Plutella xylostella and Sclerotinia sclerotiorum[J].Plant Cell Tissue and Organ Culture,2011,106(1):143-151.
[6]ZHU J Q,ZHANG J T,TANG R J,et al.Molecular characterization of ThIPK2,an inositol polyphosphate kinase gene homolog from Thellungiella halophila,and its heterologous expression to improve abiotic stress tolerance in Brassica napus[J].Physiologia Plantarum,2009,136(4):407-425.
[7]郑宁宁,丁旭东,宋晓宇,等.RNA干扰对小鼠脾淋巴细胞分泌TNF-α 的影响[J].中国医科大学学报,2006,35(5):449-450.
[8]施巧素.水稻内源siRNA的序列测定及分析[D].广东:中山大学,2007.
[9]刘若雪.烟草表皮毛蛋白NtTTG1与转录因子AtMYB44调控植物防卫反应信号传导的机制[D].南京:南京农业大学,2010.
[10] HEAZLEWOOD J L,TONTI-FILIPPINI J S,GOUT A M,et al.Experimental analysis of the Arabidopsis mitochondrial proteome highlights signalling and regulatory components,provides assessment of targeting prediction programs,and indicates plant-specific mitochondrial proteins[J].The Plant Cell,2004,16:241-256.
[11] OBAYASHI T,KINOSHITA K,NAKAI K,et al.ATTED-II:a database of co-expressed genes and cis elements for identifying co-regulated gene groups in Arabidopsis[J].Nucleic Acids Research,2007,35:863-869.
[12] ROLLAND F,BAENAGONZALEZ E,SHEEN J.Sugar sensing and signaling in plants:conserved and novel mechanisms[J].Annual Review of Plant Biology,2006,57(1):675.
[13]杜建中,孙毅,王景雪,等.转水稻NibT基因玉米植株的获得及抗病性研究[J].西北植物学报,2011,31(5):893-901.
[14]杜春芳,刘惠民,李朋波,等.花粉介导法获得油菜转基因植株研究[J].作物学报,2006,32(5):749-754.
[15]KARL D HAUFFE,STEPHEN P LEE,RAJAGOPAL SUBRAMANIAM,et al.Combinatorial interactions between positive and negative cis acting elements control spatial patterns of 4CL1 expression in transgenic tobacco[J].The Plant Journal,1993,4(2):235-253.
[16] WANG J X,LI Y H,LIANG C.Recovery of transgenic plants by pollen-mediated transformation in Brassica juncea[J].Transgenic Res,2008,17:417-427.
[17] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25:402-408.
[18]KARVE A,MOORE B.Function of Arabidopsis hexokinase-like1 as a negative regulator of plant growth[J].Journal of Experimental Botany,2009,60(14):4137-4149.
[19] TAO X,GU Y H,WANG H Y.Digital gene expression analysis based on integrated de novo transcriptome assembly of sweet potato(Ipomoea batatas(L.)Lam.)[J].PloSOne,2012,7(4):e3623.
[20] KARVE R,LAURIA M,VIRNIG A,et al.Evolutionary lineages and functional diversification of plant hexokinases[J].Molecular Plant,2010,3(2):334-346.
[21] HÄUSLER R E,HEINRICHS L,SCHMITZ J,et al.How sugars might coordinate chloroplast and nuclear gene expression during acclimation to high light intensities[J].Molecular Plant,2014,7:1121-1137.
[22]KELLY G,DAVID-SCHWARTZ R.The pitfalls of transgenic selection and new roles of AtHXK1:a high level of AtHXK1 expression uncouples hexokinase1-dependent sugar signaling from exogenous sugar[J].Plant Physiology,2012,159(1):47-51.
