欧前胡素衍生物的合成与血管舒张活性研究
2018-01-12黄立敏李友佳侯亚静贺怀贞
黄立敏,李友佳,侯亚静,王 程,魏 迪,贺怀贞*
(1.西安交通大学药学院,西安 710061;2.西安交通大学第二附属医院,西安 710004)
高血压是最常见的心血管疾病,严重影响人类健康,甚至威胁生命[1-3]。高血压治疗周期长,化学药物治疗是其防治的重要手段,目前,临床上常用的降压药主要有利尿剂、β受体阻滞剂、钙通道拮抗剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂以及肾素抑制剂六大类[4-9]。这些药物在发挥药效的同时,也会产生一些毒性和不良反应,如利尿剂的长期使用会造成电解质紊乱,钙通道拮抗剂会产生水肿、面红、头痛、头晕等现象[10-14]。因此,新的降压药物的研究与开发仍是目前药物研究关注的热点。
血管紧张素转换酶抑制剂通过抑制血管紧张素Ⅰ转换为血管紧张素Ⅱ,不灭活缓激肽,产生降压效应。钙通道拮抗剂通过选择性地减少Ca2+内流,干扰细胞内Ca2+浓度,从而产生降压效应。尽管各类降压药物作用机制不同,但舒张血管是它们起效的基本途径[15]。本课题组前期研究发现,白芷中主要成分欧前胡素具有一定的血管舒张活性,在此基础上优化结构,得到系列具有血管舒张特性的化合物[16-18]。本研究拟保留欧前胡素活性母核结构,以Williamson醚化为关键反应步骤,设计合成4个欧前胡素衍生物,产物结构经IR,MS,1H-NMR,13C-NMR进行确证。采用多通道微血管张力测定方法对其血管舒张活性进行初步考察,应用计算机辅助药物设计软件中的Surflex-dock模块,对所得化合物与可能靶标蛋白的相互作用进行初步分析。
1 仪器与试药
1.1仪器 X-4型显微熔点测定仪(予华仪器有限责任公司);LC-MS-8040质谱仪(日本岛津公司);AVANCE 400 MHz核磁共振波谱仪(NMR,德国布鲁克公司);DMT血管张力测量系统(丹麦DMT公司);倒置显微镜(上海光学仪器厂);优谱超纯水制备机(成都超纯科技有限公司);微量移液器(大龙医疗设备有限公司);电子天平(德国赛多利斯集团)。
1.2试药 8-甲氧基补骨脂素(南京春秋生物工程有限公司);氘代试剂CDCl3(萨恩化学技术有限公司);柱层析硅胶(300~400目,青岛海洋化工有限公司);雄性SD大鼠(250~300 g,西安交通大学实验动物中心提供);其他试剂均为分析纯。
2 方法
2.1目标化合物的合成 见图1。
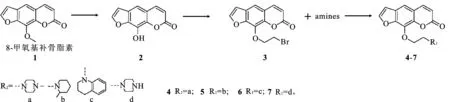
图1欧前胡素衍生物的合成路线
Fig.1 The synthetic route of imperatorin derivatives
2.1.18-羟基补骨脂素(化合物2)的合成 将2.50 g(11.57 mmol)8-甲氧基补骨脂素置于圆底烧瓶中,用35 mL干燥的二氯甲烷溶解,氮气保护,0 ℃下搅拌10 min,避光条件下缓慢滴入10 mL溶有6.5 mL三溴化硼的二氯甲烷溶液。室温反应4 h,TLC监测(乙酸乙酯∶石油醚=1∶2)反应进程。反应完毕后,将反应液缓慢倒入100 mL饱和碳酸氢钠溶液中,室温搅拌1 h后,抽滤,洗涤,干燥,得白色固体粉末8-羟基补骨脂素2.15 g(10.65 mmol),产率92.1%。mp249~251 ℃[11];Rf=0.24(乙酸乙酯∶石油醚=1∶1);IR (KBr):υmax3 294 (-OH),3 132 (furan-CH),3 063(ArH),1 697(-C=O),1 157(-C-O-C-)cm-1;1H-NMR (400 MHz,CDCl3):δ 8.07(d,J=9.6 Hz,1H,H-pyrano),8.04 (d,J=2.4 Hz,1H,H-furan),7.42 (s,1H,ArH),7.01(d,J=2.4 Hz,1H,H-furan),6.35 (d,J=9.6 Hz,1H,H-pyrano);EI-MS(m/z):201.9[M]+。
2.1.29-(2-溴乙氧基)-7H-呋喃并[3,2-g]苯并吡喃-7-酮(化合物3)的合成 将1.01 g(5.00 mmol)化合物2溶于75 mL无水丙酮中,加入0.83 g(6.00 mmol)无水碳酸钾,在氮气保护下室温搅拌30 min,在反应液中分别加入2.5 mL(28.88 mmol)1,2-二溴乙烷,在50 ℃下反应12 h,反应结束后,将反应液降至室温,并将其倒入冰水中,用乙酸乙酯萃取,合并有机相,有机相依次用清水和饱和食盐水洗涤,无水硫酸钠干燥,浓缩,柱层析分离(乙酸乙酯∶石油醚=1∶2)得白色固体9-(2-溴乙氧基)-7H-呋喃并[3,2-g]色烯-7-酮1.32 g(4.27 mmol),产率85%。mp148~149 ℃[11];Rf=0.63(乙酸乙酯∶石油醚=1∶1);IR(KBr):υmax3 155 (furan-CH),3 070(ArH),2 878 (-CH2-),1 697(-C=O),1 589 (-C=C-),1 157(-C-O-C-)cm-1;1H-NMR (400 MHz,CDCl3):δ7.78 (d,J=9.6 Hz,1H,CH=HC-C=O),7.72 (s,1H,CH=HCO),7.41(1H,s,ArH),6.84 (s,1H,CH=HCO),6.39 (d,J=9.2 Hz,1H,CH=HC-C=O),4.76(t,J=6.4 Hz,2H,-OCH2CH2Br),3.75 (t,J=6.4 Hz,2H,-OCH2CH2Br);EI-MS(m/z):307.9 [M]+。
2.1.3化合物4~7的合成 将5.00 mmol化合物3溶于150 mL无水丙酮中,加入0.83 g(6.00 mmol)无水碳酸钾,在氮气保护下室温搅拌30 min,在反应液中分别加入6.00 mmol不同的有机胺盐,在50 ℃下继续反应12 h,反应结束后,减压蒸去溶剂,将残余固体溶于乙酸乙酯,有机相依次用清水和饱和食盐水洗涤,无水硫酸钠干燥,浓缩进行柱层析分离得产品。
2.1.3.19-(2-(4-甲基-1-哌嗪基)乙氧基)-7H-呋喃并[3,2-g]色烯-7-酮(化合物4) 白色固体,产率90%;mp73-74 ℃;Rf=0.29 (氯仿∶甲醇,10∶1);IR (KBr):υmax3 148(furan-CH),3 063 (ArH),2 937(-CH3),2 880(-CH2-),1 732(-C=O),1 587(-C=C-),1 541(-C=C-),1 148 (-C-O-C-)cm-1;1H-NMR(400 MHz,CDCl3)δ7.77 (d,J=9.6 Hz,1H,H-pyrano),7.69 (s,1H,H-furan),7.37 (s,1H,ArH),6.82 (s,1H,H-furan),6.37 (d,J=9.2 Hz,1H,H-pyrano),4.60 (t,J=5.2 Hz,2H,-OCH2CH2N),2.91 (t,J=5.2 Hz,2H,-OCH2CH2N),2.66 (s,4H,-N(CH2CH2)2NCH3),2.45 (s,4H,-N(CH2CH2)2NCH3),2.28 (s,3H,-N(CH2CH2)2NCH3);EI-MS(m/z):328.1[M]+。
2.1.3.29-(2-(2-甲基-1-哌啶基)乙氧基)-7H-呋喃并[3,2-g]色烯-7-酮(化合物5) 白色固体,产率68%;mp102~103 ℃;Rf=0.60 (氯仿∶甲醇=10∶1);IR (KBr):υmax3 148 (furan-CH),3 067(ArH),2 930(-CH3),2 853(-CH2-),1 728(-C=O),1 587(-C=C-),1 508(-C=C-),1 150(-C-O-C-)cm-1;1H-NMR(400 MHz,CDCl3):δ7.77(d,J=9.6 Hz,1H,H-pyrano),7.69 (s,1H,H-furan),7.35(s,1H,ArH),6.82 (s,1H,H-furan),6.37 (d,J=9.6 Hz,1H,H-pyrano),4.62 (d,J=3.6 Hz,2H,-OCH2CH2N),3.31~3.15 (m,1H,-(CH2)2NCHCH3),3.08~2.83(m,2H,-OCH2CH2N),2.52~2.33(m,2H,-CH2NCH(CH3)CH2-),1.68~1.46(m,4H,-CH3CHCH2CH2CH2CH2N),1.36~1.21(m,2H,-CH2NCH(CH3)CH2-),1.11(d,J=6.0 Hz,3H,-(CH2)2NCHCH3); EI-MS(m/z):327.1[M]+。
2.1.3.39-(2-(3,4-二氢喹啉-1(2H)-基)乙氧基)-7H-呋喃并[3,2-g]色烯-7-酮(化合物6) 白色固体,产率77%;mp143~145 ℃;Rf=0.27(石油醚∶乙酸乙酯=1∶4);IR(KBr):υmax3 150(furan-CH),3 063(ArH),2 845(-CH2-),1 734(-C=O),1 590(-C=C-),1 504(-C=C-),1 150(-C-O-C-)cm-1;1H-NMR (400 MHz,CDCl3):δ7.76 (d,J=9.6 Hz,1H,H-pyrano),7.65(s,1H,H-furan),7.34 (s,1H,ArH),7.04 (t,J=7.8 Hz,1H,ArH),6.95 (d,J=6.6 Hz,1H,ArH),6.80 (s,1H,H-furan),6.68(s,1H,ArH),6.59 (s,1H,ArH),6.37(d,J=9.6 Hz,1H,H-pyrano),4.72 (s,2H,-OCH2CH2N),3.82 (t,J=5.8 Hz,2H,-OCH2CH2N),3.56 (s,2H,-NCH2CH2CH2-),2.77 (s,2H,-NCH2CH2CH2-),1.99 (s,2H,-NCH2CH2CH2-);EI-MS(m/z)361[M]+。
2.1.3.49-(2-(哌嗪基)乙氧基)-7H-呋喃并[3,2-g]色烯-7-酮(化合物7) 白色固体,产率31%;mp178~180 ℃;Rf=0.09(氯仿∶甲醇=10∶1);IR(KBr):υmax3 416(NH),2 835(-CH2-),1 718(-C=O),1 589(-C=C-),1 126(-C-O-C-)cm-1;1H-NMR(400 MHz,CDCl3):δ 7.63 (s,1H,ArH),7.31(d,J=8.4 Hz,1H,H-pyrano),6.87~6.82(m,1H,H-furan),6.78~6.74(m,1H,H-furan),6.65 (d,J=9.2 Hz,1H,H-pyrano),6.24 (s,1H,NH),5.18(s,2H,-OCH2CH2N),3.88 (s,2H,-OCH2CH2N),3.53(s,4H,-N(CH2CH2)2NH),3.44(s,4H,-N(CH2CH2)2NH);EI-MS(m/z):314.1[M]+。
2.2血管舒张活性评价
2.2.1Kreb′s溶液的配制 制取1 000 mL新鲜的三蒸水。见表1,按照表1配制缓冲盐体系,用1 mol·L-1的盐酸调节pH值至7.4,将Kreb′s溶液置于4 ℃冰箱中保存,现配现用。
2.2.2供试品溶液的配制 欧前胡素衍生物浓度梯度溶液:精密称取化合物4,5,6和7,并用一定量的DMSO溶液溶解为储备液,用水或DMSO稀释,配制成终浓度分别为1×10-7,3×10-7,1×10-6,3×10-6,1×10-5,3×10-5和1×10-4mol·L-1的系列化合物溶液,置于4 ℃冰箱中避光保存。
2.2.3微血管的分离 将雄性SD大鼠脱颈处死,取其肠系膜动脉、肾动脉和脑基底动脉。置于4 ℃Kreb′s溶液中,分别制备成每段3~4 mm的血管环[12-13]。
表1Kreb′s溶液的配制
Tab.1 The preparation of Kreb′s solution

试剂名称相对分子质量/M用量/g·L-1摩尔量/mmol·L-1氯化钠58.486.954119.0碳酸氢钠84.011.26015.0氯化钾74.550.3434.6氯化钙110.980.1661.5六水合氯化镁203.300.2441.2二水合磷酸二氢钠156.010.1871.2葡萄糖180.161.0906.1
2.2.4实验测定 将分离好的血管用两根长3.0 cm的细钢丝贯穿血管腔,两端分别与浴槽内的2个灌流针连接即固定在张力换能器水浴槽的中心位置,加热,设定温度37 ℃,血管环置于95%氧气和5%二氧化碳混合气体饱和的Kerb′s溶液中。调零稳定后,给予血管环3 mN的预张力,平衡1.5~2.0 h,期间每隔20 min换1次Kreb′s溶液。待血管环张力稳定平衡后,去除滞留的Kreb′s液,将60 mmol·L-1K+rich-Kreb′s溶液置于张力换能器中的水浴槽中检验动脉环收缩性,待血管环收缩达到稳定平台后,用Kreb′s溶液冲洗血管环3遍,使其张力恢复至基线水平。2次收缩幅度相差小于10%者用于实验。血管收缩稳定后依次加入5 μL待测药物的浓度梯度溶液,记录血管环张力的变化,分别考察目标化合物对高钾溶液所致不同血管收缩的舒张作用。
2.3分子对接 前期研究表明,欧前胡素降压作用的作用位点可能是电压依赖的L-型钙离子通道中的α-1C受体[12]。因此,在本实验中,在PDB蛋白数据库中选取L-型钙离子通道中α-1C受体蛋白(PDB ID:3G43),选用Sybyl-X软件中的Sulflex对接模型与目标化合物进行模拟对接。采用Sybyl/Sketch模块构建底物分子,优化过程中采用Powell′s 能量梯度法,利用Tripos分子力场进行能量最小化计算,能量收敛限定为0.005 Kcal·mol-1,化合物中各原子净电荷类型为Gasteiger-Hückle型,迭代次数设定为1 000次获得最佳构象。
3 结果与讨论
3.1合成部分 实验以8-甲氧基补骨脂素为原料,以Williamson醚化反应为关键步骤合成目标化合物。在欧前胡素衍生物中引入含氮侧链,使得衍生物易于成盐,有利于提高欧前胡素衍生物的水溶性,增强衍生物的成药性。通过考察反应溶剂、缚酸剂优化Williamson醚化反应。反应溶剂考察了N,N-二甲基甲酰胺(DMF)和丙酮,在合成目标产物的过程中,DMF作为溶剂时,生成的副产物多且后处理不易除去;缚酸剂考察了强碱氢氧化钠和弱碱碳酸钾,氢氧化钠可导致吡喃酮环发生分子环反应。因此,选择丙酮作为反应溶剂,碳酸钾作为酸结合剂,50 ℃下反应12 h,得到目标产物。
3.2血管舒张活性 欧前胡素衍生物对肠系膜动脉、肾动脉和脑基底动脉的血管舒张效应见表2和图2。由表2和图2可知,所得4种衍生物对3种不同血管均具有不同程度的舒张活性,最大舒张率基本均达到90%以上;与肾动脉和脑基底动脉相比,4种衍生物在肠系膜动脉中血管舒张效应相对较好,其中化合物5在3种不同血管中的舒张效应均高于欧前胡素;化合物5~7的侧链分别为2-甲基哌啶、四氢喹啉及哌嗪,三者在所测血管上作用趋势相同,其血管舒张活性均逐渐降低;在肠系膜动脉中,化合物4与7相比,将侧链哌嗪环的仲胺氢置换为甲基后,脂溶性增加,化合物活性增强,然而在肾动脉和脑基底动脉中活性差别不大。与前期研究相比[11],本实验合成的化合物总体血管舒张活性优于前期合成的化合物,在后期研究中可继续对其结构进行优化,期待得到活性更强的化合物。
表2欧前胡素(IMP)及其衍生物对大鼠肠系膜动脉、肾动脉及脑基底动脉舒张的pEC50和Emax(%)值
Tab.2 The pEC50and Emax(%) of imperatorin(IMP)and its derivatives on rat mesenteric artery,renal artery and basilar arterymodel

化合物R1肠系膜动脉pEC50Emax/%肾动脉pEC50Emax/% 脑基底动脉pEC50Emax/%IMP-5.20±0.09 96.00±1.004.95±0.14 85.60±4.005.26±0.25 65.00±4.2045.47±0.33 88.80±9.154.33±0.02 99.80±0.594.32±0.07100.00±0.0055.67±0.05109.00±11.315.19±0.01107.40±2.445.69±0.21107.30±9.6664.79±0.10 93.90±4.164.97±0.08104.50±3.854.77±0.02102.80±3.1174.59±0.31 92.40±5.714.52±0.12 94.10±2.874.69±0.31 93.30±5.67

图2欧前胡素衍生物在大鼠动脉的量效曲线(n=6)
A.肠系膜动脉;B.肾动脉;C.脑基底动脉。
Fig.2 The dose-effect curve of imperatorin derivatives on the rat artery model(n=6)
A.rat mesenteric artery;B.renal artery;C.basilar artery.
3.3分子对接 化合物5与α-1C受体蛋白(PDB ID:3G43)的作用结果见图3A。化合物5中内酯环2位羰基上的-O-与Thr110残基上的H形成1个氢键,键长为2.22 Å;内酯环1位的-O-与His 107残基上的H形成1个氢键,键长为1.95 Å;呋喃环的-O-与Lys94残基上的H形成1个氢键,键长为2.28 Å;酚醚中的-O-分别与His 107和Lys94残基上的H形成2个氢键,键长分别为2.35和2.32 Å。基于以上分析,化合物5与α-1C受体蛋白氨基酸残基上的H形成了5个氢键,且键长均小于3 Å;与前期合成的联苯型香豆素类化合物相比[11],此类化合物与靶标蛋白相互作用中,氢键作用力可能是主要贡献,且化合物5与靶标蛋白形成的氢键数量多,其含氮柔性侧链伸入到活性空腔,有较好的契合性,见图3B。化合物5与靶标蛋白的作用模式与化合物4,6和7不同,见图3C。化合物5与受体有较好亲和力,这与活性实验结果一致。

图3分子对接图
A,B.化合物5与α-1C受体蛋白(PDB ID:3G43)作用模式图;C.化合物4,5,6和7与α-1C受体蛋白作用模式图。
Fig.3 Molecular docking
A,B.binding mode of compound5toα-1C(PDB ID:3G43);C.binding mode of compounds4,5,6and7toα-1C.
4 结论
本研究在保留欧前胡素母核结构的基础上,以Williamson醚化反应为关键步骤,设计合成4个欧前胡素衍生物,产物结构经IR,MS,1H-NMR和13C-NMR进行确证,反应步骤简单,条件温和。多通道微血管张力测定结果表明,4个化合物均具有不同程度的血管舒张活性,其中化合物5在3种不同血管中的舒张效应均高于欧前胡素。进一步分子对接研究表明,化合物5与可能作用受体有较好的亲和力,为欧前胡素衍生物结构优化提供理论依据。
[1] Kanaoka T,Tamura K,Ohsawa M,et al.Relationship of ambulatory blood pressure and the heart rate profile with renal function parameters in hypertensive patients with chronic kidney disease[J].Clin Exp Hypertens,2012,34(4):264-269.
[2] Ghosh R K,Ball S,Das A,et al.Selexipag in pulmonary arterial hypertension:most updated evidence from recent preclinical and clinical studies[J].J Clin Pharmacol,2017,57(5):547-557.
[3] 潘俊龙.高血压常见药物与治疗方法的研究进展[J].中国当代医药,2014,21(5):185-187.
[4] 吴金珊,李佳.抗高血压药物的研究进展和临床应用[J].中国实用医药,2009,4(23):231-232.
[5] 苏定冯.新型抗高血压药物研究进展[J].中国药理学通报,1991,7(2):92-94.
[6] 郭永辉,张小民.阿托伐他汀联合普罗布考对糖尿病合并高血压患者的影响[J].西北药学杂志,2015,30(2):191-192.
[7] 谢娜.抗高血压药物研究新进展[J].中国现代药物应用,2009,3(14):198-200.
[8] 王艳春,吕巧莉,孙建勋,等.我国近5年降脂药药物经济学研究文献分析[J].中国药房,2016,27(26):3609-3613.
[9] Julius S.Amlodipine in hypertension:an overview of the clinical dossier[J].J Cardiovasc Pharmacol,1988,12(Suppl 7):S27-S33.
[10]卢奕,何英,李东,等.阿托伐他汀不良反应的流行病学特征研究[J].中国药业,2014,23(3):46-49.
[11]蒋丽华,薛爱英.阿托伐他汀钙致29例不良反应文献分析[J].包头医学院学报,2015,31(4):80-81.
[12]鄢琳,王振纲.探讨中国、美国及欧洲高血压防治指南中有关药物治疗的问题[J].中国药理学通报,2006,22(1):14-19.
[13]梁峰,胡大一,沈珠军,等.2014年美国成人高血压治疗指南[J].中华临床医师杂志:电子版,2014,8(2):252-260.
[14]Widelski J,Popova M,Graikou K,et al.Coumarins fromAngelicaLucidaL.-antibacterial activities[J].Molecules,2009,(14):2729-2734.
[15]Zhou N,He J Y,Wang T,et al.Design,synthesis,and vasorelaxation activity of novel imperatorin derivatives[J].J Asian Nat Prod Res,2013,15(6):650-657.
[16]王程,周楠,潘晓艳,等.联苯型呋喃香豆素类衍生物的设计合成与活性评价[J].西北大学学报:自然科学版,2014,44(4):573-577.
[17]Li N,He J,Zhan Y Z,et al.Design,synthesis and preliminary evaluation of novel imperatorin derivatives as vasorelaxant agents[J].Med Chem,2011,7(1):18-23.
[18]Xu Y C,Leung S W S,Yeung D K Y,et al.Structure-activity relationships of flavonoids for vascular relaxation in porcine coronary artery[J].Phytochemistry,2007,(68):1179-1188.
