硝苯地平缓释微丸在Beagle犬体内的药动学及生物等效性
2018-01-12肖正林丁劲松
肖正林,丁劲松
(1.湘潭市中心医院药学部,湘潭 411100;2.中南大学药学院 长沙 410013)
硝苯地平(nifedipine)作为第1个二氢吡啶类钙通道阻滞剂,由德国拜耳公司于1969年首次合成并成功上市,目前是用于口服治疗高血压和心绞痛的首选药物之一[1-4],其普通短效(4~8 h)制剂给药频繁,个体差异性及血药浓度波动大,大剂量使用时可产生心律失常,增加心脏猝死的危险性[5];而长效缓控释制剂给药频次每日1~2次,药效平稳,可有效减轻上述不良反应的发生,用药安全性和依从性更好[6-7]。本文前期研究中[8],以硝苯地平为模型药物,采用流化床上药法制备含药素丸,并以 Eudragit®RL、RS缓释膜材包衣制备硝苯地平缓释微丸,以减少给药频次、平稳血药浓度、降低不良反应的发生率,从而提高临床用药的依从性。通过已上市产品Coracen®为对照,比较Beagle犬服用硝苯地平缓释微丸和Coracen®后的体内药动学行为,旨在证明硝苯地平缓释微丸具有良好的缓释效果,同时为新剂型的研究和临床合理用药提供参考。
1 仪器与材料
1.1仪器 API3000型三级四极杆液质联用仪(AB SCIEX公司);TGL-16M低温高速离心机(长沙英泰仪器有限公司);BS 224S万分之一天平(德国赛多利斯公司);TDD-5M型多管低速离心机(长沙英泰仪器有限公司);MTN-2800D氮吹仪(AUTO SCIENCE公司);TARGINTM VX-Ⅱ涡旋振荡仪(北京踏锦科技有限公司);WH-2微量旋涡混合仪(上海沪西分析仪器厂);KL-up-Ⅱ-10型超纯水机(台湾艾柯公司)。
1.2材料 硝苯地平对照品(批号136515,质量分数>99.7%,山西临汾宝珠制药有限公司);地西泮对照品(批号100326,质量分数>99.5%,中国食品药品检定研究院);硝苯地平缓释微丸(自制,规格为20 mg);硝苯地平缓释胶囊Coracen®(参比制剂,规格为20 mg,英国优时比制药有限公司);其余试剂均为分析纯。
1.3动物 Beagle犬6只,雌雄各半,均由湖南省实验动物中心提供,合格证号:SCXY(湘)2013-0021。
2 方法与结果
2.1实验方案及血样采集 采用自身交叉单剂量口服给药。6只Beagle犬编号1~6,随机分为2组,每组3只。给药前禁食12 h,分别给予硝苯地平缓释微丸或上市缓释胶囊各1粒,于给药后0,0.5,1,1.5,2,4,6,8,10,12和24 h分别取前腿静脉血5 mL,以3 000 r·min-1离心15 min,取上层血清,于-20 ℃避光保存。
2.2血浆样品处理 精密吸取血样500 μL,置于10 mL具塞离心管中,加入内标溶液(1 μg·mL-1地西泮溶液)50 μL和1 mol·L-1氢氧化钠溶液50 μL,混匀,加入3 mL乙醚,涡旋3 min,以3 000 r·min-1离心12 min,取上层清液2.4 mL,40 ℃氮气挥干,加入流动相150 μL复溶,涡旋1 min,以12 000 r·min-1离心10 min,取上清5 μL,进样分析。
2.3储备液的配制 硝苯地平对照品储备液的配制:精密称取硝苯地平对照品10 mg,置于100 mL量瓶中,适量甲醇超声溶解,甲醇定容至刻度,摇匀,即得质量浓度为100 μg·mL-1的硝苯地平对照品储备液(1)。精密吸取上述对照品储备液(1)1 mL,置于100 mL量瓶中,用甲醇定容至刻度,摇匀,即得质量浓度为1 μg·mL-1的硝苯地平对照品储备液(2),于4 ℃避光保存,备用。
地西泮内标储备液的配制:精密称取地西泮对照品10 mg,置于100 mL量瓶中,适量甲醇超声溶解,用甲醇定容至刻度,摇匀,即得质量浓度为100 μg·mL-1的地西泮对照品储备液(1)。精密吸取上述对照品储备液(1)1 mL,置于100 mL量瓶中,甲醇定容至刻度,摇匀,即得质量浓度为1 μg·mL-1的地西泮对照品储备液(2),于4 ℃避光保存,备用。
2.4体内药动学研究
2.4.1色谱和质谱条件 色谱柱:Symmetry C18柱(50 mm ×2.1 mm,5 μm);流动相:3 mL·L-1甲酸-甲醇(38.5∶61.5);流速:0.3 mL·min-1;柱温:30 ℃;进样量:5 μL。
质谱条件:电喷雾离子源(ESI),正离子模式,多反应MRM监测,质谱参数为:硝苯地平:[M+H]+347.3(m/z)→315.2(m/z),DP:46 V,FP:293 V,EP:8 V,CE:14 eV,CXP:15 V;地西泮:[M+H]+285.0(m/z)→193.2(m/z),DP:82 V,FP:295 V,EP:8 V,CXP:8 V,CE:48 eV。离子源参数:Nebulizer Gas:13 Psi;Collision Gas:4 Psi;Curtain Gas:8 Psi;Gas 2:7 000 Psi;Temperature:500 ℃;Ion Spray Voltage:5 000 V。
2.4.2专属性 分别取6份不同来源的空白血浆、空白血浆+药物(10 ng·mL-1)和1号犬给药后2 h血样,按照2.2项下方法处理后进样分析,记录色谱图。见图1。由图1可知,在该测定条件下,硝苯地平和地西泮的保留时间分别为1.6和2.6 min,血浆内源性物质不干扰两者的测定。
2.4.3标准曲线的绘制 取硝苯地平对照品储备液(2),用甲醇稀释为质量浓度为1 000,500,250,100,50,25和10 ng·mL-1的标准工作溶液。分别吸取上述溶液50 μL,精密加入空白血浆450 μL,涡旋1 min,依次配制药物质量浓度为100,50,25,10,5,2.5和1 ng·mL-1的硝苯地平标准血样。按照2.2项下方法处理后进样分析,记录色谱图,以硝苯地平和地西泮的峰面积比值为纵坐标y、血浆中硝苯地平质量浓度为横坐标x进行线性回归,得线性方程:y=2.43×10-2x+1.76×10-3,r=0.999 7,权重系数为1/C2。结果表明,硝苯地平在血浆样品中质量浓度为1~100 ng·mL-1范围内线性关系良好。该条件下血浆中硝苯地平的最低检测限为1 ng·mL-1。

图1LC-MS/MS法测定Beagle犬血浆中硝苯地平色谱图
A.空白血浆;B.空白血浆+药物(tR=1.6 min,10 ng·mL-1)+内标(tR=2.6 min,1 μg·mL-1);C.1号犬第1周期给药后2 h血样+内标(tR=2.6 min,1 μg·mL-1);1.硝苯地平;2.地西泮。
Fig.1 LC-MS/MS chromatograms of nifedipine in Beagle dogs plasma
A.blank plasma;B.blank plasma sample+nifedipine(tR=1.6 min,10 ng·mL-1)+internal standard(tR=2.6 min,1 μg·mL-1);C.plasma sample of 2 h from No.1 Beagle dog after given drugs for the first period+internal standard(tR=2.6 min,1 μg·mL-1);1.nifedipine;2.diazepam.
2.4.4绝对回收率 用空白血浆配制含硝苯地平高、中和低质量浓度(80,25和2.5 ng·mL-1)的标准血浆样品各5份,按照2.2项下方法处理后进样分析。另取甲醇配制硝苯地平高、中和低质量浓度(80,25和2.5 ng·mL-1)各5份,同上操作,进样并分析,由二者峰面积比值计算绝对回收率。结果发现,血浆中高、中和低质量浓度的绝对回收率分别为97.7%,108.0%和92.7%。
2.4.5基质效应 取空白血浆50 μL,加入200 μL流动相,涡旋、离心,取上清液备用。另取高、中和低(80,25和2.5 ng·mL-1)3个质量浓度的硝苯地平甲醇溶液各50 μL,分别平行配制5份。加入质量浓度为1 μg·mL-1的内标溶液50 μL,加入上述上清液150 μL,涡旋,取上清液,进样分析。另取高,中和低(80,25和2.5 ng·mL-1)3个质量浓度的硝苯地平甲醇溶液各50 μL,分别平行配制5份。加入质量浓度为1 μg·mL-1的地西泮溶液50 μL,加入流动相150 μL,涡旋混匀,取上清液,进样分析,由二者峰面积比值计算基质效应。结果发现,高、中和低质量浓度硝苯地平血浆样品的基质效应在87.0%~96.6%之间,满足生物样品测定方法学的要求。
2.4.6精密度和准确度 用空白血浆配制含硝苯地平高、中和低质量浓度(80,25和2.5 ng·mL-1)的标准血浆样品各5份,按照2.2项下方法处理后进样分析,连续测定3 d,计算不同质量浓度的日内、日间精密度和准确度。结果表明,高、中和低质量浓度硝苯地平血浆样品的日内、日间的精密度均不超过9.9%,准确度为87.5%~97.8%,满足生物样品测定方法学的要求。
2.4.7稳定性 用空白血浆配制含硝苯地平高、中和低质量浓度(80,25和2.5 ng·mL-1)的标准血浆样品各5份,分别考察血浆样品在室温、反复冻融、长期冻存(-20 ℃)以及处理液室温条件下的稳定性。结果表明,血浆中硝苯地平在考察条件下均稳定。
2.5药-时曲线及药动学参数研究 6只Beagle犬单剂量灌服20 mg硝苯地平缓释微丸与Coracen®后,绘制得到的血药质量浓度-时间曲线见图2,采用DAS 3.0药动学软件处理血药质量浓度数据,以非房室模型法计算曲线下面积AUC,根据药-时曲线末端4个点进行线性回归,求得消除速率常数Ke。药动学参数及相对生物利用度(F)见表1。
2.6体内外相关性评价 对硝苯地平缓释微丸的血药质量浓度数据进行室模型拟合,权重系数为1/C2,以AIC法和拟合优度R2法判别隔室模型。结果表明,硝苯地平缓释微丸的体内吸收过程符合单室模型,与文献报道一致[9-11],见表2。

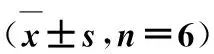
表1Beagle犬口服硝苯地平缓释微丸和Coracen®后的药动学参数
Tab.1 The main pharmacokinetic parameters of nifedipine in Beagle dogs after orally administrated Nifedipine Sustained-release Pellets and Coracen®

参数Coracen 硝苯地平缓释微丸Cmax/ng·mL-128.72±4.8827.11±2.87Ke/h-10.23±0.020.21±0.02t1/2/h4.67±1.025.03±1.16tmax/h3.67±0.523.83±0.41MRT0-t/h5.97±0.416.72±0.29AUC0~t/ng·h·mL-1155.41±23.11164.99±20.32AUC0~∞/ng·h·mL-1164.43±23.41170.81±19.99F/%-103.9
表2硝苯地平缓释微丸药动学模型判断
Tab.2 Pharmacokinetic model judgement of Nifedipine Sustained-release Pellets in Beagle dogs
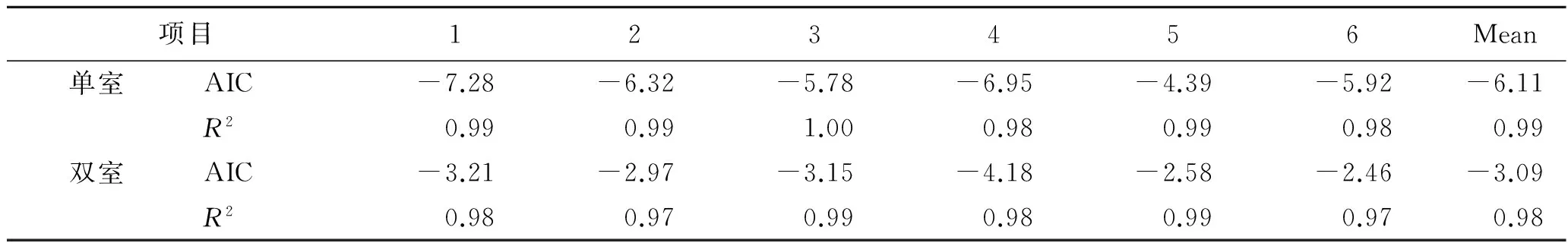
项目123456Mean单室AIC-7.28-6.32-5.78-6.95-4.39-5.92-6.11R20.990.991.000.980.990.980.99双室AIC-3.21-2.97-3.15-4.18-2.58-2.46-3.09R20.980.970.990.980.990.970.98
采用Wagner-Nelson法计算硝苯地平缓释微丸的吸收分数Fa(%)[12]。对不同时间点体内吸收分数Fa(%)与在释放介质为0.02 mol·L-1十二烷硫酸钠溶液、转速为100 r·min-1、温度为37±0.5 ℃条件时,相同时间体外累积释放分数Fr(%)进行线性回归,得线性方程Fa=1.259Fr+2.26(R=0.99,P<0.01),表明硝苯地平缓释微丸体内外相关性良好,见表3。
表3硝苯地平缓释微丸的体内外相关性
Tab.3 Theinvivoandinvitrocorrelation of Nifedipine Sustained-release Pellets

t/hCtKeCt+Ke×AUC0~tKe×AUC0~∞Fa/%Fr/%0------13.740.214.0535.8711.719.8329.400.2110.1735.8728.3420.57422.300.2124.6735.8768.7845.92613.880.2132.1335.8789.5766.2788.690.2135.8235.8799.8683.50
2.7生物等效性分析 利用SPSS 19.0对主要药动学参数经对数转换后进行统计分析,分别采用方差分析、双单侧t检验及(1-2α)置信区间法对硝苯地平缓释微丸和Coracen®进行生物等效性判定。
2.7.1方差分析法 对硝苯地平缓释微丸和Coracen®的AUC0~24 h和Cmax进行对数转换后,进行方差分析。结果显示,lnAUC0~24 h在制剂间、组间和个体间的方差分别为1.203,0.865和27.159;lnCmax在制剂间、组间和个体间的方差分别为0.634,1.216和12.297,经统计分析表明,lnAUC0~24 h、lnCmax的制剂间、周期间差异均无统计学意义(P>0.05),lnCmax的个体间差异无统计学意义(P>0.05),lnAUC0~24 h在个体间差异有统计学意义(P<0.05)。
2.7.2双单侧t检验和(1-2α)置信区间考察 采用双单侧t检验和(1-2α)置信区间法考察硝苯地平缓释微丸和Coracen®的主要药动学参数(lnAUC0~24 h、lnCmax)的差异是否在允许范围内,结果显示,硝苯地平缓释微丸的lnAUC0~24 h的t1和t2分别为2.732和2.463;lnCmax的t1和t2分别为2.609和2.454,两参数均大于临界值t0.95(4)=2.132,90%CI分别为(88.3~121.6)%和(79.6~133.5)%,结果表明,硝苯地平缓释微丸与Coracen®生物等效。
3 讨论
3.1体内分析方法的建立 文献报道[13],单剂量口服硝苯地平控释片(30 mg)后,Cmax仅为27.5±15.9 ng·mL-1,血药质量浓度极低,硝苯地平体内分析方法较多[14-19],最早使用的荧光法对血浆中硝苯地平质量浓度进行监测时[16],利用硝苯地平分子结构中二氢吡啶母环在氧化成吡啶环后产生荧光特征进行测定,操作较繁琐、费时,样品需事先经氧化处理,且该方法灵敏度低,不符合药物质量浓度测定的要求。其次,硝苯地平化学结构中的二氢吡啶母环在高温下不稳定,应用GC法分析时需程序升温[17],对实验结果带来一定影响。HPLC法[18]能够满足硝苯地平血样的测定要求,但样品分析时间较长,不利于大批量样品的测定。
本研究采用LC-MS/MS法测定Beagle犬血浆中硝苯地平的质量浓度,以地西泮为内标,与其他分析方法相比,灵敏度大大提高(LLOQ为1 ng·mL-1)的同时,分析准确、快速,药物和内标的保留时间仅为1.6和2.6 min,提高了分析效率,适用于大批量血样的测定。
3.2体内外相关性 胃肠道环境相对于体外释放度条件更为复杂[20],缓控释制剂释药性质的评价最终应以体内吸收情况为标准。考察药物体内外相关性,可以在体外预测药物在体内的释放情况从而使体外评价更加科学合理,达到简化制剂体内评价过程的目的。
硝苯地平缓释微丸在体内吸收过程符合单室模型,可采用Wagner-Nelson法计算其体内吸收分数,基于体外累积释放分数可考察二者的相关性,结果表明,微丸体内外相关性良好,证实可通过体外释放度实验来表征药物在体内的吸收过程。由于硝苯地平缓释微丸与Coracen®犬体内生物等效,因此以其建立IVIVC模型而制定的体外释放标准更为科学和合理。
3.3生物等效性 药动学研究中,硝苯地平缓释微丸与上市产品Coracen®的主要药动学参数无显著性差异,经双单侧t检验和90%CI法分析表明,两制剂生物等效,提示以Eudragit®RL/RS为包衣膜材制备的硝苯地平缓释微丸表现出良好的缓释特性,与上市产品Coracen®具有相似的体内行为,进而为硝苯地平新型制剂的开发提供参考。
[1] Poole-Wilson P A,Lubsen J,Kirwan B A,et al.Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial):randomised controlled trial[J].Lancet,2004,364(9437):849-857.
[2] Vincent M,Joerg O,Nicoletta L,et al.Oral osmotically driven systems:30 years of development and clinical use[J].Eur J Pharm Biopharm,2009,73(3):311-323.
[3] Vaněĉková I,Dobešová Z,KuneJ,et al.Endothelin A receptor blocker atrasentan lowers blood pressure by the reduction of nifedipine-sentive calcium influx in Ren-2 trangenic rats fed a high-salt diet[J].J Hypertens,2015,33(1):161-169.
[4] Zimmer J,Hawlitschek C,Rabald S,et al.Effects of late-onset and long-term captopril and nifedine treatment in aged spontaneously hypertensive rats:Echocardiographic studies[J].Hypertens Res,2015,38(11):1-7.
[5] Witkowska M,Tracz W,Kubler G,et al.Comparative study to assess the efficacy and adverse effects of amlodipine and nifedipine retard in patients with stable exertional angina and hypertensio[J].Przeglad lekarski,1997,54(5):324-328.
[6] Sawada T,Kondo H,Nakashima H,et al.Time-release compression-coated core tablet containing nifedipine for chronopharmacotherapy[J].Int J Pharm,2004,280(1):103-111.
[7] 李凤云,赵立军.硝苯地平控释片与硝苯地平缓释片对血压波动性的影响[J].实用预防医学,2009,16(4):1283-1284.
[8] 张跃飞,潘忠平,肖正林,等.星点设计-效应面法优化硝苯地平缓释微丸的包衣处方[J].中南药学,2015,13(5):469-472.
[9] Thelen K,Jantratid E,Dressman J B,et al.Analysis of nifedipine absorption from soft gelatin capsules using PBPK modeling and biorelevant dissolution testing[J].J Pharm Sci,2010,99(6):2899-2904.
[10]张杰,左飞,柯清华,等.硝苯地平控释胶囊在Beagle犬体内的药动学研究[J].中南药学,2014,12(9):873-875.
[11]马萍,祝力,孙淑英,等.硝苯地平缓释微丸家犬体内药动学和生物利用度[J].广东药学院学报,2004,20(1):32-34.
[12]张继稳,李川.正确使用Wagner-Nelson法评价缓、控释制剂吸收度[J].中国药学杂志,2007,42(3):236-238.
[13]Minami J,Numabe A,Andoh N,et al.Comparison of once-daily nifedipine controlled-release with twice-daily nifedipine retard in the treatment of essential hypertension[J].Br J Clin Pharm,2004,57(5):632-639.
[14]Suzuki H,Fujiwara S,Kondo S,et al.Determination of nifedipine in human plasma by high-performance liquid chromatography with electrochemical detection[J].J Chromatogr B,1985,(341):341-347.
[15]Wang X D,Li J L,Lu Y,et al.Rapid and simultaneous determination of nifedipine and dehydronifedipine in human plasma by liquid chromatography-tandem mass spectrometry:application to a clinical herb-drug interaction study[J].J Chromatogr B,2007,852(1):534-544.
[16]Schlossmann K.Fluorometric determination of 4-(2′-nitrophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylic acid dimethyl ester and its main metabolite[J].Arzneimittel-Forsch,1972,22(1):60-62.
[17]Dankers J,van den Elshout J,Ahr G,et al.Determination of nifedipine in human plasma by flow-injection tandem mass spectrometry[J].J Chromatogr B,1998,710(1):115-120.
[18]Zendelovska D,Simeska S,Sibinovska O,et al.Development of an HPLC method for the determination of nifedipine in human plasma by solid-phase extraction[J].J Chromatogr B,2006,839(1):85-88.
[19]张静,隋强军,王晨.黄芩苷对大鼠体内硝苯地平的药动学的影响[J].现代药物与临床,2015,30(10):1198-1203.
[20]黄显会.内服给药制剂剂型设计与应用[J].北方牧业,2015,38(9):18-20.
