阿昔洛韦微乳的制备及其理化性质的测定
2018-01-12殷旭东孔云虹杨晓虹
殷旭东,程 威,孔云虹,杨晓虹
(昆明学院生命科学与技术系,昆明 650214)
微乳制剂作为一种新剂型在医药领域已取得广泛应用[1-3]。微乳载药可提高药物以及其他营养物质的稳定性[4-7],控制药物释放,延长药物的血液循环时间,促进药物吸收[8-10]。研究表明,微乳制剂可提高在水中难溶解药物的溶解量,提高生物利用度[11-13]。
阿昔洛韦(acyclovir,ACV)为合成的嘌呤核苷类似物,相对分子质量为225.21,可干扰单纯疱疹病毒DNA多聚酶,抑制单纯疱疹病毒的复制[14]。由于阿昔洛韦难溶于水,口服吸收差,研究人员采用将其制成纳米颗粒或聚合物胶束等方法,以提高阿昔洛韦的生物利用度[15-16]。为了克服阿昔洛韦在临床应用的缺点,本文制备了阿昔洛韦微乳制剂,测定了阿昔洛韦微乳制剂的主要理化指标。
1 仪器与材料
1.1仪器 DDS-11D电导率仪(上海虹益仪器仪表有限公司);79-1A恒温加热磁力搅拌器(苏珀仪器有限公司);FA1004电子天平(上海恒平科学仪器有限公司);PHS-3C pH计(上海仪电科学仪器股份有限公司);Nano-ZS 型马尔文粒径测定仪(英国马尔文公司);Tecnai-12 型透射电子显微镜(荷兰Philips 公司)。
1.2材料 阿昔洛韦(江苏常州康丽制药有限公司,批号20160813);蓖麻油聚氧乙烯醚(EL-60,山东济宁铭达新材料有限公司,批号20150721);油酸钠、吐温-80(辽宁美仑生物技术有限公司,批号:20160308,20160426);其他试剂均为市售分析纯。
2 方法
2.1三元相图的绘制 将油酸与复合表面活性剂(油酸钠、吐温-80和EI-60)按照1∶8,2∶7,3∶6,4∶5,4.5∶4.5,5∶4,6∶3,7∶2和8∶1的质量比,分别称取,置于50 mL烧杯中,总质量固定为2.5 g。在室温条件下,磁力搅拌均匀后,逐滴加入去离子水,记录体系由透明变浑浊或由浑浊变透明,即发生相变时加入水的质量。以复合表面活性剂作为三元相图的一个顶点,油和水分别为三元相图的另外2个顶点,分别以O和W表示。在相图上标示出相变点的位置,连接各相变点,绘制三元相图。
2.2微乳电导率的测定 在50 mL的烧杯中加入油酸钠1.0 g,滴入1.5 mL去离子水,在磁力搅拌下溶解,再分别加入吐温-80、EI-60和油酸2.0,1.72和0.3 g,在磁力搅拌下混匀,加入1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,12.0,14.0,16.0,18.0和20.0 mL去离子水,测定空白微乳电导率。
2.3空白微乳制剂的制备 室温下,在50 mL烧杯中加入油酸钠0.5 g,再加入吐温-80和EI-60 1.0和0.8 g,滴入1.0 mL去离子水,在磁力搅拌下溶解;再加入油酸0.3 g,在磁力搅拌下,滴入5.0 mL去离子水,持续搅拌25 min。
2.4阿昔洛韦微乳制剂的制备 室温下,在磁力搅拌下,将丙三醇0.5 g加入到2.3项下制备的空白微乳制剂中,搅拌10 min。再将阿昔洛韦0.1 g加入微乳体系中,持续搅拌20 min。
2.5空白微乳和阿昔洛韦微乳制剂粒子的表征 空白微乳和阿昔洛韦微乳制剂粒子的粒径、电位、粒径分散指数用激光散射仪测定;微乳pH值用PHS-3C pH计测量。重复测量3次,取平均值。
2.6阿昔洛韦微乳制剂微观形态学观察 将载有 Formvar 支持膜的铜网置于蜡板上,在膜上滴加2.4项下制备的阿昔洛韦微乳制剂1滴,自然晾干30 min,再滴加质量浓度为20 g·L-1的磷钨酸1滴,自然晾干10 min,用滤纸吸走多余的液体,置于Tecnai-12型透射电子显微镜下观察微乳的形态。
3 结果与讨论
3.1油酸/(油酸钠,吐温-80,EL-60)/水的相行为 以EI-60、吐温-80和油酸钠和油酸(O)和水(W)分别为拟三元相图的3个顶点绘制拟三元相图,见图1。
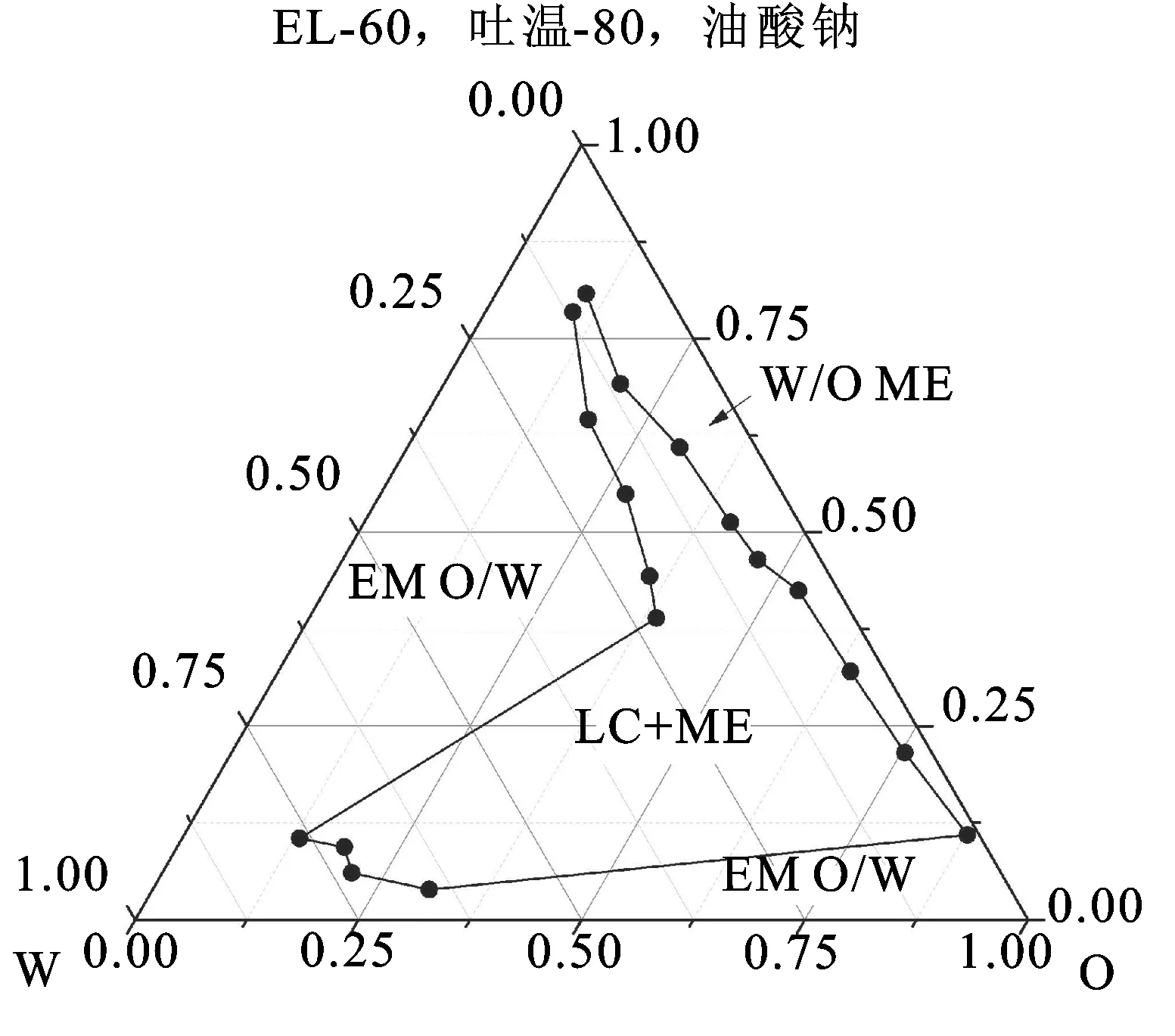
图1体系油酸/(EL-60,吐温-80,油酸钠)/水的三元相图(25℃)
Fig.1 System oleic acid/(EL-60,Tween-80,sodium oleate)/water ternary phase diagram(25 ℃)
图1中的W/O ME表示W/O型单相微乳液;O/W ME表示O/W 型单相微乳液;EM 表示乳状液;LC 表示液晶;LC+ME 表示液晶与微乳液共存;EM O/W表示水包油乳状液;EM W/O表示油包水乳状液。结果显示,在水或者油酸的的含量增加、表面活性剂较少时,形成区域较大的油包水或者水包油乳状液区。
3.2空白微乳电导率的测定 微乳电导率随含水量的变化见图2。电导率值最高点为微乳成型的临界点[17]。在水含量为33.3%时,电导率为4.2 ms·cm-1,为乳白色黏稠液体。随含水量增加,液体逐渐透明,流动性增强,黏度减小,形成微乳区。在水的含量增加到70.0%时,阴离子表面活性剂水解使导电离子浓度增大,微乳液的电导率增加到最高值为10.6 ms·cm-1。此时,水包油达到极限。随后继续增加水的含量,微乳转变成乳液发生相分离,微乳的电导率值减小,当水含量达到76.5 %时,体系的电导率为9.7 ms·cm-1。
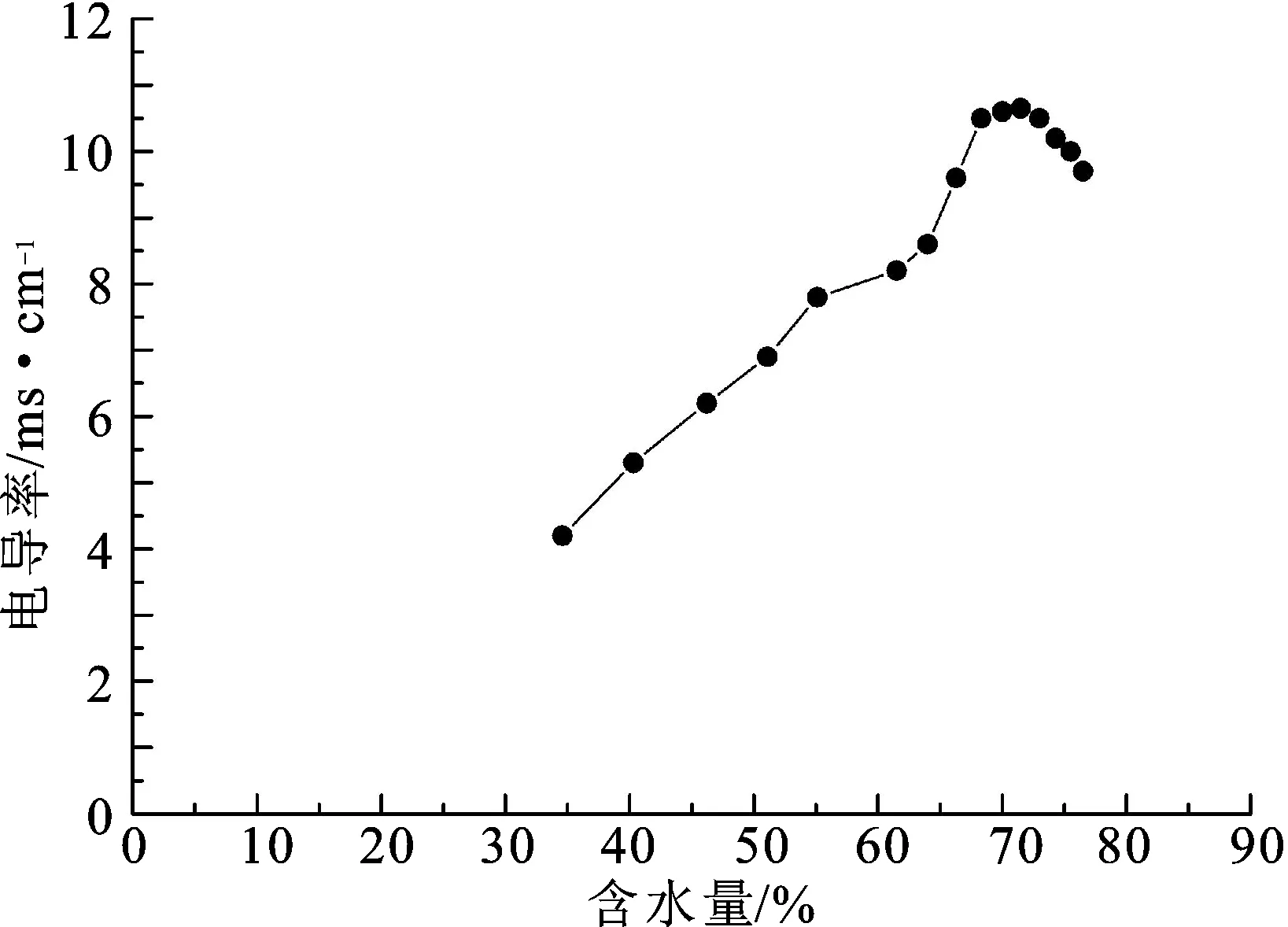
图2m(油酸):m(油酸钠、吐温、EL-60)=1∶8时电导率值随含水量变化的曲线(25℃)
Fig.2 The curve conductivity value with the water content changes whenm(oleic acid):m(sodium oleate,Tween,EL-60)=1∶8 (25 ℃)
3.3阿昔洛韦微乳制剂的制备 在阿昔洛韦微乳制剂中所用的复合表面活性中油酸钠为阴离子表面活性剂,吐温-80和EL-60为非离子表面活性剂。阿昔洛韦微乳形成模式见图3。空白微乳的含水量为70%,油酸分子因具有亲油基团在整个微乳体系的中间,在阴离子表面活性剂油酸钠形成的胶束内。非离子表面活性剂吐温-80和EL-60在最外层,亲油基团在内部,其亲水基团在外部与水分子作用吸附。当阿昔洛韦加入空白微乳液后,阿昔洛韦逐渐进入胶束内部,阿昔洛韦分子被阴离子表面活性剂(油酸钠)和非离子表面活性剂吐温-80和EL-60亲油基团吸附。
3.4空白微乳和阿昔洛韦微乳制剂的测定 阿昔洛韦微乳(A)和空白微乳(B)制剂见图4。二者均为淡黄色透明液体,阿昔洛韦微乳颜色较深一些。
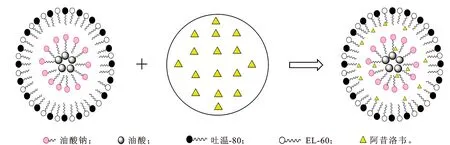
图3阿昔洛韦微乳的形成模式
Fig.3 The formation of acyclovir microemulsion

图4阿昔洛韦微乳(A)和空白微乳(B)
Fig.4 The acyclovir microemulsion (A) and blank microemulsion (B)
阿昔洛韦微乳(A)和空白微乳(B)制剂的理化参数见表1。微乳的粒子直径和表面电荷与微乳的稳定性以及药物的吸收有关[18-20]。用马尔文激光散射粒度测定仪,在 20 ℃下,光散射度为90 °测定空白微乳和阿昔洛韦微乳的粒径。空白微乳和阿昔洛韦微乳制剂的平均粒径分别为37.37和40.28 nm,粒径分散指数分别为0.19和0.21,电位分别为-16.71 mV和-15.82 mV。空白微乳和阿昔洛韦微乳pH值分别6.71和6.82。结果显示,空白微乳和阿昔洛韦微乳制剂的粒子直径较小,粒度范围小,较为稳定。
表1阿昔洛韦微乳(A)和空白微乳(B)的理化参数
Tab.1 Physical and chemical parameters of acyclovir microemulsion (A) and blank microemulsion (B)
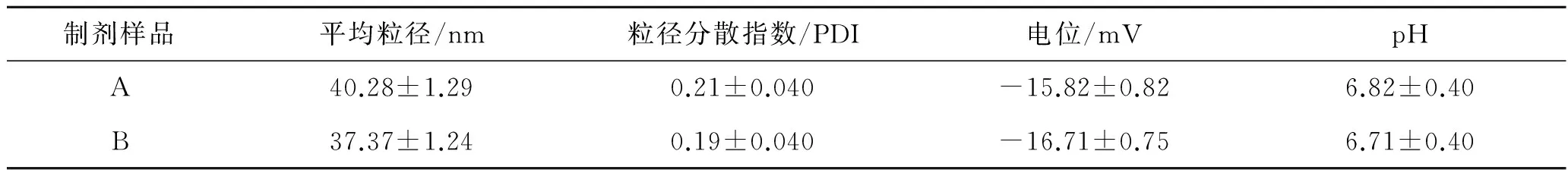
制剂样品平均粒径/nm粒径分散指数/PDI电位/mVpHA40.28±1.290.21±0.040-15.82±0.826.82±0.40B37.37±1.240.19±0.040-16.71±0.756.71±0.40
3.5阿昔洛韦微乳制剂的形态观察 阿昔洛韦微乳制剂的透射电镜图见图5。由图5可知,阿昔洛韦微乳粒子的直径为30~50 nm。阿昔洛韦微乳粒子成圆球形状。

图5阿昔洛韦微乳电镜图片
Fig.5 TEM photograph of acyclovir microemulsion
4 结论
在室温下,以油酸为油相,通过复合表面活性剂油酸钠(阴离子)、吐温-80(非离子)和EL-60(非离子),以甘油为助剂制备了阿昔洛韦微乳制剂,粒子平均直径为40.28 nm,粒度范围小,较为稳定。阿昔洛韦微乳制剂pH值为6.82,接近中性,有利于对其展开进一步研究。
[1] 王传邦,刘亭亭,牟丽秋,等.新型微乳载药系统的研究进展和应用前景[J].中国药业,2016,25(1):5-10.
[2] 刘洁,何军,张兵,等.注射用微乳的研究进展[J].中国医药工业杂志,2011,42(4):300-307.
[3] 章辉,肖小年,李莉,等.肉桂油纳米微乳的制备[J].天然产物研究与开发,2014,(26):1321-1326.
[4] Spernath A,Aserin A.Microemulsions as carriers for drugs and nutraceuticals[J].Adv Colloid Interface Sci,2006,(128-130):47-64.
[5] 吴红艳,孙长豹,刘宁,等.月见草油微乳体系的微观结构研究[J].东北农业大学学报,2014,45(5):44-51.
[6] 杨光,谢向阳,宋艳玲.白藜芦醇微乳的制备及表征[J].中国药师,2015,18(3):444-449.
[7] 刘洁,杨亚妮,何军,等.前列地尔微乳处方及制备工艺的优化[J].中国医药工业杂志,2015,46(6):586-591.
[8] 康荣荣,杨苏芳,韩萌,等.微乳在经皮给药系统中的应用[J].中南药学,2014,12(3):253-257.
[9] 李磊,王长远,蔡芸,等.羟丝肽口服微乳的制备与体内药动学研究[J].医药导报,2014,33(2):135-139.
[10]张倩,吴红.色胺酮纳米胶束的制备及其性质研究[J].西北药学杂志,2016,31(3):277-281.
[11]马茜,范娟.壳聚糖纳米粒载体的应用研究进展[J].西北药学杂志,2015,30(2):213-215.
[12]刘璇,张振海,陈彦,等.秋水仙碱微乳的制备及体外经皮渗透研究[J].中草药,2011,42(10):1963-1967.
[13]许日鑫,石添香,廖娴,等.β-细辛醚微乳的制备及其性质考察[J].中草药,2013,44(1):31-35.
[14]Parang Mehta.Acyclovir[J].Pediatri Infect Dis,2013,5(4):178-180.
[15]Jin Y,Tong L,Ai P,et al.Self-assembled drug delivery systems 1.Properties andinvitro/invivobehavior of acyclovir self-assembled nanoparticles (SAN)[J].Int J Pharm,2006,309(1/2):199-207.
[16]Sawdon A J,Peng C A.Polymeric micelles for acyclovir drug delivery[J].Colloids Surf B Biointerfaces,2014,(122):738-745.
[17]Xu Z,Jin J,Zheng Y,et al.Co-surfactant free microemulsions:preparation,characterization and stability evaluation for food application[J].Food Chem,2016,(204):194-200.
[18]Narang A S,Delmarre D,Gao D.Stable drug encapsulation in micelles and microemulsions[J].Int J Pharm,2007,345(1/2):9-25.
[19]Chamieh J,Davanier F,Jannin V,et al.Size characterization of commercial micelles and microemulsions by Taylor dispersion analysis[J].Int J Pharm,2015,492(1/2):46-54.
[20]Rao J,Mc C,David J.Food-grade microemulsions and nanoemulsions:role of oil phase composition on formation and stability[J].Food Hydrocolloi,2012,29(2):326-334.
