墨兰绿墨素与大花蕙兰世界和平杂交种组培快繁技术
2018-01-12王玉英张宇欢陈淑英李枝林
宋 莲, 王玉英, 张宇欢, 陈淑英, 李枝林,2
(1.云南农业大学园林园艺学院花卉研究所,云南昆明 650201; 2.生物多样性与云南特色农业协同创新中心,云南昆明 650201)
墨兰(Cymbidiumsinense)别称报岁兰、入岁兰,分布于中国福建、台湾、广东、广西、云南、贵州、四川等省(区),花期为9月至次年3月,根长而粗壮,假鳞茎椭圆形,叶片剑形,花茎直立,高出叶面,花香浓郁,抗性强[1]。大花蕙兰(C.hybridium)别称西姆比兰、东亚兰,花期10月至次年4月,是兰属中一些热带附生种的杂种,株型高大,花大色艳,花期长、无香味,适应性强,既可盆栽,又可作切花。杂交育种是兰花育种最传统、最有效的方法,通过墨兰×大花蕙兰杂交获得F1代植株,可有望选育出具有国兰“香”、洋兰“艳”的兰花新品系。但是,兰花种子相对较小,内含发育不完全球形胚,在自然条件下很难萌发,而采用离体胚培养[2]可解决这一难题。
目前,在墨兰、大花蕙兰、线艺兰、野生碧玉兰、墨兰金华山×春兰宋梅、春兰紫萼×大花蕙兰日本绿等兰属植物上有相关组培技术的报道[3-8],但对墨兰绿墨素与大花蕙兰世界和平的F1后代组织培养技术研究尚未见报道。因此,本研究以墨兰绿墨素与大花蕙兰世界和平杂交种原球茎为试验材料,探索其增殖分化、不定芽增殖、生根的最佳培养基配方,以期为其新种质的创制和规模化生产提供理论依据。
1 材料与方法
1.1 材料
墨兰绿墨素(♀)与大花蕙兰世界和平(♂)杂交种原球茎,由云南农业大学花卉研究所自主培育。试验试剂均为市购。
1.2 方法
1.2.1 原球茎的增殖分化 选取大小相同、嫩绿且长势良好的杂交种原球茎,剔除培养基、幼根和芽,接种于以1/2MS培养基为基本培养基,添加不同浓度及配比的6-苄氨基腺嘌呤(6-BA)、萘乙酸(NAA)(表1)及琼脂6.5 g/L、蔗糖 30 g/L、香蕉80 g/L、活性炭0.5 g/L,pH值为5.8的培养基上进行增殖培养,培养条件为温度(23±2)℃,光照度 1 800~2 500 lx。每处理45个原球茎,重复3次。培养45、60 d后分别统计增殖率、出芽数。
1.2.2 不定芽的增殖 选取生长健壮、长势一致的不定芽,接种于以1/2MS培养基为基本培养基,添加不同激素配比(表2)及琼脂6.5 g/L、蔗糖30 g/L、香蕉80 g/L、活性炭 0.5 g/L,pH值为5.8的培养基上进行增殖培养,培养条件为温度(23±2)℃,光照度 1 800~2 500 lx。每处理40个不定芽,重复3次。培养60 d后统计不定芽的增殖率。
1.2.3 生根培养 将株高为3~5 cm的无根苗接种于以 1/2MS 培养基为基本培养基的不同生根培养基(表3、表4)中进行培养,培养条件为温度(23±2)℃,光照度1 800~2 500 lx。每瓶5株,每处理10瓶,重复3次。接种45 d后观察生根情况。
1.3 数据统计分析
采用Excel 2003软件对数据进行整理,采用SPSS 20.0软件进行方差分析,采用最小显著性差异法(LSD法)对试验数据进行多重比较。
2 结果与分析
2.1 不同培养基对杂交兰原球茎增殖分化的影响
由表1可见,含不同激素的培养基对墨兰、大花蕙兰杂交种原球茎增殖分化效果差异明显;含6-BA 1.0 mg/L+NAA 1.0 mg/L的培养基对杂交兰原球茎的增殖相对最好,增殖率为317.77%,显著高于其他培养基(P<0.05),说明杂交兰原球茎增殖的最佳配方为1/2MS+6-BA 1.0 mg/L+NAA 1.0 mg/L+蔗糖3%+琼脂6.5 g/L+香蕉80 g/L+活性炭0.5 g/L;接种后60 d,部分原球茎分化出幼芽,含6-BA 0.5 mg/L+NAA 0.3 mg/L的培养基原球茎出芽率相对最高,为54.96%,显著高于其他培养基处理(P<0.05),说明原球茎分化效果最优的培养基为1/2MS+6-BA 0.5 mg/L+NAA 0.3 mg/L+蔗糖3%+琼脂6.5 g/L+香蕉80 g/L+活性炭0.5 g/L。
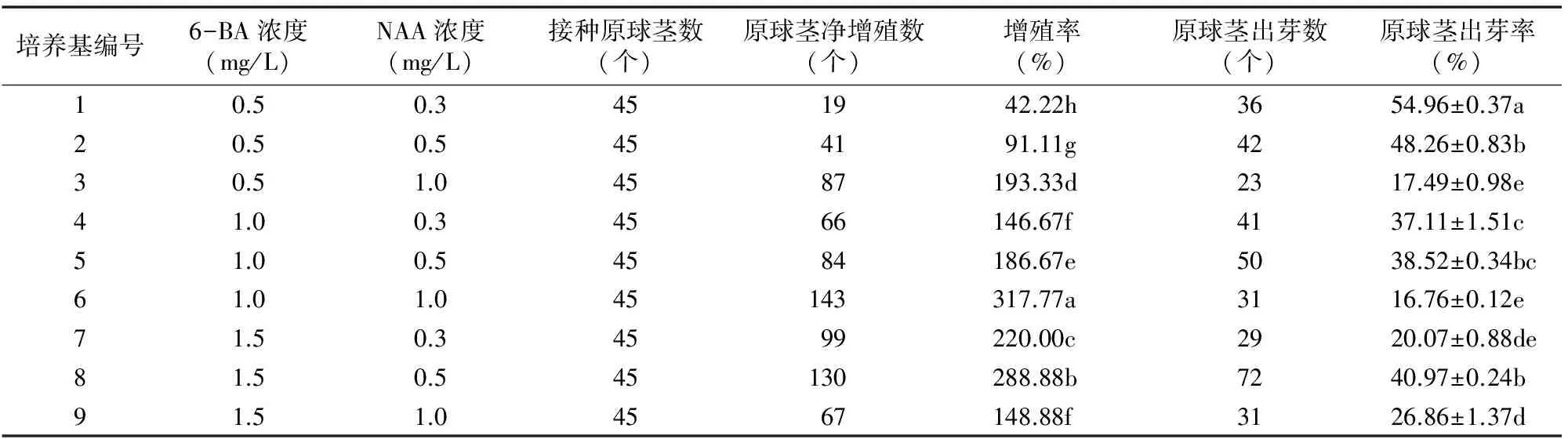
表1 不同培养基对墨兰×大花蕙兰原球茎增殖分化的影响
注:同列数据后不同小写字母表示差异显著(P<0.05)。下同。
2.2 不同6-BA浓度对杂交兰不定芽增殖的影响
由表2可知,当NAA浓度为0.3 mg/L时,含不同浓度 6-BA 的培养基对墨兰、大花蕙兰杂交种不定芽的增殖有明显差异,含6-BA 2.0 mg/L的培养基增殖率相对最高,为227.5%,显著高于其他培养基处理(P<0.05);6种培养基配方中,6-BA浓度在0.5~2.0 mg/L时,随6-BA浓度的增加,不定芽增殖率升高,当6-BA浓度大于2.0 mg/L时,不定芽的增殖受到抑制;1/2MS+6-BA 2.0 mg/L+NAA 0.3 mg/L+蔗糖30 g/L+琼脂6.5 g/L+香蕉80 g/L+活性炭0.5 g/L为杂交兰不定芽增殖的最佳配方。

表2 不同6-BA浓度对杂交兰不定芽增殖的影响
2.3 不同培养基对杂交兰生根的影响
2.3.1 不同NAA浓度对杂交兰生根的影响 由表3可见,5组培养基配方均能诱导墨兰绿墨素、大花蕙兰世界和平杂交组培苗的生根,且NAA对生根率的影响差异明显;含NAA 0.5 mg/L 的培养基杂交兰生根率相对最高,为81%,分别比含NAA 1.0、1.5、2.5 mg/L培养基培养的显著高30.65%、24.62%、32.79%(P<0.05),且根数多而粗,植株生长健壮。
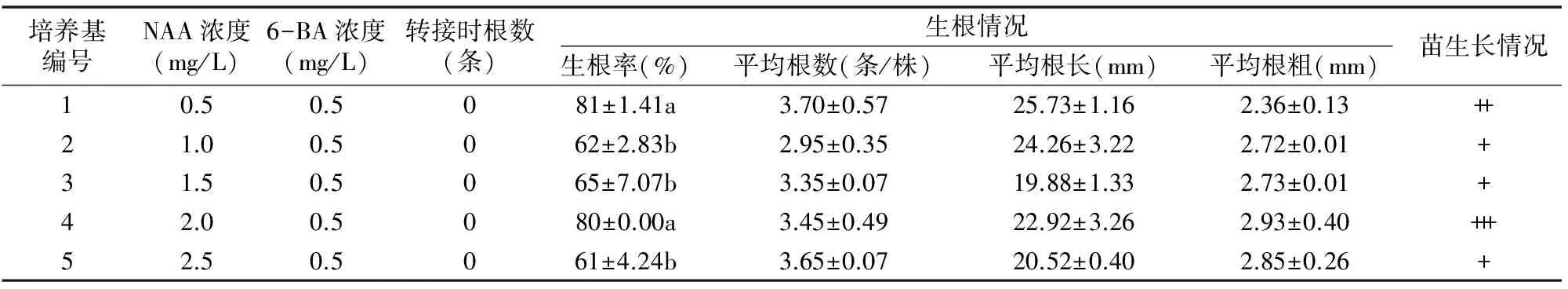
表3 不同NAA浓度对杂交兰生根的影响
注:-代表不生长;+代表长势一般;++代表长势良好;+++代表长势健壮。下同。
2.3.2 不同活性炭用量对杂交兰生根的影响 由表4可知,活性炭对杂交兰生根的影响差异显著(P<0.05);活性炭用量为1.0 g/L时的生根率相对最高,为81%,且苗生根情况和生长情况最佳,分别比活性炭用量为0.5、0 g/L的高 24.62%、47.27%。因此,生根效果相对最好的培养基为 1/2MS+6-BA 0.5 mg/L+NAA 2.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L+香蕉80 g/L+活性炭1.0 g/L。
3 结论与讨论
在兰花组织培养中,最常用的培养基为MS、VW、KC、H、RM、White及其改良型,应用时可根据不同品种和类原球茎的形成、增殖、分化及壮苗等不同培养阶段加以修改[9]。低盐培养基有利于兰花的生长,朱根发等认为,1/2MS培养基有利于大花蕙兰的快速繁殖[10];丁雪珍等认为,最适于墨兰根状茎增殖的基本培养基为1/2MS[11];罗虹等在研究墨兰的组织培养和快速繁殖中也使用1/2MS培养基[12]。
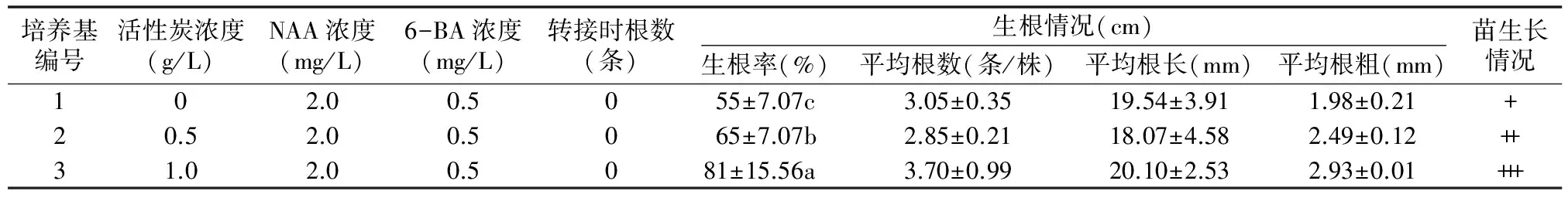
表4 不同活性炭用量对杂交兰生根的影响
植物激素是植物新陈代谢中产生的天然复合物,植物激素的种类和浓度是影响兰花组织培养的重要因素之一,很小的量就会影响植物细胞的分化、分裂、发育、形态建成、开花和结实等[13-14]。细胞分裂素的作用在于刺激细胞分裂、诱导芽的分化、促使叶片扩大和茎长高、打破顶端优势、促进丛生芽的形成和增殖、抑制根的生长[15],而目前6-BA是兰花组织培养中最常用的细胞分裂素之一。生长素的主要生理作用是促进生根,与细胞分裂素协同可诱导不定芽的分化、侧芽的萌发与生长[16],而NAA是兰花组培中最常用的生长素。陈丽等认为,NAA+BA有利于墨兰原球茎的生长、分化[17],陈小强等在研究大花蕙兰原球茎增殖时发现,NAA+6-BA对大花蕙兰的增殖效果良好[18],而一般情况下,当生长素/细胞分裂素比例高时抑制不定芽分化、促进生根,反之亦然[19]。原球茎在分化芽苗阶段,由于生根数少而短,易导致炼苗时难以成活,因此,筛选最佳的生根培养基非常重要[20]。相关研究表明,降低6-BA浓度、适当增加NAA的浓度有助于兰花生根。本试验结果表明,不同的6-BA与NAA配比对墨兰与大花蕙兰杂交兰的原球茎增殖与分化、不定芽增殖和生根有明显影响,含6-BA 1.5 mg/L+NAA 0.5 mg/L的培养基可获得288.88%的原球茎增殖率和40.97%的分化率;不定芽增殖的最佳激素配比为6-BA 2.0 mg/L+NAA 0.3 mg/L,此时NAA浓度/6-BA浓度为0.15,增殖率为227.5%,当NAA浓度/6-BA浓度>0.15时,不定芽的增殖率递增,而NAA浓度/6-BA浓度<0.15时,不定芽的增殖率随6-BA浓度的增加而递减;高浓度NAA对生根有抑制作用,NAA浓度为 2.0 mg/L 时杂交兰的生根苗数多,生根率为81%,且苗生长健壮。
香蕉对酸碱有很强的缓冲能力,能保持培养基pH值在5.6左右,对植物的生长、增殖具有促进作用,同时香蕉泥还能有效吸收外植体分泌的类多酚氧化物,抑制外植体的褐变、降低其死亡率。李小军等研究发现,香蕉对霍山石斛壮苗有促进作用[21];王玉英等在辐射诱变的线艺兰快繁技术体系研究中加入了80 g/L香蕉泥[22]。巩振辉等认为,适宜的生根培养基中添加适量的活性炭有助于生根[23-25]。本试验在杂交兰不同培养阶段都添加了80 g/L香蕉泥,这有助于杂交兰组培苗的复壮、减轻褐变现象的出现;而在生根阶段加入1.0 g/L活性炭,此时杂交兰生根率高,根数多且长。
[1]刘 燕. 园林花卉学[M]. 北京:中国林业出版社,2003:336.
[2]王玉英,李光宏,李志敏,等. 野生黄婵兰无菌快繁技术的研究[J]. 安徽农业科学,2013,41(28):11275-11277.
[3]李 丽,罗君琴,聂振鹏,等. 线艺兰的组织培养及植株再生研究[J]. 浙江农业科学,2008(6):679-681.
[4]陈兰芬,王 晶,田亦平,等. 墨兰组织培养根状茎分化技术研究[J]. 河北林果研究,2011,26(1):22-24.
[5]胡燕梅,方中明,郭云贵,等. 大花蕙兰原球茎增殖、分化与离体保存的研究[J]. 安徽农业大学学报,2016,43(1):67-72.
[6]王亚沉,王玉英,周慧恒,等. 野生碧玉兰组培快繁技术[J]. 亚热带植物科学,2013,42(1):27-30.
[7]左利娟,李志强,郑志勇,等. 杂交兰根状茎的增殖与分化成苗技术[J]. 江苏农业科学,2015,43(6):54-55,56.
[8]李玉萍,罗凤霞,史慧梅. 春兰与大花蕙兰杂交种原球茎增殖研究[J]. 江苏农业科学,2016,44(1):53-55.
[9]张 莉,张 明,高宏秀. 兰花组织培养研究进展[J]. 安徽农业科学,2005,33(11):2134-2135,2147.
[10]朱根发,蒋明殿. 大花蕙兰的组织培养和快速繁殖技术[J]. 广东农业科学,2004(4):36-38.
[11]丁雪珍,韩 磊,张文静. 墨兰增殖培养基的筛选研究[J]. 北方园艺,2009(8):208-209.
[12]罗 虹,陈汝民. 墨兰的组织培养和快速繁殖[J]. 植物生理学通讯,1997(6):436-437.
[13]王 玲,陈发棣,陈 凤,等. 不同细胞分裂素及使用浓度对蝴蝶兰花梗芽增殖生长的影响[J]. 江苏农业科学,2013,41(2):49-51.
[14]章鹏程,陈 瑜,邓衍福,等. 6-BA与NAA不同浓度配比对大花蕙兰原球茎诱导的影响[J]. 杭州师范大学学报(自然科学版),2012,11(4):331-336.
[15]陈菁瑛,蓝贺胜,陈雄鹰. 兰花组织培养与快速繁殖技术[M]. 北京:中国农业出版社,2004:32.
[16]李子红,贾 燕. 珍品兰花快速繁殖与养护[M]. 上海:上海科学技术出版社,2006:125.
[17]陈 丽,潘瑞炽,陈汝民. 墨兰原球茎生长的研究[J]. 热带亚热带植物学报,1999,7(1):59-64.
[18]陈小强,马 毅,孙 宁,等. 大花蕙兰原球茎增殖条件研究[J]. 天津农学院学报,2009,16(1):9-12.
[19]李合生. 现代植物生理学[M]. 北京:高等教育出版社,2002:200-217.
[20]李玉萍,王燕青,武文婷,等. 春兰与大花蕙兰杂交种原球茎分化和生根研究[J]. 天津农业科学,2015,21(8):127-132.
[21]李小军,刘石泉,潘维陵,等. 香蕉提取物对霍山石斛试管苗壮苗的影响[J]. 江苏大学学报(自然科学版),2004,25(6):469-472.
[22]王玉英,苏 畅,李海燕,等. 辐射诱变的线艺兰快繁技术体系研究[J]. 北方园艺,2015,39(23):101-103.
[23]巩振辉,申书兴. 植物组织培养[M]. 北京:化学工业出版社,2007:34.
[24]Jiang J C,Tainter F H. Micro propagation of short leaf,virginia and loblolly short leaf pine hybrids via organogenesis[J]. Plant Cell Tissue and Organ Culture,1991,25(1):57-61.
[25]鲁 迪. 春剑和大花蕙兰种间杂交种子无菌萌发及杂交后代的RAPD分析[D]. 雅安:四川农业大学,2010:31-32.
