肥城桃果实己糖激酶Ⅱ基因克隆、生物信息学分析及原核表达
2018-01-12朱树华
张 凯,高 珊,朱树华
(山东农业大学 化学与材料科学学院,山东 泰安 271018)
糖为植物生长和呼吸提供能量,是所有植物生存的基础物质[1],也是决定果实品质的重要因素。在大多数高等植物中,通过光合作用产生的碳水化合物以蔗糖为主,通过韧皮部分配运输到不同的库组织中。在植物组织中,蔗糖可以被直接贮藏,还可以在蔗糖合成酶或者转化酶的作用下转化成己糖[2],也就是葡萄糖和果糖。在植物呼吸代谢过程中,己糖经过己糖激酶(Hexokinase,HK)磷酸化开始进行糖酵解,从而为植物活动提供能量和代谢产物[3-5],因此植物中淀粉的合成和碳元素的循环离不开HK对己糖的磷酸化[6-7]。HK也被称为双功能兼职酶[8],在植物的生长进程中,HK不仅参与糖代谢,而且是己糖传感器[9],在信号网络中起到传感和信号作用,能够感知外界营养、光和激素信号,调控植物的生长[10]。
广义上,植物中的HK包含己糖激酶、果糖激酶和葡萄糖激酶。果糖激酶对果糖有高度的特异性,葡萄糖激酶对葡萄糖具有专一性,而HK可以磷酸化果糖、葡萄糖等一系列己糖[11]。目前已经证实几乎所有生物体中都存在HK,根据对番茄、马铃薯等植物的HK研究发现HK存在同工酶,并且多数植物中都存在1~3个同工酶[12-13]。有研究表明,线粒体的信号转导途径汇聚于线粒体HKⅡ上[14],HKⅡ可以与线粒体膜通透性转化孔(MPTP)上的电压依赖型阴离子通道(VDAC)发生相互作用,HKⅡ从VDAC上脱落诱导VDAC蛋白关闭进而抑制MPTP的开放,从而调控线粒体的通透性[15-16]。
本试验以肥城桃(Prunuspersica(L.)Batsch cv.Feicheng)为试验材料,克隆得到肥城桃果实HKⅡ基因全长并进行了生物信息学分析,并在大肠杆菌中成功表达并且纯化出HKⅡ蛋白,以期对植物HKⅡ蛋白的结构和功能有进一步的了解,从而为揭示HKⅡ在线粒体中的信号转导途径奠定理论基础。
1 材料和方法
1.1 菌株、质粒及试验材料
以肥城桃果实为试验材料,于2015年采摘自山东省肥城市肥城桃基地。选择颜色均匀、大小相似、无机械损伤和无病虫害的七成熟桃果实,采摘后于2 h内运回实验室,0 ℃环境中预冷24 h后将果实切成大小均匀的碎块用液氮冷冻处理,-80 ℃冰箱保存备用。
大肠杆菌菌种E.coliDH5α、E.coliBL21(DE3)为山东农业大学化学与材料科学学院生物化学实验室保存。表达载体pET-30a质粒采购于全式金公司。克隆载体pMD18-T Vector采购于宝生物公司。本研究所用引物(表1)均由华大基因公司合成。

表1 PCR引物序列Tab.1 PCR primers and sequences
注:GGTACC为KpnⅠ酶切位点;GGATCC为BamHⅠ酶切位点。
Note: GGTACC isKpnⅠrestriction site;GGATCC isBamHⅠrestriction site.
1.2 试验方法
1.2.1 提取肥城桃果实总RNA及合成1st-Strand cDNA 总RNA参考改良CTAB法提取[17],使用购自TaKaRa公司的PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit合成1st-Strand cDNA。
1.2.2HKⅡ基因中间片段序列的克隆 根据从GenBank中查找的碧桃的HKⅡ基因片段,使用Primer Premier 6.0软件设计HKⅡ-F和HKⅡ-R作为验证引物,以合成的1st-Strand cDNA为模板加入PCR反应体系,将反应后的PCR产物进行1%琼脂糖凝胶电泳,将含有目的条带的凝胶块切块回收,使用Gel Extraction Kit(康为世纪)回收DNA片段。将目的DNA连接pMD18-T载体,通过热激法将构建好的克隆载体转化至感受态细菌DH5α中。通过菌液PCR验证筛选阳性克隆后送至测序公司(北京华大基因)。
1.2.3HKⅡ基因全长的克隆及生物信息学分析 根据通过测序验证的HKⅡ基因片段,设计RACE引物HKⅡ-S、HKⅡ-AS和巢式引物HKⅡ-NS、HKⅡ-NAS。使用SMARTTMRACE cDNA(TaKaRa)试剂盒,按照说明书操作进行5′-RACE和3′-RACE。将RACE得到的PCR产物作为PCR中的复制模板,加入巢式引物HKⅡ-NS、HKⅡ-NAS进行巢式PCR。PCR产物经过电泳纯化后,切胶回收目的DNA,送至华大公司测序。将测序得到的5′端和3′端核苷酸序列与中间片段拼接,得到HKⅡ基因全长。将获得的核苷酸序列在NCBI数据库中Blast检索分析同源序列,利用DNAMAN软件进行HKⅡ氨基酸序列同源性分析,使用MEGA 4.1软件构建HKⅡ蛋白序列的系统进化树。使用ProtParam tool在线分析HKⅡ蛋白的理化性质和亲水性。使用PSIPRED分析HKⅡ蛋白的二级结构,利用SWISS-MODEL对HKⅡ蛋白进行三维结构的模拟。
1.2.4 体外重组HKⅡ蛋白 根据HKⅡ的核苷酸完整开放阅读框,使用Primer Premier 6.0设计带有不同酶切位点的引物HKⅡ-1和HKⅡ-2。RT-PCR获得HKⅡ的DNA全长与pMD18-T Vector连接,构建克隆载体。将克隆载体和pET-30a质粒分别用限制性内切酶双酶切后,采用T4DNA Ligase连接目的片段,获得pET-30a-HKⅡ重组质粒。将重组质粒pET-30a-HKⅡ导入表达菌株BL21,经菌液PCR检测后进行体外重组蛋白。取200 μL菌液加入到10 mL含抗生素的培养基中,37 ℃摇菌至OD600=0.4~0.6,取1 mL菌液用于电泳检测,向剩余菌液中加入终浓度为1 mmol/L的IPTG,38 ℃条件下诱导8 h,取1 mL菌液进行12%的聚丙烯酰胺凝胶电泳检测。
1.2.5 HKⅡ重组蛋白的纯化 采用带有His标签的Ni-琼脂糖凝胶(Solarbio)进行蛋白质的纯化,按照说明书的使用方法操作。洗脱蛋白的咪唑洗脱液效果最佳浓度为200 mmol/L。用12%的SDS-PAGE分析纯化后的HKⅡ蛋白。
2 结果与分析
2.1 HKⅡ基因cDNA全长的克隆
通过GenBank中桃果实的HKⅡ基因片段,设计验证引物HKⅡ-F和HKⅡ-R,以反转录得到的cDNA为模板进行PCR反应,所得结果如图1-A所示,经过测序验证后序列一致。根据中间片段序列设计RACE引物以及巢式引物,进行RACE扩增和巢式PCR后得到与预期长度一致的目的条带,得到如图1-B所示的结果,将5′与3′-RACE的核苷酸序列与中间片段进行拼接后获得肥城桃HKⅡ基因cDNA全长序列,共1 835 bp。
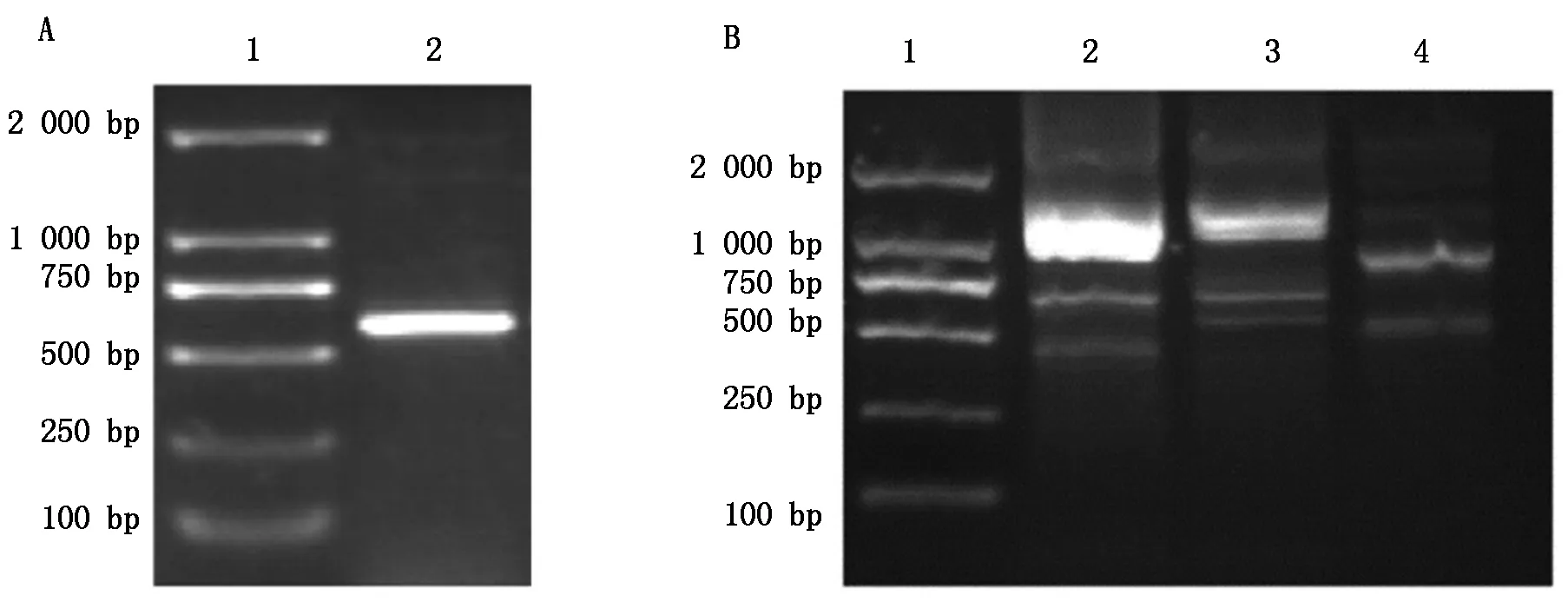
A.HKⅡ基因中间片段:1.DL2000分子量标准;2.PCR产物。B.巢式PCR:1.DL2000分子量标准;2,3.3′巢式PCR产物;4.5′巢式PCR产物。A.Middle sequences of HKⅡ gene:1.DL2000 Marker;2.Product of PCR.B.Nested PCR:1.DL2000 Marker;2,3.Nested PCR of 3′-RACE products;4.Nested PCR of 5′-RACE products.
2.2 HKⅡ基因的生物信息学分析
对HKⅡ基因进行生物信息学分析(图2-A),该序列具有起始密码子ATG(173 bp)和终止密码子TGA(1 664 bp),存在完整的开放阅读框。阅读框共有1 496个碱基,编码497个氨基酸(图2-B)。PortParam tool预测蛋白分子式为C2379H3846N652O717S17,原子总数为7 611个,分子量为53.6 kDa,理论等电点为6.17,总平均疏水指数为0.023,表明HKⅡ蛋白为疏水性蛋白。TMHMM跨膜结构预测HKⅡ为跨膜蛋白,有1次跨膜,绝大部分在膜外。如图3-A所示,二级结构预测结果显示HKⅡ蛋白由15段α螺旋和11段β折叠和无规则卷曲构成。肥城桃HKⅡ蛋白预测的三级结构如图3-B所示,其蛋白结构呈V字型,折叠结构较多。
2.3 HKⅡ氨基酸序列同源比对和系统进化分析
试验获取的桃果实HKⅡ氨基酸序列在NCBI数据库中进行Blast,与其他植物HKⅡ氨基酸序列比对,得到如图4所示的同源性关系。比对显示,桃果实与其他植物的HKⅡ氨基酸的同源性较高,其中与猕猴桃(Actinidiadeliciosa)、橙子(Citrussinensis)、木豆(Cajanuscajan)、枇杷(Eriobotryajaponica)、苹果(Malusdomestica)、葡萄(Vitisvinifera)、桑树(Morusnotabilis)、香瓜(Cucumismelo)、烟草(Nicotianatabacum)的相似度分别是91.58%,91.98%,92.18%,96.98%,96.58%,89.13%,93.59%,92.18%,90.78%,系统进化树(图5)中碧桃和枇杷在一支上,与同源比对结果一致。结果符合进化关系,说明植物的HKⅡ蛋白具有较高的保守性。

图2 HKⅡ基因cDNA序列(A)和氨基酸序列(B)Fig.2 Full length sequence of cDNA (A) and amino acid sequence (B) of HKⅡ
2.4 HKⅡ的体外表达与纯化
将重组质粒pET-30a-HKⅡ导入大肠杆菌BL21(DE3)中,加IPTG至终浓度为1 mmol/L,诱导表达,获得HKⅡ重组蛋白。电泳结果如图6-A所示,HKⅡ重组蛋白表达成功。菌液通过超声破碎分离出包涵体,溶解于6 mol/L盐酸胍缓冲液中,经过Ni-琼脂糖凝胶纯化后,获得较高纯度的HKⅡ重组蛋白(图6-B)。
3 结论与讨论
本试验通过NCBI中碧桃HKⅡ的cDNA序列为模板设计验证引物,以肥城桃果实中反转录的cDNA为模板进行PCR,测序后试验结果与碧桃的序列片段一致,根据该片段设计RACE引物和巢式PCR引物,获得HKⅡ基因5′和3′端序列后,片段拼接得到共计1 664 bp的肥城桃果实HKⅡ基因cDNA序列,编码氨基酸497个。对HKⅡ进行序列比对和生物信息学分析,发现桃HKⅡ具有较高的同源性,与枇杷(ADZ96378.1)的HK同源性最高。本试验还体外表达了HKⅡ蛋白,通过Ni-琼脂糖凝胶纯化出带有His标签的目的蛋白。
人们在1956年发现并报道了己糖激酶,在随后的研究中发现植物体组织中存在好几种不同的己糖激酶,它们分布在细胞的叶绿体、线粒体、液泡、内质网、细胞核等不同的组织中,而且它们的层析和动力学性质有一定差异[18]。细胞质中的HK可活化其中的葡萄糖[19],而线粒体膜上的HK参与糖酵解过程[20],细胞核中HK可以影响调控葡萄糖信号基因的表达。有研究表明,苹果的HK在细胞质基质中含量最高,为39.1%,其次是线粒体,为17.4%[21],本研究为下一步桃果实中HKⅡ基因的亚细胞定位和探讨打下了基础。
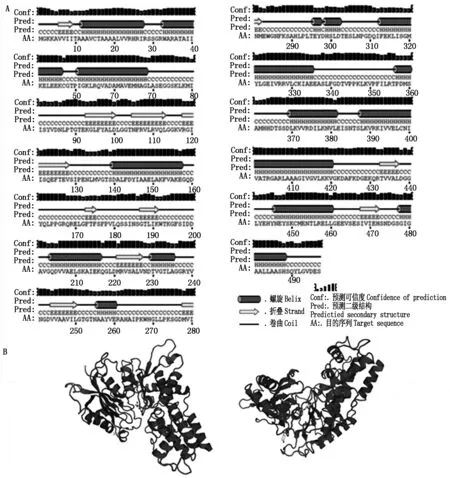
图3 HKⅡ蛋白二级结构(A)和三级结构预测(B)Fig.3 The second structure (A) and thepredicted tertiary structure (B) of HKⅡ protein

由上而下依次为橙子、猕猴桃、木豆、枇杷、苹果、葡萄、桑树、香瓜、烟草、碧桃。The amino acid sequence in the map which from the top to the bottom represent are:Citrus sinensis,Actinidia deliciosa,Cajanus cajan,Eriobotrya japonica,Malus domestica,Vitis vinifera,Morus notabilis,Cucumis melo,Nicotiana tabacum,Prunus persica.

分支上的数值表示1 000次重复计算得到的Bootstrap值。The values on the branches represent the Bootstrap values obtained by the 1 000 iteration.
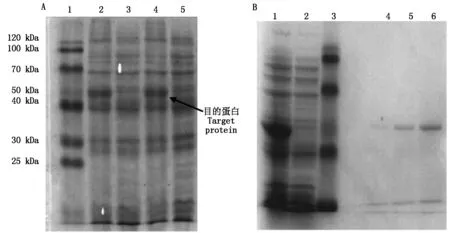
A.HKⅡ重组蛋白表达:1.低分子蛋白质分子量标准;2,4.含pET-30a-HKⅡ质粒,经IPTG诱导的蛋白;3.含pET-30a-HKⅡ质粒,未诱导的蛋白;5.含pET-30a的质粒,经IPTG诱导的蛋白。B.HKⅡ重组蛋白纯化:1.经IPTG诱导的蛋白;2.未经IPTG诱导的蛋白;3.低分子蛋白质分子量标准;4~6.纯化后的HKⅡ蛋白。
A.Recombinant protein expression of HKⅡ:1.Standard protein molecular mass Markers;2,4.pET-30a-HKⅡ with induction by IPTG;3.pET-30a-HKⅡ without induction;5.pET-30a with induction by IPTG.B.Purification of HKⅡ recombinant protein:1.pET-30a-HKⅡ with induction by IPTG;2.pET-30a-HKⅡ without induction;3.Standard protein molecular mass Markers;4-6.Purified HKⅡ protein.
图6HKⅡ重组蛋白12%SDS-聚丙烯酰氨凝胶电泳
Fig.6RecombinantHKⅡproteinin12%SDS-PAGE
近年来的研究发现,己糖激酶参与高等植物的糖感受和信号转导的过程,植物细胞能够响应和感受己糖激酶信号,己糖激酶还参与了植物细胞程序性死亡。VDAC作为调控线粒体膜通透性和参与细胞凋亡通路的重要组成部分[22],和HK结合后影响了MPTP的开放。另有研究表明,在植物中VDAC和HK的表达量是一致的[23-24]。这表明,在植物体中HK参与糖酵解和细胞凋亡的信号转导途径,更多关于肥城桃果实HKⅡ的重组蛋白活性检测、结构分析的试验正在进行中,将为HK参与的多种信号通路和糖感受机制提供理论依据。
[1] Li L,Sheen J.Dynamic and diverse sugar signaling[J].Current Opinion in Plant Biology,2016,33:116-125.
[2] Li M,Feng F,Cheng L.Expression patterns of genes involved in sugar metabolism and accumulation during apple fruit development[J].PLoS One,2012,7(3):e33055.
[3] Yim H K,Lim M N,Lee S E,et al.Hexokinase-mediated sugar signaling controls expression of the calcineurin B-like interacting protein kinase 15 gene and is perturbed by oxidative phosphorylation inhibition[J].Journal of Plant Physiology,2012,169(15):1551-1558.
[4] Claeyssen E,Rivoal J.Isozymes of plant hexokinase:occurrence,properties and functions[J].Phytochemistry,2007,68(6):709-731.
[5] Granot D,David-Schwartz R,Kelly G.Hexose kinases and their role in sugar-sensing and plant development[J].Frontiers in Plant Science,2013,4(1):44.
[6] Alonso A P,Vigeolas H,Raymond P,et al.A new substrate cycle in plants.Evidence for a high glucose-phosphate-to-glucose turnover frominvivosteady-state and pulse-labeling experiments with[13C]glucose and [14C] glucose[J].Plant Physiology,2005,138(4):2220-2232.
[7] Zhao J,Sun M,Hu D,et al.Molecular cloning and expression analysis of a hexokinase gene,MdHXK1 in apple[J].Horticultural Plant Journal,2016,2(2):67-74.
[8] Moore B D.Bifunctional and moonlighting enzymes:lighting the way to regulatory control[J].Trends in Plant Science,2004,9(5):221-228.
[9] Kim Y M,Heinzel N,Giese J O,et al.A dual role of tobacco hexokinase 1 in primary metabolism and sugar sensing[J].Plant,Cell & Environment,2013,36(7):1311-1327.
[10] Feng J,Zhao S,Chen X,et al.Biochemical and structural study ofArabidopsishexokinase 1[J].Acta Crystallographica Section D-Biological Crystallography,2015,71(Pt 2):367-375.
[11] Kelly G,Moshelion M,David-Schwartz R,et al.Hexokinase mediates stomatal closure[J].The Plant Journal :for Cell and Molecular Biology,2013,75(6):977-988.
[12] Claeyssen E,Wally O,Matton D P,et al.Cloning,expression,purification,and properties of a putative plasma membrane hexokinase fromSolanumchacoense[J].Protein Expression and Purification,2006,47(1):329-339.
[13] Feng J,Zhao S,Chen X,et al.Biochemical and structural study ofArabidopsishexokinase 1[J].Acta Crystallographica Section D-Biological Crystallography,2015,71(Pt 2):367-375.
[14] Rasola A,Sciacovelli M,Pantic B,et al.Signal transduction to the permeability transition pore[J].FEBS Letters,2010,584(10):1989-1996.
[15] Godbole A,Dubey A K,Reddy P S,et al.Mitochondrial VDAC and hexokinase together modulate plant programmed cell death[J].Protoplasma,2013,250(4):875-884.
[16] Szabo I,Zoratti M.Mitochondrial channels:ion fluxes and more[J].Physiological Reviews,2014,94(2):519-608.
[17] 陈长宝,朱树华,周 杰.改良CTAB法提取成熟肥城桃果实的总RNA[J].山东农业科学,2009(5):102-104.
[18] 秦巧平,张上隆,徐昌杰.己糖激酶与植物生长发育[J].植物生理学通讯,2003,39(1):1-8.
[19] Cheng W,Zhang H,Zhou X,et al.Subcellular localization of rice hexokinase (OsHXK) family members in the mesophyll protoplasts of tobacco[J].Biologia Plantarum,2011,55(1):173-177.
[20] Granot D,Kelly G,Stein O,et al.Substantial roles of hexokinase and fructokinase in the effects of sugars on plant physiology and development[J].Journal of Experimental Botany,2014,65(3):809-819.
[21] 赵 锦,孙美红,胡大刚,等.苹果己糖激酶基因MdHXK1的克隆与表达分析[J].园艺学报,2015,42(8):1437-1447.
[22] Vianello A,Casolo V,Petrussa E,et al.The mitochondrial permeability transition pore (PTP)-an example of multiple molecular exaptation?[J].Biochimica et Biophysica acta,2012,1817(11):2072-2086.
[23] Homblé F,Krammer E M,Prévost M.Plant VDAC:facts and speculations[J].Biochimica et Biophysica acta,2012,1818(6):1486-1501.
[24] Kusano T,Tateda C,Berberich T,et al.Voltage-dependent anion channels:their roles in plant defense and cell death[J].Plant Cell Reports,2009,28(9):1301-1308.
