黄瓜S期激酶相关蛋白Skp1的原核表达及其多克隆抗体的制备
2018-01-12孙新艳韩晓玉王振跃陈琳琳燕照玲艳1
孙新艳,魏 莹,韩晓玉,王振跃,陈琳琳,燕照玲,施 艳1,
(1.河南省果树瓜类生物学重点实验室,河南 郑州 450002;2.河南农业大学 植物保护学院,河南 郑州 450002;3.河南省农业科学院,河南 郑州 450002)
S期激酶相关蛋白1 (S-phase kinase-associated protein 1,Skpl ) 是真核生物中普遍存在的一类蛋白,是SCF型E3泛素连接酶途径的核心蛋白,具有特异性地连接Cullin1(Cul1) 和F-box蛋白的作用[1-3],通过与Cullin1、Rbx1和F-box蛋白形成SCF复合物来发挥功能,在SCF复合物中,Cullin1与Rbx1结合,F-box蛋白识别靶标蛋白,Skp1分别结合F-box蛋白和Cullin1,Skp1-Cul1-F-box (SCF) E3复合体在多个细胞过程中起重要作用[4]。研究表明,Skp1在真核生物的细胞周期、转录调控、信号传导等很多细胞进程中发挥关键作用。Skp1相关基因被证实在植物生长素、赤霉素、乙烯、茉莉酸和光反应途径中有十分重要的作用[5-11]。研究发现,Skp1基因在小麦从可育转变为不育过程中表达受到抑制,说明Skp1与小麦育性转变密切相关[12]。本试验构建了黄瓜Skp1基因的原核表达载体,并在大肠杆菌中高效表达出该基因的融合蛋白,通过免疫新西兰大耳白兔制备了特异性抗血清,为进一步研究该基因的功能奠定了基础。
1 材料和方法
1.1 试验材料、菌株、质粒和试剂
供试黄瓜品种为新优36,种植于温室中。
大肠杆菌菌株DH5α、BL21、原核表达载体pET-28a由河南省果树瓜类生物学重点实验室保存。
限制性内切酶、T4DNA 连接酶购自美国NEB公司。PrimeSTAR Max DNA Polymerase购自TaKaRa。IPTG、Kana、Tris、SDS、丙烯酰胺、甘氨酸为北京索莱宝科技有限公司产品。辣根过氧化物酶标记的羊抗兔IgG为Sigma 产品。SanPrep柱式质粒DNA小量抽提试剂盒为生工生物工程上海股份有限公司产品。其他试剂为进口和国产分析纯。
1.2 引物设计
根据 NCBI 已经发表的黄瓜Skp1基因序列,利用软件DNAMAN设计扩增全长阅读框的引物。正向引物为5′-GACGGATCCATGTCCTCCTCCAACAAA
AT-3′,反向引物为5′-GATCTCGAGTCATTCACAAGCC
CACTGAT-3′。引物由南京金斯瑞生物科技有限公司合成。为了便于克隆,分别在5′ 和3′ 端添加酶切位点BamH Ⅰ和XhoⅠ。
1.3 Skp1基因原核表达载体的构建
以黄瓜叶片cDNA为模板扩增Skp1基因,PCR 50 μL扩增体系:1 μL cDNA,正向引物和反向引物各0.5 μL,PrimeSTAR Max DNA聚合酶25 μL,ddH2O 23 μL。PCR反应条件:94 ℃ 预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 延伸10 min。PCR产物通过试剂盒回收纯化。将纯化后的Skp1片段和pET-28a载体分别用BamHⅠ 和XhoⅠ双酶切,用T4DNA 连接酶连接过夜后转化大肠杆菌DH5α,挑取阳性克隆进行菌落PCR鉴定并测序,提取质粒。
1.4 Skp1基因的诱导表达和SDS-PAGE 分析
将重组质粒转化大肠杆菌BL21菌株,挑取单菌落于37 ℃过夜培养,用含Kana 50 μg/mL 的LB培养基按1∶100的比例扩大培养,振荡培养至OD600为0.8。加入IPTG 至终浓度为1 mmol/L,继续培养3,6,9 h,分别离心收集菌体,每50 mL菌液加入5 mL ddH2O和1 mL 样品缓冲液(40 mmol/L Tris-HCI(pH值6.8)、10% 甘油、5% SDS、5% 巯基乙醇、0.1%溴酚蓝),煮沸10 min,离心后取上清,用12% 的分离胶进行SDS-PAGE分析。
1.5 抗血清制备及其效价测定
参照Hager 和Burgess的方法回收表达产物,表达产物经12%的SDS-PAGE 电泳后,将凝胶用预冷的0.25 mmol/L KCl,1 mmol/L DTT 溶液浸泡5 min,重蒸水冲洗,切下含目的条带的凝胶,按1∶1比例(m/V)加入PBS 缓冲液(0.14 mol/L NaCl、2.7 mmol/L KCl、1.5 mmol/L KH2PO4、8.1 mmol/L Na2HPO4),于冰浴中研磨[13]。用PBS缓冲液适当稀释后,加入等体积的福氏不完全佐剂(1.5 g羊毛脂+8 mL石蜡油)进行乳化。采用肌肉注射的方法免疫新西兰大耳白兔,共免疫5次。
以纯化的蛋白(2.5 μg/mL) 作为抗原包被ELISA板,将抗血清进行一系列倍比稀释后作为一抗,辣根过氧化物酶标记的羊抗兔IgG为二抗,用ACP-ELISA测定抗血清的效价。
1.6 蛋白免疫印迹(Western Blot)分析
利用植物总蛋白抽提缓冲液 (220 mmol/L Tris-HCl,pH值 7.4,250 mmol/L蔗糖,1 mmol/L MgCl2,50 mmol/L KCl,10 mmol/L β-巯基乙醇,100 μmol/L PMSF)提取黄瓜叶片总蛋白,取10 μL 上样于5% 的浓缩胶和12% 的分离胶进行SDS-PAGE 电泳,电泳结束后转移到PVDF膜上,加稀释500倍和稀释1 000倍的兔抗血清杂交,随后加入辣根过氧化物酶标记的羊抗兔IgG(1∶2 000稀释),在增强型HRP-DAB 底物显色试剂盒中显色至条带清晰。
2 结果与分析
2.1 黄瓜Skp1基因原核表达载体的构建
以黄瓜叶片cDNA为模板,经PCR扩增得到1条特异性片段(图1),与预期大小一致。扩增出的特异性条带在T4DNA连接酶的作用下连接到pET-28a载体上,菌落PCR验证阳性克隆并测序,获得重组质粒pETSkp1。Skp1基因全长阅读框由468个核苷酸组成,共编码155个氨基酸。

M.DNA 分子标准DL5000;1.PCR 产物。M.DNA Marker DL5000;1.PCR Product.
2.2 表达产物的SDS-PAGE 分析和蛋白纯化
将诱导后的含有pETSkp1的重组质粒的菌株裂解物进行SDS-PAGE分析,未诱导的菌株裂解物作为对照,从图2可以看出,诱导后的菌株可产生分子质量约20 kDa 的特异蛋白质条带,与预期大小相符。IPTG诱导后3 h,Skp1蛋白即获得诱导表达,6,9 h诱导对表达量没有影响,因此,本试验用3 h进行诱导,切胶回收蛋白,研磨纯化。

M.蛋白分子质量标准;1.pET空载体未诱导;2~4.未加IPTG,pETSkp1 诱导3,6,9 h;5.pETSkp1未诱导;6~8.IPTG诱导pETSkp1后3,6,9 h。
M.Protein Marker;1.pET-28a without induction;2-4.Total proteins of pETSkp1 being induced for 3,6,9 h respectiveIy without IPTG;5.pETSkp1 without induction;6-8.Total proteins of pETSkplbeing induced for 3,6,9 h respectively.
图2SDS-PAGE分析Skp1融合蛋白的诱导表达
Fig.2SDS-PAGEanalysisofexpressionproductsofpETSkp1
2.3 抗血清的制备及效价测定
用回收的特异性蛋白免疫新西兰大白兔,5次免疫后取血获得黄瓜Skp1的抗血清。将纯化的蛋白作为抗原,分别通过2种方式进行抗原包被,ACP-ELISA 检测结果表明:用胶条电洗脱包被,抗血清稀释128×103倍后能明显检测出;用包涵体抗原包被,抗血清稀释512 × 103倍后能明显检测出(表1)。
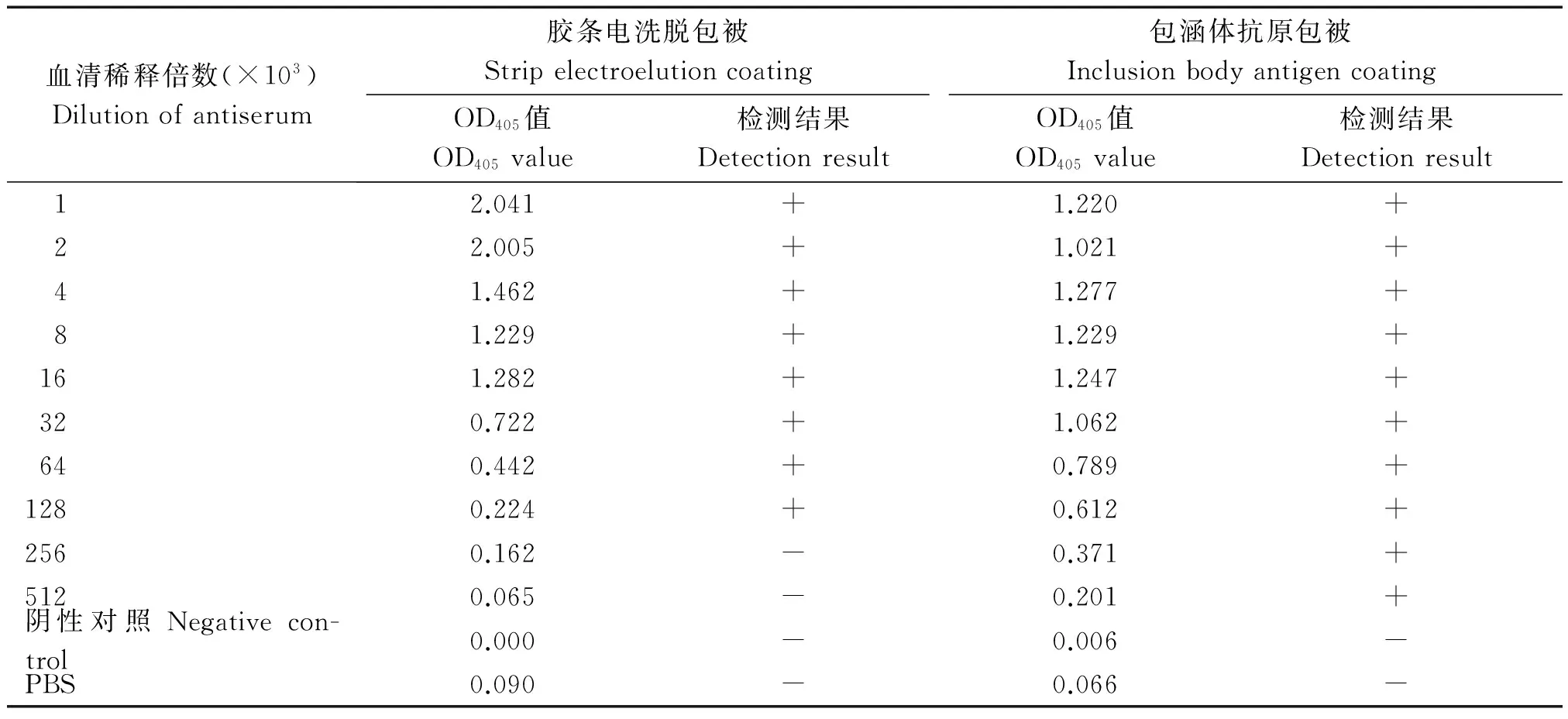
表1 抗血清效价测定Tab.1 Determination of the titer of antiserum
注:+.阳性;-.阴性。
Note:+.Positive;-.Negative.
2.4 Western Blot 检测黄瓜样品结果
提取黄瓜叶片的总蛋白,将制备的抗血清分别稀释500,1 000倍作为一抗来检测抗血清的特异性。结果表明,在这2种条件下均能明显地检测出Skp1编码的蛋白,并与预期结果一致(图3)。
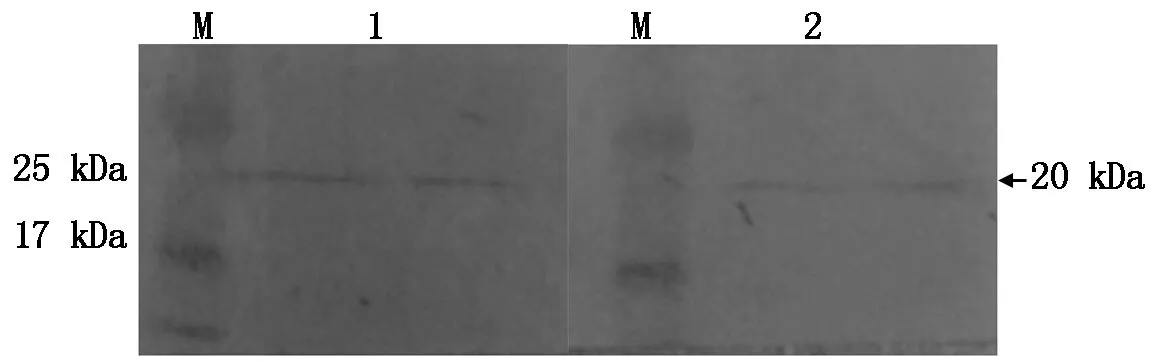
M.蛋白分子质量标准;1.抗血清稀释500倍;2.抗血清稀释1 000倍。 M.Protein Marker;1.Antiserum diluted 500 times;2.Antiserum diluted 1 000 times.
3 结论与讨论
本研究确定了Skp1蛋白在大肠杆菌BL21中高效表达的条件,利用纯化的蛋白制备了抗血清,并通过ELISA测定了其效价为1∶128 000~512 000,Western Blot检测结果发现对抗血清进行1∶500和1∶1 000稀释都可以很好地检测到Skp1蛋白,通过Western Blot进一步验证了抗血清在植物中的应用,为通过免疫共沉淀筛选与Skp1互作蛋白奠定了试验基础,同时为进一步研究黄瓜Skp1蛋白功能提供依据。
Skp1蛋白具有广泛的生物学功能,最多的研究是对泛素蛋白酶的研究,泛素蛋白酶体系统(Ubiquitin-proteasome system,UPS)是目前已知的所有真核生物体内具有高度选择性的最为重要的蛋白质降解途径,参与细胞内80%以上蛋白质的降解,泛素蛋白酶体途径广泛调控植物生长发育,如激素信号转导、胚胎发育、光信号调节、开花、干旱、自交不亲和性以及植物与病原菌相互作用和免疫反应等过程。
在拟南芥的研究中Skp1蛋白参与了多个SCF复合体的形成,Skp1作为SCF复合物中的一个关键的骨架蛋白同时结合F-box蛋白和Cul1,调控着包括植物雄性减数分裂、生长素、赤霉素、茉莉酸和乙烯等生理和发育进程[14-17]。在许多研究中,Skp1通过与病毒互作在病毒侵染植物中发挥重要作用[18-19]。黄瓜作为多种植物病毒寄主,Skp1可能在病毒侵染黄瓜中发挥重要作用,另外研究发现,Skp1参与糖基化调节[20]。黄瓜中Skp1功能研究鲜有报道,Skp1作为多种生物学过程的交叉点可能对黄瓜的生长发育及抗病性发挥重要作用。
[1] Cheng X, Liu Y Q, Wang G Z, et al. Proteomic identification of the oncoprotein STAT3 as a target of a novel Skp1 inhibitor[J]. Oncotarget, 2017, 8(2):2681-2693.
[2] Hao Q, Ren H X, Zhu J, et al. Overexpression ofPSK1, a SKP1-like gene homologue, fromPaeoniasuffruticosa, confers salinity tolerance inArabidopsis[J]. Plant Cell Reports, 2017, 36(1): 151-162.
[3] Li P, Miao H X, Ma Y E, et al. CrWSKP1, an SKP1-like Gene, Is Involved in the Self-Incompatibility reaction of Wuzishatangju(CitrusreticulataBlanco)[J]. International Journal of Molecular Sciences, 2015, 16(9): 21695-21710.
[4] Zhao L, Huang J, Zhao Z H, et al. The Skp1-like protein SSK1 is required for cross-pollen compatibility in S-RNase-based self-incompatibility[J]. Plant Journal, 2010, 62(1): 52-63.
[5] Takahashi N, Kuroda H, Kuromori T, et al. Expression and interaction analysis ofArabidopsisSkp1-related genes[J]. Plant & Cell Physiology, 2004, 45(1): 83-91.
[6] Sandoval D, Hill S, Ziemba A, et al. Ubiquitin-conjugating enzyme Cdc34 and ubiquitin ligase Skp1-Cullin-F-box ligase (SCF) interact through multiple conformations[J]. Journal of Biological Chemistry, 2015, 290(2): 1106-1118.
[7] Wilken F E, Ros B, Berger D K. Expression analysis of the defence gene SGT1 (suppressor of the G2 allele of skp1) in pearl millet (Pennisetumglaucum) during salicylic acid treatment[J]. South African Journal of Botany, 2009, 75(2): 427-428.
[8] Parry G, Estelle M. Auxin receptors: a new role for F-box proteins[J]. Current Opinion in Cell Biology, 2006, 18(2): 152-156.
[9] Tintignac L A, Lagirand J, Batonnet S, et al. Degradation of MyoD mediated by the SCF (MAFbx) ubiquitin ligase[J]. Journal of Biological Chemistry, 2005, 280(4): 2847-2856.
[10] 姚明月. 酵母科F-box基因家族的进化分析[D]. 杨凌: 西北农林科技大学, 2015.
[11] Dimitrova Y N, Li J, Lee Y T, et al. Direct ubiquitination of beta-Catenin by siah-1 and regulation by the exchange factor TBL1[J]. Journal of Biological Chemistry, 2010, 285(18): 13507-13516.
[12] 宋瑜龙. 小麦雄性不育相关基因SKP1的克隆与表达分析[D]. 杨凌: 西北农林科技大学, 2011.
[13] 马瑞丰. 橡胶树乳管细胞SCF-(COI1)复合物相关蛋白的基因克隆及表达分析[D]. 海口: 海南大学, 2010.
[14] Wang M Y, Song Y L, Zhang S X, et al. The analysis ofSKP1 gene expression in physiological male aterility induced by chemical hybridizing agent SQ-1 in wheat(TriticumaestivumL.) [J]. Cereal Research Communications, 2015, 43(2): 204-212.
[15] 郑鸿平, 李逸平. 调控细胞活动不可或缺的重要分子-F-box蛋白[J]. 生命的化学, 2011, 5:619-624.
[16] Liu A, Yu Y, Duan X, et al. GsSKP21, a Glycine soja S-phase kinase-associated protein, mediates the regulation of plant alkaline tolerance and ABA sensitivity [J]. Plant Molecular Biology, 2015, 87: 111-124.
[17] Xu Y F, Sengupta T, Kukreja L, et al. MicroRNA-223 regulates cyclin E activity by modulating expression of f-box and WD-40 domain protein 7[J]. Journal of Biological Chemistry, 2010, 285(45): 34439-34446.
[18] Mudhasani R, Tran J P, Retterer C, et al. Protein kinase R degradation is essential for rift valley fever virus infection and is regulated by SKP1-CUL1-F-box (SCF)FBXW11-NSs E3 ligase[J]. PLOS Pathogens, 2016, 12(2): e1005437.
[19] 陶 涛, 王 倩, 陈相儒, 等. 水稻黑条矮缩病毒(RBSDV) P7-2与部分水稻SKP1蛋白家族成员的互作分析[C]//彭友良. 中国植物病理学会2015年学术年会论文集.北京:中国农业科学技术出版社, 2015.
[20] 范锡麟. 小粒野生稻OmSKP1的点突变蛋白表达纯化与体外互作的初步分析[D]. 长沙: 湖南农业大学, 2013.
