富血小板纤维蛋白联合自体软骨颗粒修复兔耳软骨缺损
2018-01-12张正文
王 秀,张正文,谢 锋
(河南省人民医院整形外科 河南 郑州 450000)
自体软骨因取材丰富、组织相容性好、易于成活、与机体无排斥反应、感染及外露率低等优点被广泛应用于整形外科手术中,然而软骨移植术后,供区若遗留间隙或渗血可能会发生血肿、继发感染、局部皮肤坏死。鼻中隔术区可能出现黏骨膜坏死和穿孔,耳廓再造术中因切取肋软骨量较大,供区(尤其是儿童患者)术后可能会出现一定程度的胸廓畸形,并对正常胸廓形态发育产生一定影响。胸部术区软组织量多,一旦发生感染预后瘢痕明显或增生,外形异常甚至牵拉乳房移位变形等一系列并发症,致使患者及家属对手术效果不满意。供区软骨自身修复能力较差及创面恢复过程中的相应并发症一直是临床医师需要解决的难题。2001年法国科学家Choukroun[1]提取出第二代血小板浓缩制品富血小板纤维蛋白( platelet -rich fibrin,PRF),取自自体,直接经离心所得,未添加任何生物制剂,被证明具有促进软组织的修复,减轻炎性反应和水肿,诱导干细胞的增殖、分化、运动、凋亡及促进骨组织修复重建的能力。近年来利用颗粒软骨单独或利用其他材料包裹移植进行各种软骨缺损的修复手术及鼻整形中的应用取得较好的手术效果[2-3],为颗粒软骨的利用提供了依据。本基础实验观察PRF结合颗粒软骨修复兔耳软骨缺损的修复情况,为临床软骨移植术后供区修复提供参考。
1 材料和方法
1.1 实验动物:12~16周生长期雄性新西兰大白兔30只,体重3.2~3.5kg,均购自郑州大学医学院实验室,清洁级,普通环境下笼内单独饲养(均遵照河南省人民医院实验动物饲养与使用规定)。动物购置后适应环境2周。
1.2 实验方法
1.2.1 分组:将30只实验兔,随机分为5组,空白对照组、颗粒软骨组、PRF组、PRF+颗粒软骨组、软骨块回置组,每只实验兔双耳对称区各取一处作为实验区,每组12个标本。
1.2.2 PRF制取:实验动物称重,7%的水合氯醛注射液按3ml/kg从耳缘静脉麻醉,麻醉成功耳中动脉抽血10ml置于5ml无菌玻璃试管,离心机3 000r/min离心10min,可见血液分为3层,上层清亮液为血清,底层为破碎红细胞层,中间乳白色为纤维蛋白凝胶层[4](图1),取离心后试管中的中间层,保留少量底部红细胞层,放置于白色无菌纱布上,静置5min,称重,制备成100mg凝胶块(图2),轻轻按压挤出剩余水分使之成膜状备用。
1.2.3 制作软骨缺损动物模型及颗粒软骨的制取:于各组标记实验区切取面积约1.0cm×0.6cm的全层软骨组织。并将颗粒软骨组、PRF+颗粒软骨组切取的软骨取0.5cm×0.4cm大小的组织切成直径约1mm的软骨颗粒备用。1.2.4 缺损修复:各术区创面严密止血,反复冲洗后,空白对照组创面不作任何处理;颗粒软骨组创面置入制取的颗粒软骨;PRF组创面内置入PRF;PRF+颗粒软骨组将软骨颗粒+PRF置入缺损部位;软骨块回置组将所取软骨块原位回置于创面。每组间断缝合切口,术区涂抹红霉素软膏后处于暴露状态,放回原笼中,自由活动,定期换药。

图1 制得的PRF(乳白色凝胶状物) 图2 制备的100mg PRF凝胶块
1.3 观察指标
1.3.1 大体观察:术后观察实验兔活动、进食及切口的感染、血肿等一般情况。切取耳廓组织标本后观察大体形态及术区修复情况,包括缺损被覆程度、软骨缺损区边界与新生软骨表面情况等。
1.3.2 组织学观察:于术后4周、8周、12周分别切取各组实验兔耳软骨缺损段修复组织,标本置于体积分数为10%的甲醛溶液中固定,脱钙,梯度乙醇脱水,石蜡包埋后,切片行苏木精-伊红(Hematoxylin and Eosin,HE)染色,光镜下对修复组织的性质进行组织学观察了解修复组织的微观结构及特点和软骨细胞存活及再生情况。组织学观察指标依据Wakitanni[5]软骨缺损的组织学修复评分量表进行评估,主要包括组织形态学、细胞外基质、表面平整度、新生软骨厚度及移植组织与正常软骨融合度5个指标,总分0~14分,分数越低表示修复效果越好。见表1。

表1 软骨缺损修复组织学评分标准 (分)
1.4 统计学分析:数据采用SPSS19.0统计软件包进行统计分析。先经Levene齐性检验各时间组方差均满足齐性要求(P>0.05)。组织学评分结果行单因方差分析,两组间比较采用LSD-t检验, 数据以均值±标准差(x¯±s)表示。P<0.05为差异有统计学意义,P<0.01为差异有显著性意义。
2 结果
2.1 大体观察结果:所有实验动物无死亡,均进入结果分析,术后当日进食量减少,第2天基本恢复进食。颗粒软骨组1只兔耳术后出现感染,经换药后自行愈合。余各组实验兔切口均无红肿、渗出,无血肿形成,切口均一期愈合。
2.2 缺损修复情况:空白对照组:4~8周可以看到纤维组织增生明显,与周围组织有粘连;12周时缺损软骨除局部边缘外无明显软骨再生修复,创面呈瘢痕样修复。颗粒软骨组:4~8周可见颗粒软骨组织周围少量增殖软骨细胞,修复有限;12周时可见局部缺损边缘较前缩小,中央无颗粒区软骨缺损仍较明显,修复组织处表面凹凸不平。PRF组:4~8周时软骨缺损区逐渐缩小变浅;12周时可见软骨缺损区为薄薄的半透明新生软骨组织修复。PRF+颗粒软骨组:4~8周时可见缺损区新生软骨与置入的颗粒软骨融合良好,软骨缺损区逐渐被覆盖;12周时软骨软骨区修复良好,局部可触及突出感。软骨块回置组:4~8周时标本观察可见切取软骨边缘;12周时软骨回置区修复良好,表面光滑平整。见图3。
2.3 HE染色镜下观察结果:空白对照组:镜下可见大量纤维组织修复组织,排列分布杂乱无章,除靠近边缘软骨膜区见少量增殖的软骨细胞外,基本未见软骨细胞。颗粒软骨组:可见团块状软骨细胞聚集区,软骨块周围可见新生的软骨细胞,细胞团之间则为纤维组织填塞,新生软骨细胞为纤维软骨和弹性软骨混合。PRF组:可见增殖的软骨细胞,软骨细胞体积较小。PRF+颗粒软骨组:可见移植颗粒软骨细胞团周围出现大量的新生幼稚软骨细胞,体积较小,数量多,细胞之间排列紧密,新生软骨组织逐渐成熟,细胞体积增大,与周围的软骨组织逐渐融合到一起。软骨块回置组:软骨细胞形态基本与周围正常软骨细胞相近,软骨细胞包被于软骨囊内,软骨周边部分为幼稚软骨细胞,体积较小,呈椭圆形,越向中央,软骨细胞越趋成熟,体积逐渐增大,变成圆形或椭圆形,软骨基质与胶原纤维交织呈网状。见图4。
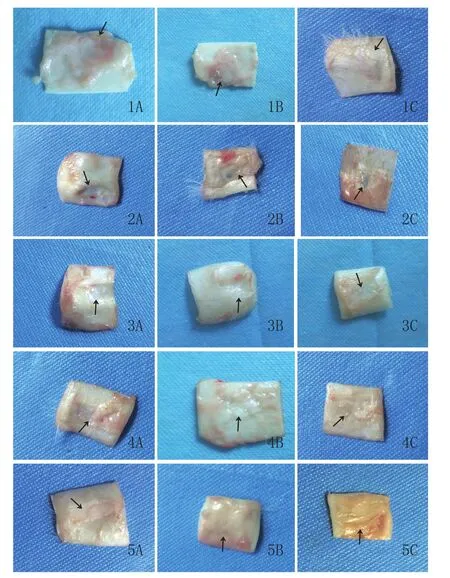
图3 各组标本大体观察结果

图4 各组标本HE染色镜下观察结果(200×)
2.4 组织学修复评分结果:由表2可知,PRF+颗粒软骨组修复评分显著低于空白对照组,差异有显著性意义(P<0.01);颗粒软骨组、PRF组修复评分均低于空白对照组,差异有统计学意义(P<0.05);颗粒软骨组、PRF组组间比较差异无统计学意义(P>0.05)。4周、8周时软骨块回置组组织学修复评分低于PRF+颗粒软骨组,差异有统计学意义(P<0.05),12周时两组间评分比较差异无统计学意义(P>0.05)。表明PRF联合颗粒软骨移植修复软骨缺损效果显著优于软骨缺损创面自行愈合,且于12周时修复的软骨形态与软骨块回置组修复效果相近;单独置入颗粒软骨或PRF修复软骨缺损也较缺损软骨自行愈合效果好。

表2 各组标本组织学修复评分比较 (分,x¯±s)
3 讨论
自体软骨来源于自体,无组织排异反应,感染和外露率低被广泛应用于整形外科手术中。自体肋软骨是国内外耳再造支架的最佳选择,随着鼻整形技术的迅速发展,肋软骨亦被广泛用于鼻背、鼻基底的前颌骨及梨状孔凹陷充填移植和鼻小柱的支撑移植等;耳廓软骨可作为外侧脚支撑移植物和覆盖软骨或硅胶等假体移植物修复重建鼻翼及鼻尖部亚单位;鼻中隔软骨可用于鼻中隔撑开、鼻小柱支撑、鼻背充填、鼻尖移植物和鼻翼缘轮廓线移植等。随着软骨移植技术的发展和应用,致使供区软骨缺损,且软骨移植术后,可能会出现感染、血肿等并发症,特别是胸部肋软骨供区切取较多量肋软骨后可能会出现一定程度的胸廓畸形。供区软骨自身修复能力较差及创面恢复过程中可能的并发症,耳廓再造或鼻整形过程中或多或少会出现的软骨碎屑以及小耳畸形患者残耳组织的再利用一直是临床医师不断探索的难题。国外学者利用耳再造术后产生的软骨碎屑回置于肋软骨供区,明显减少了胸廓畸形的发生率[6-7],为供区软骨缺损修复提供了参考。
PRF是法国科学家 Choukroun 于2001年首先报道的,是一种富含纤维蛋白、白细胞和大量生长因子的第二代血小板浓缩物,为三分子立体、疏松网状结构的凝胶,其分子结构类似于天然血凝块。相较于PRP的四分子结构,具有较大的孔隙及良好的弹性,有利于细胞因子的滞纳和细胞的长入[5,8],从而延长生长因子的释放时间。PRF中血小板活化后可释放转化生长因子-β(TGF-β)、血小板源生长因子(PDGF)、血管内皮因子(VEGF)、胰岛素样生长因子(IGF-1)、成纤维细胞生长因子(FGF)和表皮生长因子(EGF)等[9-10],这些生长因子可促进软组织的修复,减轻炎性反应和水肿,诱导干细胞的增殖分化、运动、凋亡以及和促进骨愈合及改建[11]。PRF缓慢释放上述各种生长因子,能够促进软骨细胞的增殖和软骨组织细胞外基质的生成,促进骨间质干细胞的增殖和分化,提高成骨细胞蛋白激酶和骨保护素的表达,促进成骨细胞的增殖和分化及新骨形成能力[10,12-13]。Bahmanpour[14]等在兔关节软骨损伤修复实验中通过6组对照实验得出PRF包裹SDF-1(cell-derived factor-1)对软骨全层缺损的修复作用依据国际软骨修复协会评分显著高于其他各组。张文丽[15]等观察PRF复合自体第3代BMSCs修复牙槽骨缺损的能力,发现其促进牙槽骨的再生与修复的能力显著优于其他对照组。杨勇等[16]用兔自体脂肪干细胞(ADSCs)与PRF复合修复家兔耳软骨全层缺损,较单纯置入自体未诱导的ADSCs组和单纯置入PRF组可以更加有效地修复兔耳软骨全层缺损。但是进行干细胞培养和移植要求条件较高,周期长,细胞诱导效果不稳定,移植后远期效果无法预测等,使其在具体临床应用中的推广受到限制。
颗粒软骨,即将自体软骨剪切成约1.0mm大小的颗粒状软骨组织。通常将其直接或利用不同材料包裹进行移植。1983年,Akecht等将兔自体软骨颗粒联合纤维粘合剂修复软骨缺损并发现明显的新生透明软骨[17],之后大量的基础实验也得出了相似理论[18-19]。进行颗粒软骨移植的理论基础是:将软骨制备成1~2mm大小的颗粒,可以使软骨细胞有效地从细胞外基质中释放出来,从而形成新的软骨样基质[20]。自体颗粒软骨是一个较理想的移植材料,取自自体,颗粒状易塑形成各种不同的形状以适应不同的供区,又增加了对软骨的利用率。但其术后远期有一定的吸收率,颗粒越细越小吸收越多,而且术后一旦出现感染局部产生的炎症反应也使软骨吸收增多。颗粒软骨易吸收的原因可能有:①脱离软骨膜的保护,缺乏营养供应;②力学环境的改变,颗粒软骨的生长失去一定的应力刺激;③自身抗原的暴露,加工颗粒软骨的过程令平时被软骨基质保护而未被识别的软骨细胞暴露于自身免疫系统中,加重其炎症反应[21]。为进行颗粒软骨移植及减少吸收率,前人进行了大量的探究。利用不同包裹材料包括氧化纤维素、自体筋膜组织及生物胶等,术后均存在一定的软骨吸收、术区臃肿或供区出现瘢痕等并发症,应用受到限制[22-23]。Bullocks等[24]采用自体混合凝胶ATG联合颗粒软骨进行鼻背填充,未出现明显的软骨吸收及并发症。因而利用本身具有抗感染而又具有促进软骨细胞增殖的材料包裹颗粒软骨就成了提高软骨移植成活率及减少远期吸收率的有效方法之一。
本次利用PRF能够有效抗炎、促进软组织修复及新骨形成结合颗粒软骨的软骨细胞能够从细胞外基质中释放出来促进新生软骨生成的原理进行实验设计的。依据大体标本及组织学观察可见PRF+颗粒软骨组移植软骨颗粒成活良好,且软骨周围可见大量新生软骨,新生软骨组织与原软骨组织形态相近,组织融合良好。软骨缺损修复较空白对照组缺损软骨组自行愈合有明显优势(P<0.01),12周时修复的软骨组织形态与周围组织软骨组织相近。单独颗粒软骨或PRF置入对软骨缺损修复亦有一定的促进作用。单独置入颗粒软骨主要为软骨缺损边缘或颗粒软骨周围局部组织的修复,缺损中央区或软骨颗粒缺乏区修复有限;单独置入PRF软骨缺损处增殖软骨细胞少且小,为纤维软骨修复为主,修复后软骨组织较正常软骨组织薄。本研究显示:PRF结合颗粒软骨对软骨供区的软骨组织缺损有良好的修复效果,单独置入PRF或颗粒软骨亦较软骨缺损区自行修复效果好。在实验过程中应注意PRF制备工作中要求采血迅速,一旦抽血过程延缓,置入玻璃试管中时血液震荡较多,或是离心不及时等,均会导致制备PRF失败。有时可能需要多次操作才能制备出合格足量的PRF组织,故在制备PRF时注意采血的迅速,在离心过程中注意配平,离心管在离心过程中尽量避免摇晃引起血液凝固。本实验亦存在不足及需进一步研究之处:①颗粒软骨移植有一定的吸收率,本实验观察时间较短,实验标本量较小,无法评估远期移植颗粒软骨吸收情况及缺损面修复效果;②PRF完全取自自体,而个体抽取血液有限,限制了大范围、大面积组织修复的应用;③软骨颗粒原位移植的存活率较异位存活率是否更高;④对于大面积的软骨缺损,如耳再造后肋软骨供区,是否可以直接利用制得的PRF凝胶结合软骨颗粒进行移植以扩大包裹及覆盖面积修复缺损有待进一步研究。希望通过进一步的实验研究,取得更多理论依据的支持,为临床的进一步应用提供参考。
[1]Dohan DM,Choukroun J,Diss A,et al.Platelet-rich fibrin (PRF) :A second generation platelet concentrate.Part I:Technological concepts and evolution[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(3):37-44.
[2]马继光,蔡磊,王克明.自体颗粒肋软骨移植隆鼻的临床应用[J].中华整形外科杂志,2016,32(1):25-28.
[3]荣峥,于智宏,张敬德.自体耳软骨颗粒注射隆鼻的临床应用[J].中国美容医学,2015,24(24):14-16.
[4]Dohan DM,Choukroun J,Diss A,et al.Platelet- rich fibrin(PRF):A second generation platelet concentrate.Part Ⅱ:Platelet-related biologic features[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(3):45-50.
[5]Wakitani S,Goto T,Pineda SJ,et al.Mesenchymal cell based repair of large, full thickness defects of articular cartilage[J].J Bone Joint Surg Am,1994,76(4):579-592.
[6]Kawanabe Y,Nagata S.A new method of costal cartilage harvest for total auricular reconstruction:part I.Avoidance and prevention of intraoperative and postoperative complications and problems[J].Plast Reconstr Surg,2006,117(6):2011-2018.
[7]Fattah A,Sebire NJ,Bulstrode NW.Donor site reconstitution for ear reconstruction [J].J Plast Reconstr Aesthet Surg,2010,63(9):1459-1465.
[8]Dohan Ehrenfest DM,Del Corso M,Diss A,et al.Three dimensional architecture and cell composition of a Choukroun′s platelet-rich fi brin clot and membrane[J].J Periodontol,2010,81(4):546-555.
[9]罗晓丁,李 丹,张剑明.富血小板纤维蛋白促进组织愈合机制的探讨[J].中国口腔种植学杂志,2011,16(4):198-200.
[10] Schar MO,Diaz-Romero J,Kohl S,et al.Platelet-rich concentrates differentially release growth factors and induce cell migration in vitro[J].Clin Orthop Relat Res,2015,473(5):1635-1643.
[11]Marx RE,Carlson ER,Eichstaedt RM,et al.Platelet-rich plasma:Growth factor enhancement of bone grafts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 1998,85(6):638-646.
[12]Choukroun J,Diss A,Simonpieri A,et al.Platelet-rich fi brin(PRF):A second generation platelet concentrate.Part IV:Clinical effects on tissue healing [J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(3):56-60.
[13]Panda S,Doraiswamy J,Malaiappan S,et al. Additive effect of autologous platelet concentrates in treatment of intrabony defects:a systematic review and meta-analysis[J].J Investig Clin Dent,2016,87(2):103-113.
[14]Bahmanpour S,Ghasemi M,Sadeqhi-Naini M,et al.Effects of Platelet-Rich Plasma & Platelet-Rich Fibrin with and without Stromal Cell-Derived Factor-1 on Repairing Full Thickness Cartilage Defects in Knees of Rabbits[J].Iran J Med Sci,2016,41(6):507-517.
[15]张文丽,李淑慧,陈诚.PRF复合自体骨髓间充质干细胞修复兔牙槽骨缺损的研究[J].口腔医学研究,2015,31(4),336-339.
[16]杨勇,杨涛,刘斌,等.自体 ADSCs 复合 PRF 修复家兔耳软骨缺损的实验研究[J].现代生物医学进展,2013,13(12):2210-2214.
[17]Albrecht F,Roessner A,Zimmermann E.Closure of osteochondral lesions using chondral fragments and fi brin adhesive[J].Arch 0rthop Trauma Surg,1983,101(3):213-217.
[18]Frisbie DD,Lu Y,Kawcak CE,et al.In vivo evalution of autologous cartilage fragment loaded scafolds implanted into equine articular defects and compared with autologous chondrocyte implantation[J].Am J Sports Med,2009,37(1):71-80.
[19]Goral A,Aslan C,Kucukzeybek BB,et al.Platelet-rich fi brin improves the viability of diced cartilage grafts in a rabit model[J].Aesthet Surg J,2016,36(4):153-162.
[20]Farr J,Cole BJ,Sheaman S,et a1.Particulated articular cartilage:CAIS and De Novo NT[J].J Knee Surg,2012,25(1):23-29.
[21]廖俊琳,周建大.自体颗粒软骨在鼻整形中的研究应用进展[J].中国美容医学, 2015,24(15):78-81.
[22]Daniel RK.Diced cartilage grafts in rhinoplasty surgery:current techniques and applications[J].Plast Reconstr Surg,2008,122(6):1883-1891.
[23]Chang CS,Bergeron L,Chen PK.Diced cartilage rhinoplasty technique for cleft lip patients[J].Cleft Palate Craniofac J,2011,48(6):663-669.
[24]Bullocks JM,Echo A,Guerra G,et a1.A novel autologous scaffold for diced-cartilage grafts in dorsal augmentation rhinoplasty[J].Aesthetic Plast Surg,2011,35(4):569-579.
