氧化苦参碱对胃癌细胞株SGC-7901增殖的影响
2018-01-11孙衍福王庆才
李 磊 孙衍福 李 帅 王庆才
(1.泰山医学院附属泰山医院消化内一科,山东 泰安 271000; 2. 泰安市中心医院分院,山东 泰安 271000;3.泰山医学院附属莱芜医院,山东 莱芜 271100)
氧化苦参碱对胃癌细胞株SGC-7901增殖的影响
李 磊1孙衍福2李 帅3王庆才1
(1.泰山医学院附属泰山医院消化内一科,山东 泰安 271000; 2. 泰安市中心医院分院,山东 泰安 271000;3.泰山医学院附属莱芜医院,山东 莱芜 271100)
目的 观察氧化苦参碱(OM)对人胃癌SGC-7901细胞中P21表达的影响,研究其抑制细胞增殖的途径。方法 首先在体外进行胃癌细胞SGC-7901的培养, 采用流式细胞仪观察不同浓度(2 mg/ml、3 mg/ml、4 mg/ml )[1]的氧化苦参碱在24 h和36 h不同时间下对SGC-7901胃癌细胞增殖的抑制效果,然后通过Western blot方法观察SGC-7901胃癌细胞内P21基因表达。结果 与对照组相比,不同浓度(2 mg/ml、3 mg/ml、4 mg/ml)OM可使细胞阻滞于G0/G1期[24 h:(67.5±0.1)%,(69.5±1.4)%,(71.0±1.0)% vs. (58.6±0.4)%,P<0.0 5; 36 h:(68.5±0.3)%,(71.9±0.9)%,(78.0±0.4)% vs. (58.8±0.1)%,P<0.05)],上调细胞周期负调控因子P21蛋白表达水平(P<0.05)。结论 OM可能通过阻滞细胞DNA合成,使胃癌细胞处于G0/G1期,并且可以上调P21的表达,从而发挥其抗肿瘤增殖作用。
氧化苦参碱;胃癌;P21;细胞周期;流式细胞术
氧化苦参碱(Oxymatrine,OM)是从中药苦参中提取的一种具有抗病毒和抗纤维化作用的生物碱,能够在患者放化疗后显著提升白细胞水平。近来研究发现,氧化苦参碱对肿瘤细胞有着较好的杀伤效果,同时能够抑制肿瘤细胞的侵袭性,因而目前也广泛应用于临床辅助抗癌药物治疗之中[2]。本实验通过研究氧化苦参碱对于胃癌细胞株SGC-7901增殖的影响,了解其抗肿瘤的作用机制。
1 材料与方法
1.1主要实验试剂
人胃癌细胞株SGC-7901由深圳市白恩维生物科技有限公司提供;氧化苦参碱购自山东华明药业有限公司,生产批号:011230,规格:2 ml/*200 mg。
1.2实验方法
1.2.1细胞培养与增殖
1.2.1.1细胞培养 将人胃癌细胞株SGC-7901从液氮中取出,放置在37 ℃的恒温水浴箱中摇动1~2 min解冻,离心5 min后将上清液倒掉,加入含有10%新生小牛血清的RPMI-1640培养液,制成细胞悬液。在37 ℃ 5% CO2的培养箱中进行培养,24 h后更换培养液。瓶底的细胞数量面积在80%以上时进行传代培养。培养36 h左右时,取处于对数生长期的细胞进行胰酶消化,采用1000 r/min离心,10 min后收集细胞,并利用新的培养液重悬细胞,对细胞计数之后按照每孔1×106的个数分别接种在6孔细胞培养板中,再次将其在同样的环境中培养1夜后,让细胞贴壁备用。
1.2.1.2与氧化苦参碱共孵育 实验设对照组(A1、A2)和实验组(B1、B2、B3、B4、B5、B6),当细胞贴壁后于实验组加入氧化苦参碱溶液,使其终浓度分别为2 mg/ml、2 mg/ml、3 mg/ml、3 mg/ml、4 mg/ml、4 mg/ml,补足体积为220 μl,混匀后放入CO2孵箱中继续培养,分别培养24 h和36 h,收集细胞和上清液。
1.2.2流式细胞术分析
①利用冷PBS对药物处理的细胞进行洗涤,收集细胞;②准备结合缓冲液,并加入双蒸水进行稀释;③取PI工作液加入到结合缓冲液之中,储备待用;④收集细胞,去除上清液后将细胞的浓度调整为1×106/L;⑤将PI工作液加入到细胞悬浊液中,在室温条件下孵育15 min;⑥加入结合缓冲液并轻轻摇匀,把实验用的样本放在冰上面;⑦流式细胞仪进行检测,分析细胞DNA含量。
1.2.3Western blot试验
1.2.3.1细胞蛋白提取 收集不同浓度药物作用的SGC-7901细胞,PBS洗3次之后,将PBS吸收干净,冰上反应30 min将细胞刮净,40 ℃ 12000 r/min离心待测蛋白浓度。在培养皿加入200 μl RIPA裂解液,用枪吹打数下,使裂解液和细胞充分接触,期间多次轻摇培养皿,使其裂解完全,冰上吸上清分装,置于冰箱保存。
1.2.3.2蛋白质浓度测定 将离心待测蛋白加入PBS稀释为浓度5 mg/ml,-20 ℃保存。根据样品的数量来配置适量的BCA工作液,工作液的配置比例为BCA试剂A∶B为50∶1的体积比。分别按照0,1,2,4,8,12,16,20 μl体积的BSA加入到96孔板之中,并用PBS将其分别补足到20 μl。取适当体积的待测样品放置在96孔板之内,同样用PBS将其补足到20 μl,每个样品保持3个平行孔,适当调整样品浓度使其OD值能够满足在标准曲线内。每个孔内都分别加入BCA工作液,37 ℃放置30 min。利用酶标仪562 nm测定OD值,并利用标准曲线计算各个样品蛋白浓度值。最后完成变性及电泳。
1.2.4统计学分析
采用SPSS 19.0软件进行统计分析处理,用均数±标准差来表示实验用的数据,多组间比较采用方差分析,两两比较采用LSD-t检验,同时用Quantity One软件分析Western blot,若P≤0.05,则说明具有统计学意义。
2 结 果
2.1OM使细胞堆积于G0/G1期
氧化苦参碱处理SGC-7901人胃癌细胞24 h后,细胞在G0/G1期所占的百分比提高,而S期和G2/M期的细胞百分比下降,具体如表1所示。
氧化苦参碱处理24 h后,经过统计学方差分析与均数两两比较LSD-t检验分析,实验组与对照组比较,不同浓度的氧化苦参碱对于胃癌SGC-7901细胞的增殖均有明显的抑制作用。G0/G1期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比统计学分析结果分别为:t=1.478,P=0.033;t=1.698,P=0.023;t=1.329,P=0.035;S期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比分别为:t=5.41,P=0.025;t=4.67,P=0.032;t=3.25,P=0.02;G2/M期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比分别为:t=1.35,P=0.03;t=1.59,P=0.04;t=2.58,P=0.01,P均<0.05,结果具有统计学意义。且根据统计学分析显示:OM作用24 h后SGC-7901细胞的细胞周期分布2 mg/ml与3 mg/ml比较结果:t=2.45,P=0.035;t=3.52,P=0.024;t=1.25,P=0.041,OM作用24 h后SGC-7901细胞的细胞周期分布3 mg/ml与4 mg/ml比较结果t=2.53,P=0.015;t=5.22,P=0.034;t=2.58,P=0.022。其中P值均小于0.05,提示伴随氧化苦参碱浓度的增加,使胃癌SGC-7901细胞的细胞周期停滞于G0/G1期的效果越明显。

表1 OM作用24h后SGC-7901细胞的细胞周期分布
氧化苦参碱处理36 h后,经过统计学方差分析与均数两两比较LSD-t检验分析,实验组与对照组相比较,不同浓度的氧化苦参碱对于胃癌SGC-7901细胞的增殖均有明显的抑制作用。G0/G1期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比t检验结果分别为:t=2.63,P=0.024;t=2.33,P=0.014;t=3.12,P=0.012;S期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比分别为:t=1.32,P=0.033;t=5.41,P=0.024;t=3.21,P=0.036;G2/M期:2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组相比分别为t=6.25,P=0.017;t=3.24,P=0.048;t=3.78,P=0.029),P<0.05,结果具有统计学意义。且根据统计学分析显示:OM作用36 h后SGC-7901细胞的细胞周期分布2 mg/ml与3 mg/ml比较结果:t=4.89,P=0.017;t=7.14,P=0.024;t=6.21,P=0.087,OM作用36 h后SGC-7901细胞的细胞周期分布3 mg/ml与4 mg/ml比较结果t=4.21,P=0.019;t=2.14,P=0.022;t=3.78,P=0.048。其中P值均小于0.05,因此提示:伴随氧化苦参碱浓度的增加,使胃癌SGC-7901细胞的细胞周期停滞于G0/G1期的效果越明显。具体数据见表2,图1。

表2 OM作用36h后SGC-7901细胞的细胞周期分布
2.2氧化苦参碱对细胞周期蛋白的影响
通过Western blot法来检测P21蛋白水平,来进一步验证OM对蛋白表达的影响。OM能够使细胞阻滞在G0/G1期,Western blot法检测周期蛋白结果显示,不同浓度的OM作用于胃癌细胞后P21的蛋白含量不同,表明细胞发生了周期阻滞。此外在36 h时P21蛋白含量增加最为明显(P<0.05),见图2。
对Western blot检测法来检测P21蛋白水平进行分析,结果显示,24 h时2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组进行方差分析与均数两两比较LSD-t检验结果分别为:t=5.24,P=0.042;t=7.38,P=0.018;t=1.69,P=0.032;36 h时2 mg/ml、3 mg/ml、4 mg/ml氧化苦参碱与对照组进行t检验结果分别为:t=5.32,P=0.014;t=3.54,P=0.021;t=2.45,P=0.034;P值均小于0.05,差异具有统计学意义,即不同浓度的氧化苦参碱对于胃癌细胞中P21蛋白的表达具有明显的影响。统计学分析结果显示24 h时2 mg/ml、3 mg/ml氧化苦参碱作用下P21蛋白表达情况比较结果分别为:t=5.73,P=0.006;3 mg/ml、4 mg/ml氧化苦参碱作用下P21蛋白表达情况比较结果分别为:t=4.77,P=0.036;36 h时2 mg/ml、3 mg/ml氧化苦参碱作用下P21蛋白表达情况比较结果分别为:t=5.68,P=0.007;3 mg/ml、4 mg/ml氧化苦参碱作用下P21蛋白表达情况比较结果分别为:t=6.72,P=0.023;伴随浓度的增加,胃癌细胞中P21蛋白表达水平越高,且不同浓度作用下24 h和36 h的胃癌细胞中P21蛋白进行t检验分析(t=4.27,P=0.008;t=3.68,P=0.026;t=5.78,P=0.047)P<0.05,结果具统计学意义,故不同时间下,氧化苦参碱对于胃癌细胞P21蛋白的表达水平影响不同,伴随时间的增加氧化苦参碱作用下的P21蛋白表达水平越高。具体如表3。

表3 氧化苦参碱作用下P21蛋白的表达水平
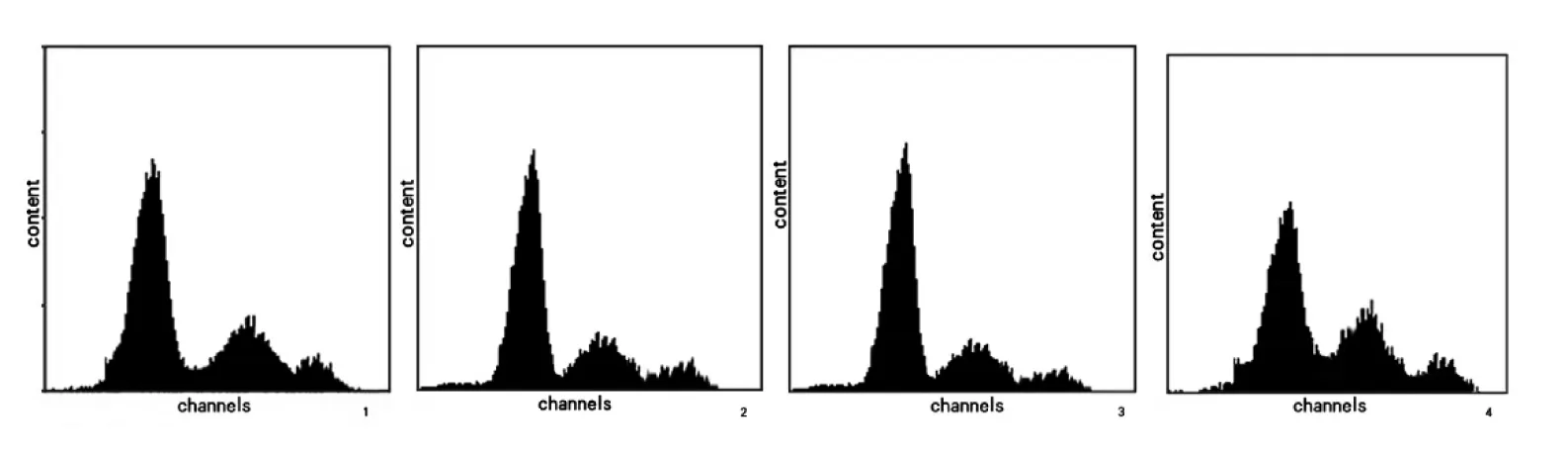
图1 氧化苦参碱对SGC-7901细胞作用36 h后DNA合成的抑制作用
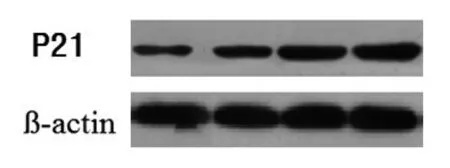
图2 氧化苦参碱对SGC-7901细胞作用36 h后P21蛋白水平
3 讨 论
胃癌目前是全世界范围内最为常见的恶性肿瘤之一,我国则同样是胃癌发病率及病死率最高的国家之一,分别为42%和35%,远远超出世界的平均水平[3]。近年来,胃癌已经逐渐呈现出了年轻化的趋势,目前19~35岁的胃癌年轻患者比例已经上升到了3.3%。为了确保人们的健康,减少胃癌死亡率,迫切需要对胃癌发展的分子机制进行研究,从而寻求抗胃癌药物的新靶点。通过已有的研究发现,OM可以有效抑制肿瘤细胞的增殖和转移,诱导肿瘤细胞分化、凋亡,同时能够提升白细胞,增加免疫活性T细胞,综合提升机体的免疫力[4]。
此次研究利用流式细胞仪来进行细胞周期的检测,从细胞生长增殖的角度来分析OM对其的抑制作用。研究结果显示,经过OM的作用,SCG-7901细胞在G0/G1期的比例增加,S期细胞的比例减少。表明OM对于胃癌细胞的作用主要体现在阻止其G1/S期的生长,抑制其增殖。从分子生物的研究角度来看,细胞的生命周期包含了G0、G1期、S期、G2期和M期,其中,S期是DNA的合成期,G1期是合成前期,G2期是合成后期。从最初的静止状态G0期开始,细胞通过胞质分离和增殖进入到G1期,随后进入到S期进行DNA的复制[5]。细胞染色体复制正确后,则会进入到M期的有丝分裂的准备期G2期,细胞在M期会产生2个稳定遗传的子细胞。当出现细胞周期监测点程序的紊乱,就会出现人体疾病的发生,包括了癌症的发生[6]。细胞生命周期中最为关键的就是DNA的合成期和细胞分裂期[7]。细胞周期的停滞,指的是细胞在受到不利因素的影响时主动停止在某个阶段,从而消除所受到的不利影响[8]。近年来的研究中,使恶性肿瘤细胞周期停滞成为一种新的治疗方式的尝试,高等真核细胞之中,调节细胞周期活动主要依靠于细胞的周期蛋白,细胞周期蛋白和细胞周期分别依赖性激酶CDK和CDI共同作用完成对细胞周期的调控[9]。因而,周期蛋白的异常表达,就会和肿瘤的临床分期、预后、治疗等有着密切的联系[10]。
本次实验通过流式细胞技术和Western bolt方法研究氧化苦参碱对人胃癌SGC-7901细胞P21的影响,发现氧化苦参碱能够上调P21的表达,可以抑制肿瘤细胞的生长,检测到细胞周期停滞及凋亡。研究结果显示随着氧化苦参碱作用时间和剂量的增加,对SGC-7901的抑制作用效果越明显。这是由于氧化苦参碱对细胞凋亡起到诱导作用的同时也会使端粒酶活性下调,且氧化苦参碱浓度越大、作用时间越长,对肿瘤细胞所表现的抑制作用也越明显[11]。提示氧化苦参碱通过上调肿瘤细胞P21基因表达从而实现对其生长的影响,这也为肿瘤治疗的药物靶点研究提供了实验和理论基础[12]。
氧化苦参碱对肿瘤细胞增殖起抑制作用,是通过阻滞于G0/G1期,上调P21阻滞DNA合成。肿瘤细胞蛋白表达的降低和OM对细胞P21转录抑制有一定的关系,随着OM药物剂量的增加,P21表达也会呈现出逐渐上调的趋势。对该现象的产生可以理解为氧化苦参碱对SGC-7901细胞P21表达是从对转录增强开始,进而会在后期出现量的增加及促进。但对于OM对P21的促进是否存在着MAPK通路、ras基因及通路、trans well等方面的影响,则还需要后续的实验研究来探明。
[1] Meyer JM, Silly NP, Dixon CA, et al. Helicopter pylori and duodenal ulcer status post-treatment:a review[J].Helicopter,2001,6(2):84-92.
[2] Warren JR,Marshall BJ.Unidentified curved bacilli on gastric epithelium inactive chronic gastritis[J].Lancet,1983,1(8336):1273-1275.
[3] I J, Black KL, Au JS. Tissue factor pathway inhibitor-2 suppresses the production of active matrix metalloproteinase-2 and is down-regulated in cells harboring activated as oncogenes[J]. FEBS Left,2000, 481:31-36.
[4] Saki M. The cell surface: the stage for matrix gastrointestinal regulation of migration [J]. Burr O pin Cell Biol,2002, 14:624-632.
[5] Overall CM, Interlope C. Strategies for MMP inhibition in cancer:innovations for the post-trial era[J]. Nat Rev Cancer,2002,2:657-672.
[6] Upanishads CG, Van Meir EG. Brain cancer propagating cells:biology,genetics and targeted therapies. Trends Col Med,2009,15(11):519-530.
[7] Blagged M, Brewer Z. New functions for the matrix gastrointestinal in cancer progression[J]. Nat Rev Cancer,2002,2:163-175.
[8] Nebraska E,Manageress S, Zanuck W, et al. Prophylaxis in a patient with end-stage renal disease in the course of systemic lupus Eratosthenes, diagnostic problems-case report[J].Pol Mercury Bearskin, 2009, 27(158):123-128.
[9] Nanak E, Park K, Yamagata T, et al.Enhanced MDR1expression nonresistance of cancer stem cells derived from globalist[J]. Cancer Invest, 2009, 27(9):901-908.
[10] Rolaids GB, Scott JN, Blantyre JB, et al. Population-basedstudy progressiveness after chemoradiotherapy in GBM[J]. Can J Neural Sci, 2009, 36(5):617-622.
[11] Bad CE, Biers JM, Jonathon LA, et al. Real-time monitoring of nuclear factor kappa activity in cultured cells and in animal models[J]. Col Imaging, 2009, 8(5): 278-290.
[12] CAI R, Ding X, Chou K, et al. Blockade of TRPC6 channels induced G2/M phase arrest and suppressed growth in human gastric cancer cells[J]. Int J Cancer, 2009,125(10):2281-2287.
Effects of Oxymatrine on the expression of P21 in human gastric cancer cell line SGC-7901
LI Lei1SUN Yan-fu2LI Shuai3WANGQing-cai1
(1.Dept. of Gastroenterology, Taian City Central Hospital,Taian 271000,China;2.Taian Central Hospital branch Hospital, Taian 271000,China; 3.Laiwu People's Hospital,Laiwu 271100,China)
Objective:To investigate the effects of Oxymatrine (OM) on the expression of P21 in human gastric cancer cell line SGC-7901 and the mechanism of inhibiting the proliferation of human gastric cancer cells. Methods:Gastric cancer cell line SGC-7901 was cultured in vitro. Flow cytometry was used to observ.e the inhibitory effects of Oxymatrine(2mg/ml、3mg/ml、4mg/ml) on the proliferation of SGC-7901 gastric cancer cells at different time of 24h and 36h. The expression of P21 gene in gastric cancer cell line SGC-7901 was observed by Western blot methods. Results: Compared with the control group, different concentration (2mg/ml、3mg/ml、4mg/ml) OM to cell cycle arrest in G1/G0 phase [24 h:(67.5±0.1)%,(69.5±1.4)%,(71.0±1.0)% vs. (58.6±0.4)%,P<0.0 5; 36 h:(68.5±0.3)%,(71.9±0.9)%,(78.0±0.4)% vs. (58.8±0.1)%,P<0.05)], the expression level of up regulation of cell cycle negative regulatory factor P21 (P<0.05). Conclusion: OM may play a novel role in anti-tumor effect by blocking the cell DNA synthesis, and can up regulate the expression of P21 in G1/G0 phase of in gastric cancer cells.
Oxymatrine;gastric cancer;P21;cell cycle;flow cytometry.
李磊(1979—),男,山东泰安人,副主任医师,博士,主要从事消化系统基础和临床研究。
R735.2
A
1004-7115(2018)01-0006-04
10.3969/j.issn.1004-7115.2018.01.002
2017-11-05)
