子宫内膜腺癌GPR30和p-ERK1/2的表达及意义*
2018-01-11辛卫娟
赵 婧 辛卫娟 李 平
(1.同济大学附属第一妇婴保健院妇产科,上海 201204; 2. 复旦大学附属妇产科医院妇产科, 上海 200032;3.东营市第二人民医院,山东 东营 257300)
子宫内膜腺癌GPR30和p-ERK1/2的表达及意义*
赵 婧1辛卫娟2李 平3
(1.同济大学附属第一妇婴保健院妇产科,上海 201204; 2. 复旦大学附属妇产科医院妇产科, 上海 200032;3.东营市第二人民医院,山东 东营 257300)
目的 探讨G蛋白偶联雌激素受体30(GPR30)及细胞外信号调控激酶1/2(p-ERK1/2)在子宫内膜腺癌中的表达及意义,并探讨其在子宫内膜腺癌发病机制中的作用。方法 用免疫组化SP法检测22例子宫内膜腺癌(endometrioid endometrial cancer,EEC)组织、20例非典型增生子宫内膜(endometrial atypical hyper- plasia,EAH)组织和20例正常子宫内膜组织中GPR30和p-ERK1/2的表达,对标本的染色情况做半定量分析。结果 (1)GPR30在增生期子宫内膜、EAH、EEC三组中的阳性表达率分别为15.0% (3/20)、 40.0% (8/20)、72.7%(16/22) 。EEC组与前二者比较,GPR30阳性表达率均显著升高,差异有统计学意义(P<0.05);EAH组GPR30阳性表达率也明显高于正常组,差异有统计学意义(P<0.05)。 EAH组中轻中度非典型增生表达率25.0%(3/12),重度非典型增生表达率为62.5%(5/8),轻中度非典型增生和重度非典型增生间差异不具有统计学意义(P>0.05)。子宫内膜癌的不同肌层浸润深度间,GPR30表达有显著差异,肌层浸润深度越深,阳性表达率越高(P<0.05), GPR30的表达与其他临床病理参数无关(均P>0.05)。(2)p-ERK1/2蛋白在正常子宫内膜组、EAH组和EEC组中的表达率分别为30.0% (6/20)、65.0% (13/20)、45.5% (10/22),EAH组与正常组相比p-ERK1/2阳性表达率升高,差异有统计学意义(P<0.05);而EEC组中表达强度中等,与前二者比较,差异无统计学意义(P>0 .05)。p-ERK1/2表达与临床病理参数无关(均P>0.05)。结论 GPR30可能通过p-ERK1 /2信号通路发挥其在子宫内膜腺癌中的调控作用。
子宫内膜腺癌;G蛋白偶联雌激素受体30; 细胞外信号调控激酶1/2;免疫组化
子宫内膜癌(EC)是女性生殖道常见恶性肿瘤[1]。72%的子宫内膜癌在I~II期被诊断,但是仍有28%的患者在发生局部或远处转移后才被诊断(III期患者约20%,IV期患者约8%)[2]。在子宫内膜癌中,子宫内膜样腺癌(EEC)是最主要的类型,占80%~90%。长期无孕酮拮抗的雌激素刺激可能是其发病的主要因素。最新研究证实人类乳腺癌细胞膜上存在一种新型7-跨膜G蛋白偶联雌激素受体GPR30,可以快速与微量雌激素结合,激活细胞内第二信使,活化丝裂原活化蛋白激酶(mitogen-activated protein kinases ,MAPK),此过程比经典的ERα转导快几十倍[3],属于快速非基因组转导[4]。通过快速“非核效应”雌激素可与GPR30快速结合,激活跨膜信号转导系统。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是MAPK家族的一个亚族,该信号传导通路的过度活化和肿瘤的发生密切相关[5]。ERK1和ERK2是ERK的两个重要成员,参与调节细胞的增殖、分化以及多种代谢功能。ERK1/2可被多种生长因子等有丝分裂原激活,促进多种癌基因及细胞周期调节相关基因的转录与表达,进而促进肿瘤细胞增殖,抑制细胞凋亡[6]。磷酸化的ERK(p-ERK)是其活化形式, p-ERK1/2进入细胞核后,可以启动一些原癌基因的表达如c-jun、c-fos和c-myc等,促使细胞由G1期向S期转化,最终导致细胞恶性增殖。Acconcia等[7]在雌激素和他莫昔芬(TAM)诱导子宫内膜癌细胞支架重塑和迁移的研究中发现,雌二醇(E2)和4-羟三苯氧胺(4-OHT)可以快速激活ERK1/2、C-Srk、黏着斑激酶(FAK)通路,从而引起内膜癌细胞支架改变,促进细胞的迁移和浸润。雌激素和GPR30结合后通过下游分子Src、Raf、Ras、Mek级联反应快速激活ERK,促进细胞增生并延长细胞生长周期。Filardo等[8]研究发现,在GPR30表达阳性的MCF-7乳腺癌细胞中雌激素可激活ERK,而在缺乏GPR30的MDA-MB-231乳腺癌细胞中雌激素则不能激活ERK,但在MDA-MB-231乳腺癌细胞中转染GPR30后,雌激素可激活ERK。由此可以证明GPR30在ERK/MAPK信号途径中发挥着重要的作用。
基于以上研究,本实验将通过免疫组化的方法检测GPR30及MAPK信号通路中活化的p-ERK1/2在正常子宫内膜、非典型增生子宫内膜和子宫内膜腺癌组织中的表达情况,探讨GPR30在子宫内膜腺癌发病机制中的作用及GPR30参与雌激素“非核效应”调节的信号通路机制,为临床上寻找子宫内膜腺癌治疗的新靶点提供理论依据。
1 资料与方法
1.1临床资料 子宫内膜标本分为三组。收集同济大学附属东方医院病理科2009年1月—2012年2月手术的子宫内膜癌手术切除的石蜡组织标本22份。患者年龄46~68岁、中位年龄55.0岁。病理类型均为EEC。采用FIGO新的分级方法,高分化(Gl)5例、中分化(G2)12例、低分化(G3)5例。收集同期子宫内膜非典型增生(EAH)组织20份,患者年龄40~56岁、中位年龄47.5岁。选取正常子宫内膜组织20份作为对照组,年龄40~61岁、中位年龄48.5岁,来源于因子宫良性疾病行子宫切除术后证实子宫内膜正常者。患者术前均未行化疗、放疗或激素治疗。三组年龄有可比性。
1.2子宫内膜组织GPR30和p-ERK1/2表达的检测 采用免疫组化SP法。具体步骤按照说明书进行,抗原修复方法均为微波修复。每组实验均设阳性对照和阴性对照,用已知阳性片作阳性对照,PBS代替一抗作阴性对照。兔抗人 GPR30 多克隆抗体(ab98075)购于美国 Abcam 公司,抗体工作浓度 为1∶50。兔抗人 p-ERK1/2多克隆抗体(BS4621)购于美国Bioworld公司,抗体工作浓度 为1∶50。HRP标记山羊抗兔二抗(111-035-003)购于美国Jackson公司,免疫组化试剂盒(SP9001)和DAB显色剂购于北京中杉金桥生物技术有限公司。
1.3结果判定方法 光镜下,GPR30表达定位于细胞胞浆及胞膜,p-ERK1/2表达主要位于细胞质中,少数位于细胞核中,均为棕黄色或褐色颗粒。细胞计数采用双盲法,每张切片高倍镜(×400)下随机选择6个视野,计算阳性细胞百分率。参照文献[9]所推荐ER免疫组化评分系统,据染色程度及阳性细胞数计算评分:①染色程度:全部细胞阴性(-)为0分,染色细胞弱阳性(+)为1分,中等阳性(++)2分,强阳性(+++)3分;②阳性细胞数:着色强度高于背景非特异性染色者为阳性。随机选取肿瘤细胞分布密集区域的6个高倍视野进行计数,至少计数100个肿瘤细胞,观察其阳性表达情况。阳性表达率<1%为1分,1%~10%为2分,11%~33%为3 分,34%~66%为4分,67%~100%为5分。①、②之和5~8分者定为抗原表达阳性,否则为阴性。每张切片由两名病理医师分别评分,两者不一致时重新评估。
1.4统计学方法 采用SPSS17.0统计软件。计数资料以率表示,比较采用多个样本率比较的χ2检验及校正的χ2检验。相关性分析用等级资料Spearman秩相关,以r=0.05作为判断相关性的标准。P≤0.05为有统计学意义。
2 结 果
2.1GPR30和p-ERK1/2 在不同子宫内膜组织中的表达情况 在EEC组织中,GPR30表达定位于子宫内膜癌细胞的胞浆及胞膜,表达较强,呈棕黄色,阳性细胞较多;在EAH组织中,GPR30表达位于子宫内膜异型细胞的胞浆与胞膜,以胞浆着色为主,表达强度中等;在正常子宫内膜组织中GPR30有较弱的表达,呈浅黄色,以胞浆表达为主(见图1)。GPR30蛋白在增生期子宫内膜、非典型增生子宫内膜(EAH)、子宫内膜腺癌(EEC)中的阳性表达率分别为15. 0% (3/20)、 40.0% (8/20)、72.7%(16/22) ,呈逐渐增高趋势。EEC组与前二者比较,GPR30阳性表达率均显著升高,差异有统计学意义(P<0.05);EAH组GPR30阳性表达率也明显高于正常组,差异有统计学意义(P<0.05)(见表1)。
在正常子宫内膜组织中,可见有较弱的p-ERK1/2表达,呈浅黄色,以胞质表达为主;而非典型增生子宫内膜组织中p-ERK1/2蛋白阳性信号显著增强,多呈棕黄色、棕褐色,可见胞质及胞核阳性;子宫内膜癌中p-ERK1/2的表达位于细胞核及细胞质,但主要位于细胞核中,呈棕黄色颗粒,灶状或散在分布,而正常子宫内膜组织中,胞质、胞核均不着色(见图2)。p-ERK1/2蛋白在正常子宫内膜组织、EAH组织和EEC组织中的表达率分别为30.0% (6/20)、65.0% (13/20)、45.5% (10/22)。正常子宫内膜中,p-ERK1/2虽呈一定数量的表达,但均为低表达;EAH组p-ERK1/2表达显著增强,与正常组相比阳性表达率升高,差异有统计学意义(P<0.05);而EEC组中p-ERK1/2表达强度中等,与前二者比较,差异无统计学意义(P>0.05)(见表1)。
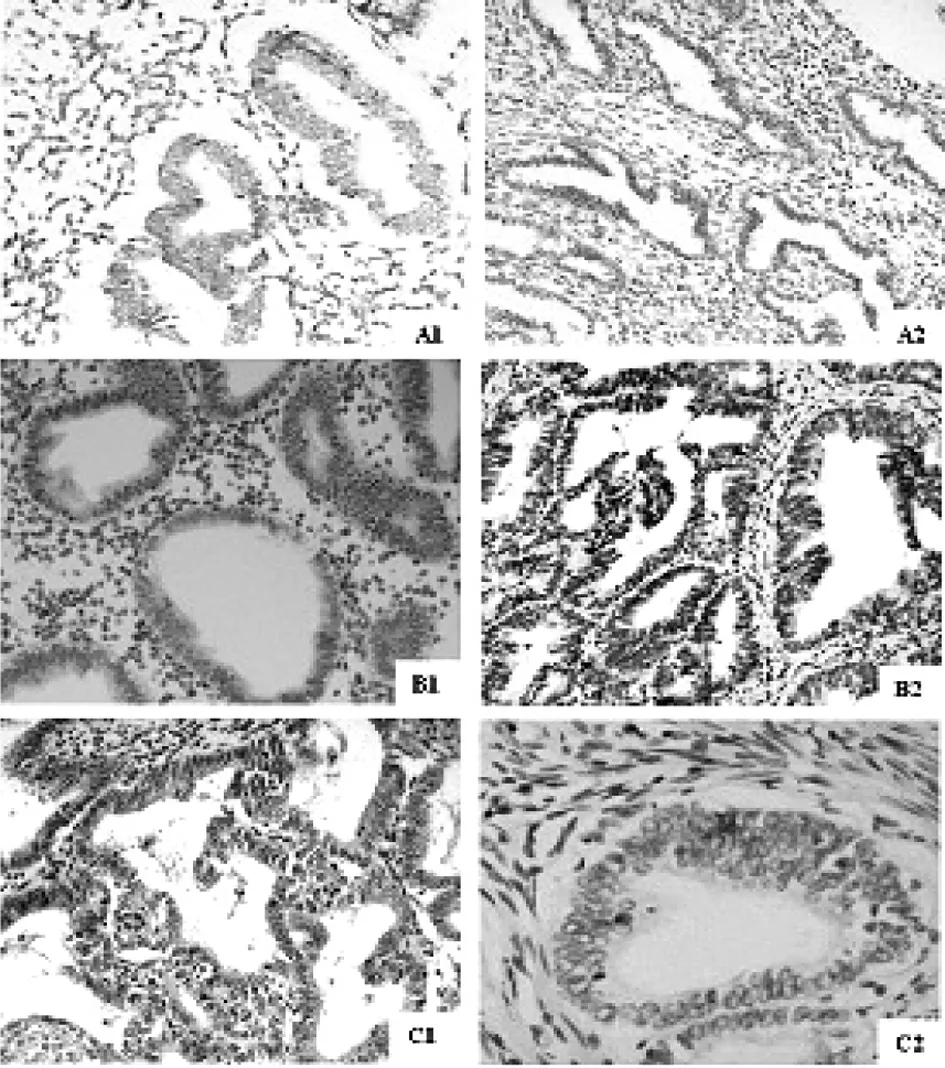
图1 GPR30在子宫内膜组织中的表达(×20)
A:正常子宫内膜组织 A1:GPR30阳性表达,A2:GPR30阴性表达;B:子宫内膜非典型增生组织 B1:GPR30阳性表达,B2:GPR30阴性表达;C:子宫内膜癌组织 C1:GPR30阳性表达,C2:GPR30阴性表达

图2 p-ERK1/2在子宫内膜组织中的表达(×20)
A:正常子宫内膜组织 A1:p-ERK1/2阳性表达,A2:p-ERK1/2阴性表达;B:子宫内膜非典型增生组织 B1:p-ERK1/2阳性表达,B2:p-ERK1/2阴性表达;C:子宫内膜腺癌组织 C1:p-ERK1/2阳性表达,C2:p-ERK1/2阴性表达
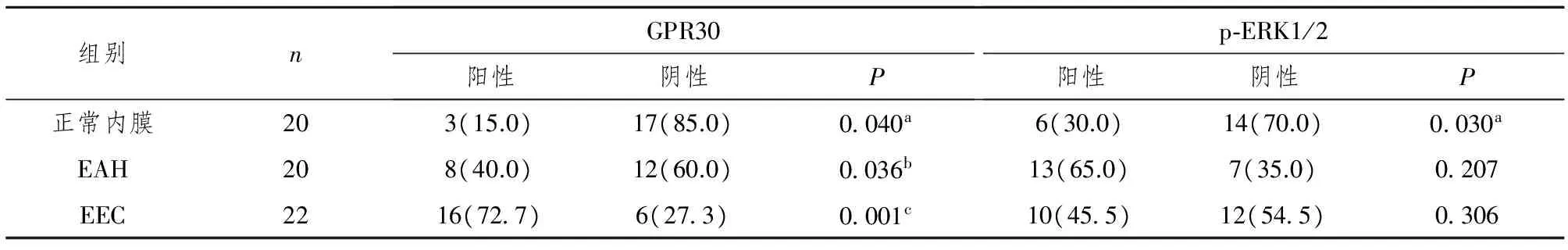
表1 GPR30和p-ERK1/2在不同子宫内膜组织中的表达情况[n (%)]
注:EAH组与正常对照组比较,aP<0.05;EEC组与EAH组比较,bP<0.05;EEC组与正常对照组比较,cP<0.05。
2.2GPR30和p-ERK1/2的表达与子宫内膜腺癌临床病理参数的关系 分析GPR30的表达与临床资料后发现,子宫内膜癌的不同肌层浸润深度中,GPR30表达有显著差异,肌层浸润深度越深,阳性表达率越高(Spearman相关分析,P=0.003), 余均无统计学意义(P>0.05)。而p-ERK1/2的表达与各临床病理指标均无相关性(见表2)。

表2 GPR30和p-ERK1/2表达与肿瘤临床病理指标的关系[n (%)]
注:Spearman相关性分析,*P<0.05。
3 讨 论
GPR30为雌激素功能性膜受体[10-12]。GPR30介导的雌激素非基因组信号广泛参与机体的生理病理过程,在卵泡发育、肾上腺发育、肝损伤保护等过程中发挥重要作用,参与细胞的增殖调控,重要的是, GPR30参与肿瘤的发生发展。E2和GPR30的选择性激动剂G1均能激活,促进卵巢癌、甲状腺癌细胞增殖。E2和GPR30结合后,使GPR30的G蛋白活化,进而激活细胞内的信号级联通路,促进Ca2+内流, cAMP、磷脂酰肌醇生成,激活丝裂原活化蛋白激酶ERK1/2,启动基因转录和调控,发挥经典雌激素核受体非依赖的快速非基因组效应[13-14]。因此,我们推测GPR30可能通过激活MAPK途径,从而在子宫内膜癌的发生发展中发挥重要的作用。本实验的研究结果显示,GPR30主要表达在腺上皮的细胞浆中和胞膜上。其在正常子宫内膜组织和子宫内膜非典型增生中不表达或中低表达,少数为高表达;而在子宫内膜癌中多为中高表达,子宫内膜腺癌患者的GPR30表达显著高于正常子宫内膜组和子宫内膜非典型增生组(P<0.05),同时子宫内膜非典型增生组的表达也高于正常组(P<0.05),与国内外报道结果相似。我们研究表明在正常子宫内膜组织—非典型增生—子宫内膜癌的动态演变过程中GPR30表达渐进性增强,说明GPR30可能在雌激素刺激子宫内膜癌变的过程中起重要作用,GPR30高表达的患者,微量的雌激素与之结合就能产生高效快速的非基因组效应,继而有可能通过各种途径持续刺激子宫内膜过度增生,甚至发生癌变。在GPR30表达与子宫内膜腺癌临床病理参数关系的研究中发现,GPR30表达与肌层浸润程度存在显著相关(P<0.05),随着肌层浸润深度加深,阳性表达率越高,表明其与子宫内膜腺癌的肿瘤侵袭过程有密切关系;进一步分析发现,GPR30表达与肿瘤的 FIGO 分期、组织分化程度、淋巴结转移情况并无明显关联(P>0.05),与Smith等研究结果不同,但与多数研究报道相近[15],这说明GPR30或许并不直接参与肿瘤转移等生物学行为的过程。至此,能基本推断GPR30表达在子宫内膜腺癌的发生发展过程中可能起到重大作用,从侧面说明GPR30参与介导雌激素激活的一系列信号转导反应可能是肿瘤增殖和进展中的关键途径之一[16],但其复杂机制有待继续研究和阐明。
ERK1 /2信号通路是否参与了子宫内膜恶变过程 ,信号通路异常激活与“高危” 子宫内膜癌是否存在关联性,目前对于该通路在子宫内膜癌发生发展中的报道较少,且研究结果也不尽相同。有研究认为雌激素能通过非基因转录效应迅速激活 MAPK/ERK1 /2 信号传导通路, 使p-ERK表达增加,刺激细胞增殖,抑制其凋亡,并参与子宫内膜癌的发生发展。本研究显示,p-ERK1/2 在 20 例正常子宫内膜、20 例增生过长子宫内膜和22 例子宫内膜癌中表达率分别为 30.0%、65.0%和 45.5%,在正常子宫内膜组织中呈中低表达,说明ERK途径在此阶段仍为其正常生理调控状态。子宫内膜非典型增生组的表达率较正常组显著升高,差异有统计学意义(P<0.05)。提示在从正常子宫内膜到非典型增生过程中, ERK1/2异常激活,可能引起细胞增殖失控,促进细胞向非典型增生进展。与在乳腺癌及结肠癌中报道的p-ERK1/2高表达不同的是[17],在本实验中EEC组p-ERK1/2呈中低表达(45.5%),较EAH组(65.0%)表达下降,但两者无明显差异(P>0.05),且EEC组p-ERK1/2表达与正常内膜组织p-ERK1/2表达(30.0%)无显著性差异(P>0.05)。Desouki 等认为子宫内膜癌中活化形式的ERK含量升高可能与子宫内膜抵抗他莫西芬抗雌激素的机制有关,而与子宫内膜癌进展过程无关。但也有研究报道雌激素能通过非基因转录效应迅速激活 MAPK/ERK信号传导通路,使 p-ERK1/2 表达增加,刺激细胞增殖,抑制其凋亡,并参与子宫内膜癌的发生发展。我们推测ERK1/2在子宫内膜非典型增生及子宫内膜癌变中可能存在有两种不同的信号调节机制,即在非典型增生中ERK1/2异常激活,促进细胞向非典型增生进展,当其表达到一定程度时可能具有某种负反馈调节机制导致不可逆转的恶性过程,造成EEC组p-ERK1/2表达下降。ERK1/2信号通路可能是参与子宫内膜癌细胞调控的信号通路之一,但并非像在乳腺癌中那样,出现非激素依赖性异常激活。本实验p-ERK1/2 的表达与临床病理参数间的关系表明,在子宫内膜癌中p-ERK1/2 的表达与年龄、绝经、肿瘤的 FIGO 分期、组织分化程度、肌层浸润深度、有无淋巴结转移等均无明显的相关性,与Mizumoto等类似,我们推测ERK1/2 信号通路的活化可能不直接参与子宫内膜癌的发展。
体外实验认为GPR30能介导雌激素快速激活ER阳性及ER阴性的子宫内膜癌细胞系内的MAPK/Erk1/2信号转导通路[18]。二者在子宫内膜癌中相互作用的具体机制还有待进一步揭示。研究GPR30与p-ERK1/2的关系有可能为子宫内膜腺癌的治疗提供新靶点。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2013,63(1):11-30.
[2] De Souza Nunes LS, De Oliveira RV, Holgado LA, et al. Use of bovine hydroxyapatite with or without biomembrane in sinus lift in rabbits: histopathologic analysis and immune expression of core binding factor 1 and vascular endothelium growth factor[J]. Oral Maxillofac Surg, 2011,69(4):1064-1069.
[3] Thomas P, Pang Y, Filardo E.J, et al. Identity of an estrogen membrane receptor coupled to a G-protein in human breast cancer cells[J]. Endocrinology,2005,146:624-632.
[4] Boonyaratanakornkit V, Edwards DP. Receptor mechanisms of rapid extranuclear signaling intiated by steroid hormones[J]. Essays Biochem,2004,40:105-120.
[5] Ajenjo N, Aaronson DS, Ceballos E, et al. Myeloid leukemia cell growth and differentiation are independent of mitogen-activated protein kinase ERK1/2 activation[J].J Biol Chem,2000,275:7189-7197.
[6] Rice PL, Goldberg RJ, Ray EC, et al. Inhibition of extracellular signal-regulated kinase1/2 phosphorylation and induction of apotosis by sulindac metabolites[J].Cancer Res,2001,61:1541-1547.
[7] Acconcia F, Barnes CJ, Kumar R. Estrogen and tamoxifen induce cytoskeletal remodeling and migration in endometrial cancer cells[J].Endocrinology,2006,147(3):1203-1212.
[8] Filardo EJ, Graeber CT, Quinn JA, et al. Distribution of GPR30,a seven membrane-spanning estrogen receptor,in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J].Clin Cancer Res,2006,12(21):6359-6366.
[9] Leake R, Barnes D, Pinder S, et al. Immunohistochemical detection of steroid receptors in breast cancer: a working protocol. UK Receptor Group, UK NEQAS,The Scottish Breast Cancer Pathology Group, and The Receptor and Biomarker Study Group of the EORTC[J]. J Clin Pathol, 2000, 53:634-635.
[10] Lapensee EW, Tuttle TR, Fox SR, et al. Bisphenol A at low nanomolar doses confers chemoresistance in estrogen receptor-alpha-positive and -negative breast cancer cells[J]. Environ Health Perspect, 2009, 117(2): 175-180.
[11] Filardo E, Quinn J, Pang Y, et al. Activation of the novel estrogen receptor G protein-coupled receptor 30(GPR30) at the plasma membrane [J]. Endoerinology, 2007, 148(7):3236-3245.
[12] Revankar CM, Cimino DF, Sklar LA, et al. A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J]. Science, 2005, 307: 1625-1630.
[13] Prossnitz ER, Arterburn JB, SmithHO, et al. Estrogen signaling through the transmembrane G protein-Coupled receptorGPR30[J].Annu Rev Physiol, 2008, 70: 165-190.
[14] Prossnitz ER, Arterburn JB, Sklar LA. GPR30: A G protein-coupled receptor for estrogen[J].Mol Cell Endocrinol,2007,265-266:138-142.
[15] He YY, Cai B, Yang YX, et al. The signaling of estrogen transmembrane receptor-GPR30 via ERK/MAPK pathway is involved in the carcinogenesis of ER negative endometrial carcinoma by promoting proliferation,IL-6 secretion and invasion potential[C].China International Congress of Gynecological Oncology,Beijing,2008.
[16] Maggiolini M, Picard D. The unfolding stories of GPR30,a new membrane-bound estrogen receptor[J].J Endoerinol,2010,204(2):105-114.
[17] Sebolt-Leopold JS, Herrera R. Targeting the mitogen-activated p rotein kinase cascade to treat cancer [J]. Nat Rev Cancer, 2004, 4(12):937-947.
[18] Yin-Yan He, Bin Cai, Yi-Xia Yang, et al. Blackwell Publishing Asia Estrogenic G protein-coupled receptor 30 signaling is involved in regulation of endometrial carcinoma by promoting proliferation, invasion potential, and interleukin-6 secretion via the MEK/ERK mitogen-activated protein kinase pathway[J].Cancer Sci,2009,100(6):1051-1061.
The expression and significance of GPR30 and p-ERK1 / 2 in endometrial adenocarcinoma
ZHAO Jing1XIN Wei-juan2LI Ping3
(1.Dept. of Obstetrics and Gynecology, First Affiliated Maternity and Infant Hospital, Tongji University, Shanghai 201204, China; 2.Dept. of Obstetrics and Gynecology, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200032, China; 3. Second People's Hospital of Dongying, Dongying 257300, China)
Objective:To explore the expressions and effects of GPR30 and p-ERK1/2 in endometrioid endometrial cancer.Methods: Expression of GPR30 and p-ERK1/2 in 22 cases of endometrioid endometrial cancer (EEC), 20 cases of atypical hyperplasia endometrium(EAH) and 20 cases of normal endometrium were detected by Immunohistochemistry SP method. Results: ① The positive rates of GPR30 expression were 15.0%(3/20), 40.0%(8/20), 72.7%(16/22) in normal endometrium, EAH and EEC. Compared with the others, there was statistical difference (P<0.05), for the positive rate of GPR30 increased obviously in EEC group. As it is the same as the above, the positive rate of GPR30 in EAH group was higher than the normal group. There were great differences between the expressions of GPR30 in different depths of myometrial invasion of EEC. The positive rate was higher in the deeper myometrial invasion (P<0.05). It was not related with other clinicopathological characteristics (P>0.05).②The expressions of p-ERK1/2 expression were 30.0%(6/20), 65.0%(13/20), 45.5%(10/22) in normal group, EAH group and EEC group. The expression in EAH group was higher than normal group, which had statistical difference (P<0.05). And the expression in EEC group was in the middle without significant difference (P>0.05). It was not related with clinicopathological characteristics (P>0.05) .Conclusion: GPR30 may exert its function in endometrioid endometrial cancer by regulating the expression of p-ERK1/2 gene.
endometrioid endometrial cancer;G protein-coupled estrogen receptor;extracellular signal regulated kinase1/2;immunohistochemistry
上海市卫生系统优秀人才培养计划(部分)(XYQ2011054)。
赵婧 (1982—),女,主治医师,主要从事妇科肿瘤工作。
李平。
R737.33
A
1004-7115(2018)01-0001-05
10.3969/j.issn.1004-7115.2018.01.001
2017-10-10)
