MTDH、Tmem16a在脉络膜黑色素瘤中的表达及意义
2018-01-11
脉络膜黑色素瘤属于临床一种较为常见的恶性肿瘤, 此类肿瘤细胞一旦进行巩膜侵犯或远处转移,则患者预后不理想[1]。相关资料显示[2,3],脉络膜黑色素瘤的发生机制较为复杂,涉及到基因变异等多种因素的影响。异粘蛋白(metadherin,MTDH)和跨膜蛋白16a (transmembrane protein16a,Tmem16a)自发现以来日益受到人们的关注及重视,其积极参与肿瘤细胞增殖和凋亡等多种活动,与肿瘤进展密切相关[4]。研究证实[5-8],MTDH、Tmem16a在胃癌、肝癌等多种恶性肿瘤组织中可检测到存在异常表达,但是在脉络膜黑色素瘤中的表达情况国内尚无资料显示。本研究探讨MTDH和Tmem16a在脉络膜黑色素瘤中的表达及临床意义,以期为临床治疗此类疾病提供有价值的参考。
资料与方法
一、一般资料
选择25例(25只眼)确诊的脉络膜黑色素瘤术后组织为实验组, 另取瘤旁正常脉络膜组织15例(15只眼)作为对照组。脉络膜黑色素瘤25例中,男性13例,女性12例;年龄30~78岁,平均年龄(63.7±2.1)岁。所有标本组织均经病理检查确诊。
二、方法
采用免疫组化方法(SP法)测定两组标本组织中MTDH、Tmem16a蛋白表达水平,标本组织经石蜡包埋、切片之后,按照SP相关试剂盒上的说明书操作。采用已知显色阳性的脉络膜黑色素瘤切片作为阳性对照, 以PBS代替一抗作为阴性对照。
三、结果判定
参考文献[9]的方法判断MTDH、Tmem16a的阳性表达结果。呈棕色着色为MTDH、Tmem16a阳性表达。
四、统计学方法
数据采用SPSS 21.0统计分析,采用t检验或卡方检验,相关分析采用Pearson 直线相关,P<0.05为差异具有统计学意义。
结 果
一、不同标本组织 MTDH、Tmem16a 阳性表达情况比较
MTDH、Tmem16a蛋白表达产物均呈棕色,见图1,2。实验组MTDH、Tmem16a阳性表达率分别为60%、52% ,均明显高于对照组(P<0.05),见表1,2。
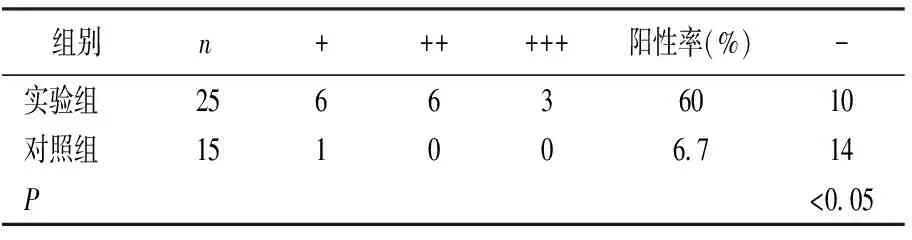
表1 不同标本组织 MTDH阳性表达情况比较(例)
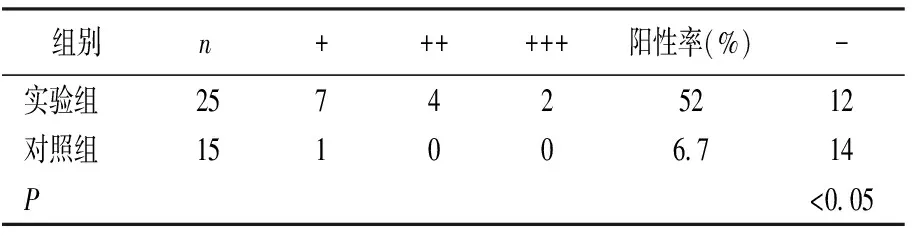
表2 不同标本组织Tmem16a 阳性表达情况比较(例)
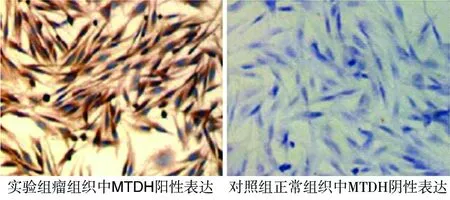
图1 MTDH蛋白在不同标本组织中的表达(200×)
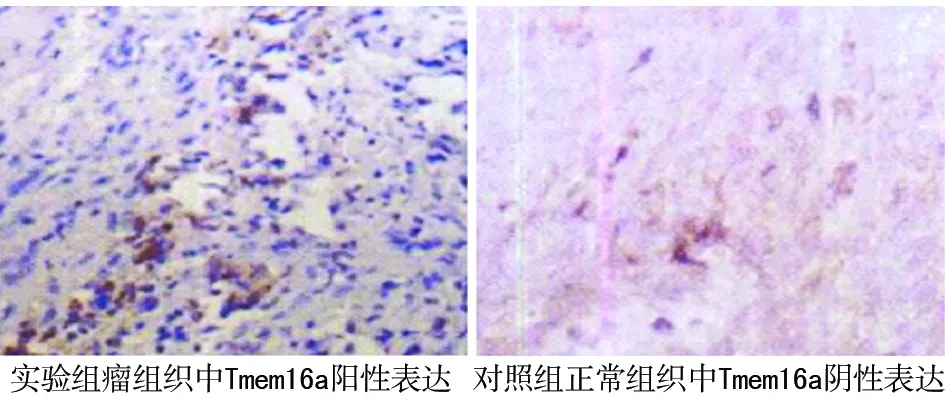
图2 Tmem16a蛋白在不同标本组织中的表达(200×)
二、MTDH、Tmem16a蛋白表达与患者临床病理特征的关系
MTDH、Tmem16a蛋白表达与脉络膜恶性黑色素瘤巩膜浸润程度及远处转移相关(P<0.05);与年龄、性别、肿瘤大小无关(P>0.05),见表3。
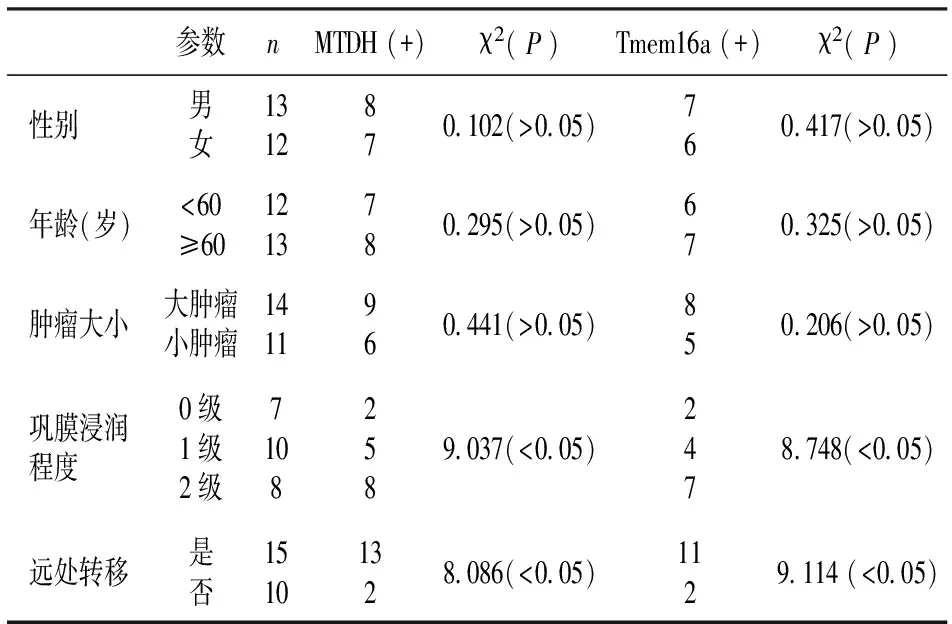
表3 MTDH、Tmem16a蛋白表达与患者临床病理特征的关系(n=25)
讨 论
脉络膜黑色素瘤属于一种恶性程度高、容易血行转移,预后较差的眼内恶性肿瘤。研究证实基因突变、发病年龄、肿瘤大小、巩膜浸润深度、远处转移等多种因素与脉络膜黑色素瘤预后密切相关[10-12]。相关资料显示[13,14],MTDH 在乳腺癌、结直肠癌等多种肿瘤中存在异常表达,参与此类肿瘤的演进。MTDH 基因能够激活PI3K/Akt等多种信号转导通路,以改变如c-Myc等致癌基因的表达水平;进而促进癌细胞发生浸润及新生血管的生成。
本研究结果显示,实验组MTDH阳性表达率为60% ,明显高于对照组正常脉络膜组织(P<0.05),其表达与脉络膜恶性黑色素瘤巩膜浸润程度及远处转移相关(P<0.05);与年龄、性别、肿瘤大小无关(P>0.05)。提示其与脉络膜恶性黑色素瘤患者预后相关,可作为此类患者预后预测的评价指标。原因可能是MTDH异常表达可以激活PI3K/Akt信号转导通路,上调基质金属蛋白酶-2 等致癌基因的表达,促进脉络膜恶性黑色素瘤组织浸润及转移。
新近发现的Tmem16a属于一种新的钙离子激活的跨膜氯离子通道家族成员,其在膀胱癌、肝癌及乳腺癌等一些恶性肿瘤中存在高表达[15]。本研究结果显示,实验组Tmem16a阳性表达率为52% ,明显高于对照组正常脉络膜组织(P<0.05)。Tmem16a蛋白表达与脉络膜恶性黑色素瘤患者巩膜浸润程度及远处转移相关(P<0.05);与年龄、性别、肿瘤大小无关(P>0.05)。可以推测Tmem16a在脉络膜恶性黑色素瘤的发生、发展过程中具有一定的作用;巩膜浸润程度及远处转移能力越强,Tmem16a表达越高。
综上所述,MTDH、Tmem16a在脉络膜黑色素瘤中呈高表达,且与巩膜浸润程度及远处转移相关,可能成为临床诊治脉络膜黑色素瘤的重要指标。
参 考 文 献
[1] 苑伏香, 张霆, 周占宇,等. 小干扰RNA沉默HIF-1α对缺氧状态下脉络膜黑色素瘤细胞中MMP-2表达的影响. 国际眼科杂志, 2015,15:1139-1142.
[2] Mashayekhi A, Shields C L, Rishi P, et al. Primary transpupillary thermotherapy for choroidal melanoma in 391 cases:Importance of risk factors in tumor control. Ophthalmology, 2015,122:600-609.
[3] 何平, 靳忠民, 朱广庆,等. 脉络膜黑色素瘤CDFI检查与肿瘤组织病理特征的关系. 临床眼科杂志, 2017, 25:38-41.
[4] Caines R, Eleuteri A, Kalirai H, et al. Cluster analysis of multiplex ligation-dependent probe amplification data in choroidal melanoma.Molecular Vision, 2015, 21:1-11.
[5] 张艳华, 姜支农. 左眼脉络膜恶性黑色素瘤术后10年肝脏、肺脏转移1例. 浙江医学, 2016, 38:1376-1377.
[6] 许根贵, 陈吉婷, 徐建锋. PET-CT漏诊脉络膜恶性黑色素瘤一例. 临床误诊误治, 2015,30:76-77.
[7] Konstantinidis L, Roberts D, Errington R D, et al. Transpalpebral proton beam radiotherapy of choroidal melanoma. Br J Ophthalmol,2015,99:232-235.
[8] Abrams M J, Gagne N L, Melhus C S, et al. Brachytherapy vs. external beam radiotherapy for choroidal melanoma: Survival and patterns-of-care analyses.. Brachytherapy, 2016, 15:216-223.
[9] 童萌, 原慧萍, 张诗琦,等. RegⅣ在视网膜母细胞瘤中的表达及其与血管新生的相关性分析. 现代生物医学进展, 2017, 17:88-92.
[10] Sharma R S, Shah P K, Narendran V. Poor uptake of fluorodeoxyglucose in positron emission tomography-computed tomography scan for intraocular choroidal melanoma in Asian Indian eyes. World Journal of Nuclear Medicine, 2015, 15:53-55.
[11] 陈伟, 杨文利, 李栋军,等. 超声弹性成像对眼内肿瘤的鉴别诊断价值.肿瘤影像学, 2016, 25:303-307.
[12] 郭佩琦, 马刚. 超声造影在眼球内肿瘤诊断中的价值. 国际眼科杂志, 2016, 16:1386-1388.
[13] Coupland E S, Kalirai H, Ho V, et al. Concordant chromosome 3 results in paired choroidal melanoma biopsies and subsequent tumour resection specimens.Br J Ophthalmol,2015,99:1444-1450.
[14] 李超, 宋振川, 王新乐,等. 异黏蛋白在乳腺癌细胞中的表达. 中华实验外科杂志, 2013, 30:62-63.
[15] 陈曦, 孙海斌. 组织蛋白酶D、Tmem 16a和乳腺肿瘤激酶在结肠癌中的表达及意义. 中国老年学, 2014, 34:1984-1985.
