鸡源产气荚膜梭菌分离株的生物学特性鉴定
2018-01-11王启琛邹开宇王守春徐守振尹燕博
王启琛 , 邹开宇 , 王守春 , 王 平 , 杜 菲 , 徐守振 , 尹燕博
(1.青岛农业大学动物科技学院 , 山东 青岛 266109 ; 2.青岛澳兰百特生物工程有限公司 , 山东 青岛 266101)
产气荚膜梭菌(C.perfringens)是引起各种动物坏死性肠炎、肠毒血症以及人类的食物中毒和创伤性气性坏疽的主要病原菌之一。目前,它被发现α,β,ε,δ,θ,κ,λ等共计12种毒素,而α、β、ε和t 是主要的致死性毒素,基于魏氏梭菌产生的主要致死毒素与其抗毒素的中和试验,将菌株分成A,B,C,D和E 5种类型,其毒素均能造成人类或动物感染某些疾病,引起组织损伤[1]。
鸡坏死性肠炎(Necrotic enteritis)是由A型或C型产气荚膜梭菌引起的鸡肠道坏死、出血的一种常见病,在全国范围内普遍存在,对中国的养鸡业造成诸多潜在威胁。随着抗生素使用越来越严格,每年家禽坏死性肠炎的发病率持续上升[2]。本研究从山东莱西、安丘、泰安等地送检的疑似坏死性肠炎的病鸡肠道中分离鉴定了3株A型鸡源产气荚膜梭菌,并对其生物学特性进行了初步研究,为鸡坏死性肠炎的诊断和防控提供依据。
1 材料与方法
1.1 主要试剂和仪器 TSB肉汤、血琼脂、硫酸亚铁牛乳培养基等,购自青岛海博生物科技有限公司;DNA质粒提取试剂盒、胶回收试剂盒,购自上海生工生物工程技术服务有限公司;琼脂糖、PCR反应试剂,购自TaKaRa公司;微生物发酵反应管、药敏纸片,购自杭州天和微生物试剂有限公司;2.5 L厌氧袋、厌氧罐,购自日本三菱瓦斯化学株式会社;PCR仪,购自杭州朗基科学仪器有限公司;SPF鸡胚,购自北京梅里亚维通实验动物有限公司;屏障系统动物房和隔离器由青岛澳兰百特生物工程有限公司提供。
1.2 分离培养和形态观察 收集病变肠道,用75%酒精擦拭肠道外壁,接种环刮取肠道内壁,接种在绵羊血琼脂平板上,在37 ℃的温箱中厌氧培养24 h。挑取疑似的双层溶血环菌落,进行涂片,革兰染色、镜检。对分离的3株菌株分别命名AQ01,KD02,TA03并纯化保存备用。
1.3 生化特性鉴定 分离菌分别接种于葡萄糖、山梨醇、乳糖、麦芽糖、蔗糖、甘露醇、明胶、山梨醇、鼠李糖、硝酸盐等生化反应管,37 ℃厌氧培养24 h,进行生化鉴定;牛乳发酵试验,观察是否出现牛乳汹涌发酵现象。
1.4 毒素分型 分离菌分别接种TSB肉汤并厌氧培养24 h,取1.5 mL培养液于离心管中,提取细菌基因组DNA。参考文献[5]合成5对引物(见表1):cpa、cpb、etx、iap、cpb2,分别扩增产气荚膜梭菌的α、β、ε、ι、β2毒素。多重PCR反应体系如下:10×PCR Buffer 3.0 μL,10 mmol/L dNTP 2.5 μL,25 mmol/L MgCl24.0 μL,上下游引物各0.5 μL,rTaq酶0.5 μL,模板DNA 2 μL;最后用ddH2O补足到30 μL。PCR反应程序:94 ℃ 5 min、95 ℃ 30 s、49 ℃~54 ℃ 30 s(第一个循环退火温度为54 ℃,然后每隔4个循环降1度,直至退火温度降为49 ℃)、72 ℃ 1 min,共进行32个循环,72 ℃延伸10 min。PCR产物用1%凝胶琼脂糖进行电泳,观察结果。
1.5 α毒素基因与16S rRNA基因分析 分别用扩增cpa(k)和16S rRNA基因的引物克隆α毒素基因和16S rRNA基因,PCR产物纯化后分别连接到T载体,阳性克隆产物送上海生工生物工程技术服务有限公司测序。在NCBI下载5种类型产气荚膜梭菌型代表株的参考序列(登录号为AY823400.1、D10248.1、D32123.1、D32126.1、D32127.1、D49969.1、D32128.1、X17300.1),用DNAStar软件对分离株和参考株序列进行α毒素基因同源性分析;用MegAlign软件构建16S rRNA基因系统发育树,进行遗传进化分析。
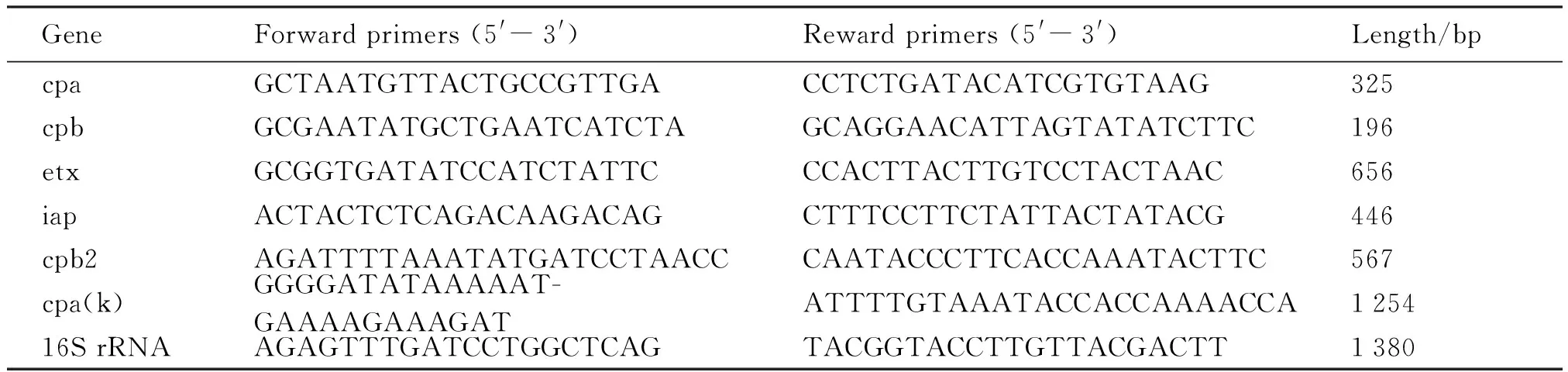
表1 目的基因扩增引物
1.6 药敏试验 根据美国临床和实验室标准协会(CLSI)的标准进行药敏试验[3]。挑取单个菌落接种TG培养基,37 ℃厌氧24 h培养。将其用灭菌棉签均匀涂布于TSC琼脂平板,稍干后再用无菌镊子将药敏纸片贴在普通营养琼脂平板表面,37 ℃厌氧培养24 h后测量各药物抑菌圈的大小(mm),根据抑菌圈直径大小判断分离菌株对各种药物的敏感程度:抑菌圈直径小于10 mm为耐药(R),10~15 mm为中度敏感(I),大于15 mm为高度敏感(S)。
1.7 SPF鸡致病性试验 采用活菌计数法确定3株产气荚膜梭菌攻毒菌液的活菌浓度为8×109CFU/mL,口腔灌服21日龄SPF鸡(每组15只),0.5 mL/只,对照组灌服相同剂量的无菌生理盐水,连续观察7 d。按照上述方法从病死鸡的肝组织和肠道中分离鉴定产气荚膜梭菌。
2 结果
2.1 细菌分离培养结果 血琼脂平板经37 ℃厌氧培养24 h后可见灰白色、边缘整齐、圆形表面光滑菌落,直径2mm~4 mm,菌落周围可见溶血环(见中插彩版图 1 A)。革兰染色镜检可见阳性粗大杆菌,两端钝圆,多单个存在,大小为0.7m~1.3m×1.5m~7m,未见芽胞,符合魏氏梭菌菌落特征(见中插彩版图 1 B)。
2.2 生化鉴定结果 3株分离株均发酵葡萄糖、乳糖、麦芽糖、蔗糖,产气产酸,不发酵山梨醇、甘露醇、鼠李糖,液化明胶,牛乳爆裂。
2.3 毒素分型结果 多重PCR对分离株毒素分型结果显示,3株菌均仅扩增出惟一1条约325 bp大小的α毒素目的条带(见中插彩版图 2),表明三分离株均为A型产气荚膜梭菌。
2.4 α毒素和16s RNA基因分析结果 对α毒素基因序列分析显示,分离菌AQ01和KD02、AQ01和TA03、KD02和TA03间α毒素核苷酸同源性分别为98.9%、98.7%、99.3%,氨基酸序列同源性分别为98.7%、98.7%、99.5%;分离株α毒素编码398个氨基酸,与其他分离株和参考株序列相比, TA03株362位点由Pro突变为Ser,KD02株162位点由Tyr突变为His、137位点Gln缺失;3分离株与参考菌株α毒素核苷酸序列同源性为97.6%~99.9%,氨基酸同源性为96.5%~99.7%。16S rRNA系统进化分析显示,AQ01与KD02亲缘关系很近,属于同一分支,TA03属于单独一个分支。

图3 α毒素氨基酸同源性分析

图4 16S rRNA基因系统进化分析
2.5 药敏试验结果 药敏试验结果显示,3株分离菌株均对庆大霉素、卡那霉素、新霉素、多黏霉素B、复方新诺明表现出耐药性,均对头孢唑啉、头孢曲松、头孢呋辛、氨苄青霉素、哌拉西林药物表现出高度敏感性,对红霉素、克林霉素、丁胺卡那霉素等药物表现出不同程度的敏感。
2.6 SPF鸡致病性试验结果 3株分离株攻毒21日龄SPF鸡7 d后,TA03、AQ01、KD02死亡率分别为100%、60%和10%,毒力强弱依次为TA03、AQ01、KD02。剖检病死鸡可见坏死性肠炎典型病变特征,肝脏变黑变脆、易破裂,有大小不一凹陷(见中插彩版图5 A);肠道臌气,肠壁变薄,肠道黏膜部分出血显著或坏死(见中插彩版图5 C);对照组无任何病变(见中插彩版图5 B、 D)。从病死鸡的肝脏和肠道中又可分离出产气荚膜梭菌。
3 讨论
近年来,产气荚膜梭菌引起的鸡坏死性肠炎给养殖户造成严重经济损失,尤其表现在肠壁上大量出血、坏死,容易被误认为流感、球虫病或新城疫的病变,易延误病情,造成更大损失。鸡坏死性肠炎主要由A型产气荚膜梭菌引起,偶见C型,多发于冬季,鸡源产气荚膜梭菌临床病原分离情况逐年增加。本试验鉴定的3株产气荚膜梭菌均分离于冬季发病种鸡和肉鸡,寒冷季节为病毒和细菌提供了有利的生存环境,经常会引发混合感染,导致坏死性肠炎发生。
A型产气荚膜梭菌主要致死性毒素是α;B型菌主要致死性毒素是α、β、ε;C型菌主要致死性毒素是α、β;D型菌主要致死性毒素是α、ε;E型菌主要致死性毒素是α、t。根据多重PCR扩增毒素用于魏氏梭菌分型见于很多研究报道[4-7]。本试验3株鸡源产气荚膜梭菌分离株经多重PCR均鉴定为A型致病性产气荚膜梭菌。药敏试验结果显示,3株分离菌株均对庆大霉素、卡那霉素、新霉素、多黏霉素B、复方新诺明表现出耐药性,对头孢类、青霉素类、氧氟沙星等药物表现出高度敏感性。耐药性除环丙沙星不同,其余药敏试验结果与艾地云等[8](2014)A型梭菌药敏试验结果基本相似,与据张艳等[9](2015)药敏试验结果有差异,这能跟鸡场的用药史有关,长时间单一用药可能使细菌出现耐药性。
产气荚膜梭菌α毒素是引起动物发病死亡的重要原因之一,近年来对α毒素的plc基因有很多研究[10]。本试验分离株间的α毒素氨基酸同源性高,为98.7%~99.5%,但分离株部分位点出现变异和缺失,其中TA03株362位点由Pro突变为Ser,KD02株162位点由Tyr突变为His、137位点Gln缺失。Nagahama等[11]和Guillouard等[12]研究发现,产气荚膜梭菌的致病性与α毒素基因的缺失改变有关。本试验攻毒结果显示,分离株的致病力存在一定差异性,毒力强弱依次为TA03、AQ01、KD02,这些氨基酸的改变是否关系到菌株毒力的改变,需进一步研究。16S rRNA基因序列是细菌的相对保守的一段序列,其在分析、鉴定细菌进化及亲缘性方面具有检测速度快等优势,是常规的细菌鉴定和培养方法无法比拟的。16S rRNA系统进化分析发现,AQ01与KD02亲缘关系很近,属于同一分支,TA03与其他两株亲缘关系相对较远。
目前,A型产气荚膜梭菌引起的鸡坏死性肠炎对山东地区规模化养鸡业造成越来越严重的经济损失。本试验通过对山东部分地区鸡源A型产气荚膜梭菌分离株的生物学特性的鉴定发现,鸡源A型产气荚膜梭菌的致病性有增强的迹象,且对之前的敏感药物产生了不同程度的耐药性,应当引起高度重视。
[1] 李超. Calibrin-Z对鸡坏死性肠炎防治效果的研究[D].泰安:山东农业大学, 2014.
[2] 郑晓丽. 规模化鸡场健康鸡群产气荚膜梭菌的分离、鉴定及遗传多样性研究[D].雅安:四川农业大学, 2009.
[3] 陈海宁,廖申权,戚南山,等. 鸡产气荚膜梭菌的分离鉴定及药敏试验[J]. 动物医学进展, 2013,34 (12):228-232.
[4] 唐源. 产气荚膜梭菌PCR分型与肠毒素基因的克隆及序列分析[D].贵阳:贵州大学, 2009.
[5] 陈小云, 张存帅, 关孚时. A型产气荚膜梭菌中国标准株α毒素基因的克隆与序列分析[J]. 中国兽药杂志, 2004, 38(12):5-8.
[6] 冶贵生, 马玉花, 韩志辉, 等. A型产气荚膜梭菌青海分离株α毒素基因分析及其蛋白结构与抗原表位预测[J]. 动物医学进展, 2014,35(08):12-18.
[7] 林明辉, 荫俊, 王慧, 等. A型产气荚膜梭菌α毒素全基因的分子克隆与核苷酸序列分析[J]. 生物技术通讯, 2003, 14(03):180-181.
[8] 艾地云, 邵华斌, 张腾飞, 等.鸡产气荚膜梭菌的分离鉴定及药敏试验[J]. 动物医学进展, 2014, 35(06):149-152.
[9] 张艳, 李兰兰, 黄艺华, 等.鸡产气荚膜梭菌的分离鉴定及药敏试验[J]. 中国兽医杂志, 2015, 51(04):73-76.
[10] 宋振银. 鸡源魏氏梭菌的分离、鉴定及分子分型研究[D].雅安:四川农业大学, 2008.
[11] Nagahama M, Okagawa Y, Nakayama T,etal. Site directed mutagenesis of histidine residues inClostridiumperfringensalpha-toxin[J]. J Bacteriol, 1995, 177(5): 1 179-1 185.
[12] Guillouard I, Garnier T, Cole S T. Use of site-directed mutagenesis to probe structure-function relationships of alpha-toxin from Clostridium perfringens[J]. Infect Immun, 1996, 64(7): 2 440-2 444.
