谈谈临床抗凝治疗对实验室监测的需求
2018-01-10乔蕊
乔蕊
(北京大学第三医院检验科,北京100191)
·专家论坛·
谈谈临床抗凝治疗对实验室监测的需求
乔蕊
(北京大学第三医院检验科,北京100191)
抗凝药物由于不同的药效学特点和临床证据支持,临床监测需求存在差异。实验室应警惕凝血酶原时间的国际标准化比值监测维生素K 拮抗剂时可能存在的干扰,普通肝素监测不应再使用活化部分凝血活酶时间比值,低分子肝素和直接口服抗凝药物更应注意药物过量的检测。
抗凝监测;肝素;维生素K拮抗剂;直接口服抗凝药物
在很长一段历史时期内,抗凝药物只有肠外给药的普通肝素(unfractionated,UFH)和口服给药的维生素K拮抗剂(vitamin K antagonists,VKA);使用这两种药物时都需要密切监测以保证抗凝治疗的有效和安全,所以抗凝治疗监测一直是临床实验室的一项重要工作[1]。 为抗凝治疗的便捷并减轻患者的负担,抗凝药物的研发一直以不需要监测为重要目标之一。20世纪六七十年代开始使用的低分子肝素(low-molecular weight heparins,LMWH)和近十年开始使用的直接口服抗凝药物(利伐沙班、达比加群)都以不需要监测为优点;但每当发生血栓或出血事件时,都会引发其是否需要监测的争论[2]。
从药效学特点和临床要求出发,抗凝药物需满足以下特点才能进行监测[3]:(1)药物代谢个体间变异大,需在治疗初始时为患者确定理想给药剂量;(2)药物作用在体内不稳定,会因药物与药物或药物与食物及未知因素作用而发生改变;(3)监测试验重复性好,其结果与药物浓度或效应有良好关系;(4)药物浓度或效应与临床不良事件(血栓或出血)发生有关,可确定一个理想的治疗区间(最小起效剂量和最大耐受剂量);(5)监测试验作为药物剂量增加或减少的基础,已被证明可以防止血栓或出血事件发生。从以上5点出发,目前各种抗凝药物监测的必要性如表1所示,实验室面对这些不同特点的抗凝药物监测时需要注意一些问题。
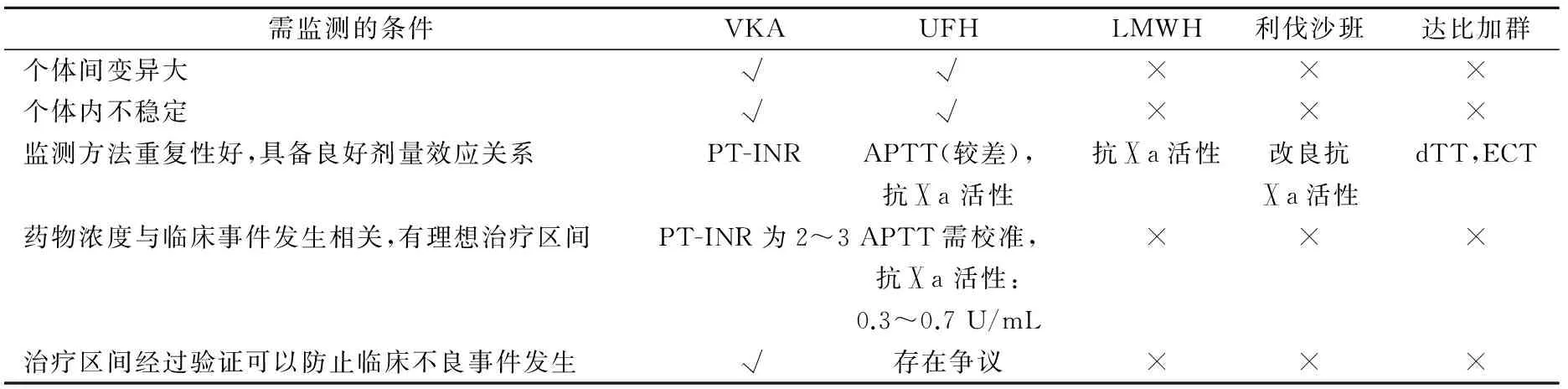
表1 各种抗凝药物监测的必要性
注:VKA,维生素K拮抗剂;UFH,普通肝素;LMWH,低分子肝素;PT-INR,凝血酶原时间的国际标准化比值;APTT,活化部分凝血活酶时间;dTT,稀释凝血酶时间;ECT,Ecarin凝固时间(Ecarin clotting time);√,满足;×,不满足。
1 凝血酶原时间的国际标准化比值监测VKA应警惕潜在的干扰
VKA抗凝效应受年龄、性别、基因多态性(CYP2C9、VKORC等)、药物与药物、药物与食物及一些尚不能解释因素的影响[4]。研究报道,即使在被高度选择的人群里,患者维持在治疗区间内的时间大约只有60%[5],所以患者在给药初始和达到稳态后,都需要监测凝血酶原时间的国际标准化比值(prothrombin time-international normalized ratio,PT-INR)以保证长期维持在治疗区间内。很多研究都证实在静脉血栓形成和非风湿性心房颤动(简称房颤)中,出血与血栓事件的危险与VKA的给药强度有关。INR每增加1单位,出血风险增加3.5倍[6];而INR小于2的血栓风险是大于2的2.8倍[7]。所以PT-INR[PT-INR=(患者PT)/(健康人平均PT的几何平均数)ISI]是监测VKA治疗的良好指标。实验室为保证其准确反映VKA抗凝效应,一方面应注意要做好试剂批号更换时国际敏感指数(international sensitivity index,ISI)和健康人平均PT的几何平均数的管理;另一方面应注意治疗前基线PT值高于参考区间患者的特殊处理。
PT基线值升高常见于高滴度狼疮抗凝物、异常免疫球蛋白存在等病理情况。基线值升高会损害PT-INR与VKA抗凝效应之间的剂量效应关系,此时若仍使用INR值作为确定患者稳态剂量和剂量调整的依据会造成偏差。为解决该问题,实验室应标定INR达到治疗区间(INR在2~3之内)时所对应的FⅩ或 FⅡ(这2个因子是VKA治疗时减低最晚的因子)活性。如图1所示,当INR为2~3时,其对应的FⅩ活性为20%~40%;二者同时使用,可以帮助判断当患者INR达到2~3时,是因狼疮抗凝物等(影响磷脂的作用)的干扰,还是真的达到了治疗区间。
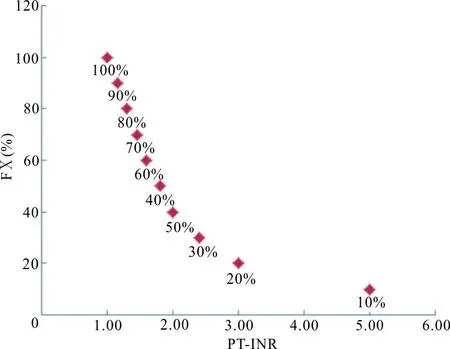
注:PT-INR为2~3时,对应的FⅩ活性为20%~40%。
图1 PT-INR对应的FⅩ活性
2 UFH监测不应再用活化部分凝血活酶时间比值
UFH由于可与内皮细胞、单核细胞及一些血浆蛋白质(玻联蛋白、富含组氨酸的糖蛋白、血小板第4因子)结合,所以存在巨大的个体间和个体内变异,一直被推荐需要监测。但其监测试验——活化部分凝血活酶时间比值(activated partial thromboplastin time ratio,APTT-R)和抗Ⅹa因子活性与药物效应、临床事件的相关性及理想的治疗区间一直存在争议[8]。甚至FIDO研究发现,在急性静脉血栓患者中,固定剂量皮下注射UFH时不监测与固定剂量皮下注射LMWH时不监测一样安全有效,两组静脉血栓的复发率分别为3.8%和3.4%[9],该研究结果挑战了UFH监测价值和剂量调整的必要性。
作为UFH的监测试验,APTT是反映内源性凝血途经因子活性的试验,其测定的重复性受试剂、仪器及除FⅦ外几乎所有因子活性的影响;而抗Ⅹa活性测定虽然干扰因素少,但在一般实验室难以开展,所以APTT仍然是最主要的UFH监测试验。但目前临床上大约有300多种APTT试剂,不同试剂UFH治疗区间(抗Ⅹa因子:0.3~0.7 U/mL)对应的APTT比值范围在1.6~2.7和3.7~6.2之间[10],显然采用APTT比值作为UFH治疗监测的可比性很差。所以当采用APTT监测UFH治疗时,合理的办法是摒弃APTT比值,而采用UFH浓度标定的每个试剂特异的APTT区间。如图2所示,UFH的治疗区间(抗Ⅹa因子:0.3~0.7 U/mL)对应的APTT为56~78 s。但应注意,在使用UFH前,APTT基线升高(存在狼疮抗凝物或因子缺乏)或缩短(纤维蛋白原或FⅧ显著升高),或存在UFH抵抗(抗凝血酶缺陷、肝素清除增加或肝素结合蛋白增加)时,不应再用APTT监测,而应采用抗Ⅹa活性测定[11]。
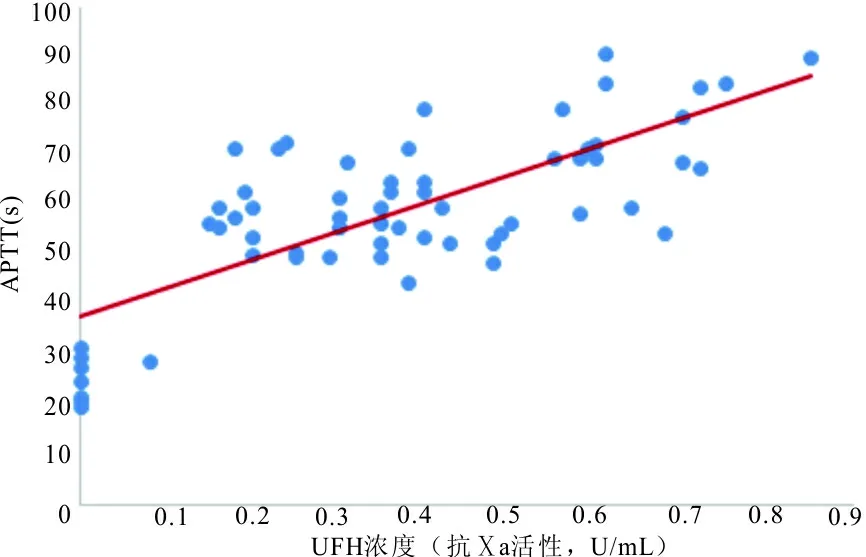
注:抗Ⅹa活性为0.3~0.7 U/mL时,对应的APTT为56~78 s。
图2 UFH浓度(抗Ⅹa活性)对应的APTT
3 LMWH和直接口服抗凝药物更应注意药物过量的检测
LMWH 由于不与内皮细胞和血浆蛋白质结合,皮下注射后有很高的生物利用度,所以LMWH监测主要是为了增强有效性和安全性。LMWH不延长APTT,只影响抗Ⅹa活性,但抗Ⅹa 活性监测与LMWH治疗效应和安全性的关系也存在质疑。研究发现,在深静脉血栓形成和肺栓塞患者中,根据体重调整LMWH给药剂量与根据抗Ⅹa活性调整剂量相比,两组不良事件发生率差异无统计学意义[12]。
与LMWH类似,由于稳定的药效学特点,直接口服抗凝药物推荐固定剂量给药,不需要监测,并且直接口服抗凝药有更宽泛的治疗窗。例如,预防骨科手术患者静脉血栓,利伐沙班在5~40 mg/d有相似的效应和安全性[13];RE-LY研究证实,在房颤患者中,达比加群固定剂量给药(110 或150 mg,bid)不监测,与INR监测的华法林相比,卒中和系统性栓塞发生率等效(110 mg,bid)或降低(150 mg,bid);大的出血事件发生率降低(110 mg,bid)或相似(150 mg,bid)。
LMWH(抗Ⅹa活性测定)、利伐沙班(改良抗Ⅹa活性测定)、达比加群(dTT 和ECT)虽然都有特异的、剂量效应关系良好的监测试验,但其监测价值有限。在更多临床情况下(表2),这些不需要监测的抗凝药物需要的是检测药物是否过量或是否正在服用某药物。例如,昏迷且需急诊手术的患者需要明确是否在服用抗凝药物;肾功能突然恶化的患者需要判断体内抗凝药物是否堆积。对于这些需求,评价这些抗凝药物对常规凝血试验的影响即可满足(表3)[14]。一般而言,当对某抗凝药物敏感性低的试验明显延长或受到影响时,通常提示过量。例如,当PT正常,APTT轻度延长,TT超出检测范围时,通常提示该患者正在服用达比加群;而当PT明显延长(达比加群对PT不敏感)时,常常提示达比加群过量。利用快速可获得的常规试验迅速判断药物过量或正在使用某药物对于过量的纠正和急诊手术的安全非常重要[15]。
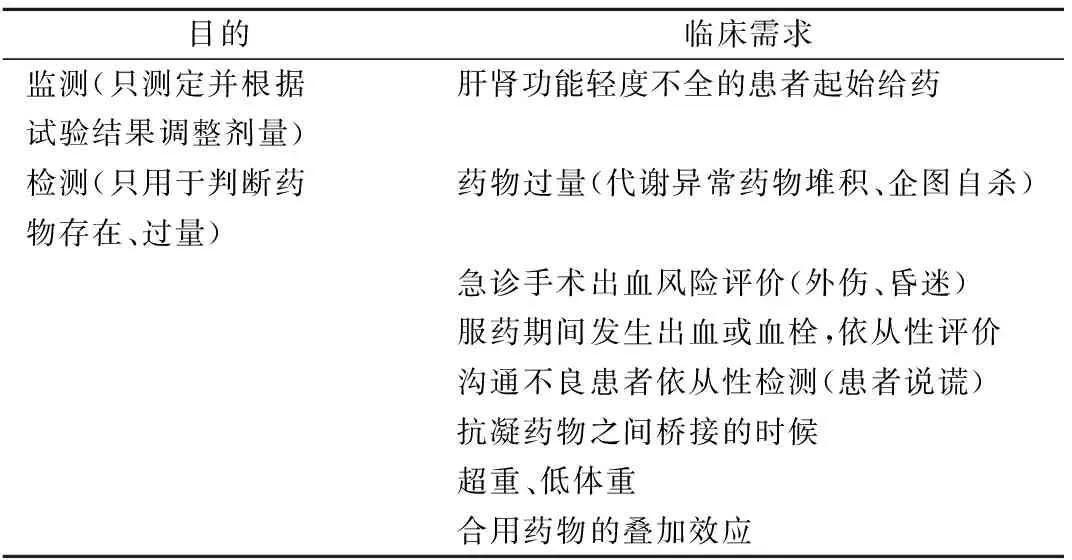
表2 临床对抗凝药物监测和检测的需求

表3 直接口服抗凝药物对常规凝血试验的影响
注:PT,凝血酶原时间;APTT,活化部分凝血活酶时间;TT,凝血酶时间。
4 总结
不同抗凝药物由于不同的药效学和临床特点,监测的需求存在明显差异;临床实验室应根据不同的药物特点和临床需求提供相应的监测或检测能力,为临床抗凝治疗的有效性和安全性提供保证。
[1]López-López JA, Jac S, Hhz T,etal. Oral anticoagulants for prevention of stroke in atrial fibrillation: systematic review, network meta-analysis, and cost effectiveness analysis[J]. BMJ, 2017, 359: j5058.
[2]Harter K, Levine M, Henderson SO. Anticoagulation drug therapy: a review[J]. West J Emerg Med, 2015, 16(1): 11-17.
[3]Mismetti P, Laporte S. New oral antithrombotics: a need for laboratory monitoring. For.[J]. J Thromb Haemost, 2010, 8(4): 621-626.
[4]Wadelius M, Chen LY, Lindh JD,etal. The largest prospective warfarin-treated cohort supports genetic forecasting[J]. Blood, 2009, 113(4): 784-792.
[5]Pokorney SD, Simon DN, Thomas L,etal. Stability of international normalized ratios in patients taking long-term warfarin therapy[J]. JAMA, 2016, 316(6): 661-663.
[6]Eckman MH, Levine HJ, Pauker SG. Effect of laboratory variation in the prothrombin-time ratio on the results of oral anticoagulant therapy[J]. N Engl J Med, 1993, 329(10): 696-702.
[7]Kearon C, Ginsberg JS, Kovacs MJ,etal. Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism[J]. N Engl J Med, 2003, 349(7): 631-639.
[8]Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against.[J]. J Thromb Haemost, 2010, 8(4): 627-630.
[9]Kearon C, Ginsberg JS, Julian JA,etal. Comparison of fixed-dose weight-adjusted unfractionated heparin and low-molecular-weight heparin for acute treatment of venous thromboembolism[J]. JAMA, 2006,296(8): 935-942.
[10]Büller HR, Agnelli G, Hull RD,etal. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy[J]. Chest, 2004, 126(3 Suppl): 401S-428S.
[11]Olson JD, Arkin CF, Brandt JT,etal. College of American Pathologists Conference XXXI on laboratory monitoring of anticoagulant therapy: laboratory monitoring of unfractionated heparin therapy[J]. Arch Pathol Lab Med, 1998, 122(9): 782-798.
[12]Alhenc-Gelas M, Jestin-Le GC, Vitoux JF,etal. Adjusted versus fixed doses of the low-molecular-weight heparin fragmin in the treatment of deep vein thrombosis. Fragmin-Study Group.[J]. Thromb Haemost, 1994, 71(6): 698-702.
[13]Eriksson BI, Borris LC, Dahl OE,etal. A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement[J]. Circulation,2006,114(22): 2374-2381.
[14]Favaloro EJ, Lippi G. The new oral anticoagulants and the future of haemostasis laboratory testing[J]. Biochem Med (Zagreb), 2012, 22(3): 329-341.
[15]Epple C, Steiner T. Acute stroke in patients on new direct oral anticoagulants: how to manage, how to treat?[J]. Expert Opin Pharmacother, 2014, 15(14): 1991-2001.
10.13602/j.cnki.jcls.2017.12.04
国家自然科学基金(81601824);北京大学第三医院临床重点项目(BYSY2017008)。
乔蕊,1979年生,女,副教授,博士,主要从事血栓与止血研究,E-mail: qrqiaorui@163.com。
R446.11
A
2017-11-20)
王海燕)
