狼疮性肾炎患者血清IL-18、IL-34水平及其意义*
2018-01-10刘美兰马福哲吴昊桑雪婷李佳许颖
刘美兰,马福哲,吴昊,桑雪婷,李佳,许颖
(吉林大学第一医院 肾病内科,吉林 长春 130021)
狼疮性肾炎患者血清IL-18、IL-34水平及其意义*
刘美兰,马福哲,吴昊,桑雪婷,李佳,许颖
(吉林大学第一医院 肾病内科,吉林 长春 130021)
目的探讨狼疮性肾炎患者血清白细胞介素18(IL-18)和白细胞介素34(IL-34)水平及其意义。方法收集2013年1月-2016年12月吉林大学第一医院狼疮性肾炎患者70例作为狼疮性肾炎组,健康体检者70例作为对照组;狼疮性肾炎组患者根据系统性红斑狼疮疾病活动度评分(SLEDAI)-2000分为活动组(SLEDAI评分≥10分)45例和非活动组(SLEDAI评分<10分)25例。收集两组患者临床资料,采用酶联免疫吸附法测定血清IL-18和IL-34水平。结果狼疮性肾炎组血清IL-18和IL-34水平高于对照组(P<0.05)。狼疮性肾炎活动组血清IL-18和IL-34水平高于非活动组(P<0.05)。狼疮性肾炎患者血清IL-18和IL-34水平与C反应蛋白、24 h尿蛋白、ds-DNA、SLEDAI评分呈正相关(P<0.05),狼疮性肾炎患者血清IL-34水平与补体C3呈负相关(P<0.05)。狼疮性肾炎患者血清IL-18水平与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润,肾小球增生性改变、肾小球炎症细胞浸润,肾间质纤维化呈正相关(P<0.05)。狼疮性肾炎患者血清IL-34水平与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润,肾小球增生性改变、肾小球炎症细胞浸润,肾间质纤维化、肾间质炎症细胞浸润呈正相关(P<0.05)。结论狼疮性肾炎患者血清IL-18和IL-34水平升高,血清IL-18、IL-34水平与疾病活动性及病理变化呈正相关。
狼疮性肾炎;白细胞介素18;白细胞介素34。
系统性红斑狼疮最严重的并发症之一为狼疮性肾炎。狼疮性肾炎的主要临床表现为蛋白尿、血尿,其在系统性红斑狼疮中的发病率和死亡率较高[1]。狼疮性肾炎的治疗主要以免疫抑制剂和激素缓解治疗为主,但治疗效果欠佳[2]。其肾脏损害机制尚不十分清楚,巨噬细胞介导的炎症损伤在狼疮性肾炎的发病中具有重要作用,白细胞介素18(Interleukin-18,IL-18)属于IL-1家族成员之一,是新发现的细胞因子,主要由巨噬细胞产生,可激发多种炎症反应[3-4];白细胞介素34(Interleukin-34,IL-34)也为新发现的细胞因子,是集落刺激因子-1受体的另一配体,和集落刺激因子-1受体结合后对巨噬细胞的增殖、分化具有调节作用,并促进炎症因子分泌,在自身免疫疾病的发病中发挥重要作用[5-6]。本文对狼疮性肾炎患者血清IL-18和IL-34水平进行研究,探讨其在狼疮性肾炎发病中的作用。
1 资料与方法
1.1 临床资料
选取2013年1月-2016年12月吉林大学第一医院狼疮性肾炎患者70例作为狼疮性肾炎组;选取年龄、性别相匹配的健康体检者70例作为对照组;狼疮性肾炎组患者根据系统性红斑狼疮疾病活动度评分(systemic lupus erythematosusdisease activity score,SLEDAI)-2000分为活动组(SLEDAI评分≥10分)45例和非活动组(SLEDAI评分<10分)25例。狼疮性肾炎患者24 h尿蛋白、补体C3、补体C4、ds-DNA、SLEDAI评分分别为(4532.57±324.15)mg/ L、(527.58±241.27)mg/L、(173.24±158.48)mg/L、(562.17±132.76)IU/L、(12.43±6.58)分。140例研究对象知情同意,经本院伦理委员会审批。
1.1.1 纳入标准狼疮性肾炎组患者为系统性红斑狼疮患者,经肾活检证实为狼疮性肾炎。对照组患者为健康体检者。两组患者均资料完整。
1.1.2 排除标准重叠综合征、原发性干燥综合征、类风湿关节炎等其他自身免疫性疾病,原发性或其他继发性肾脏疾病,严重心肝肾等脏器疾病,血液系统疾病,精神疾病,妊娠及哺乳期患者,高血压、糖尿病等,近期感染,近期行激素或免疫抑制剂治疗者。
1.2 方法
收集患者的性别、年龄、实验室检查指标、肾脏病理结果等资料。血清IL-18和IL-34水平测定:抽取两组患者空腹外周静脉血4 ml,3 000 r/min离心5 min,留取血清,采用酶联免疫吸附法测定血清IL-18和IL-34水平。
1.3 统计学方法
2 结果
2.1 狼疮性肾炎组与对照组患者临床资料比较
狼疮性肾炎组和对照组的年龄、性别、白细胞计数与对照组比较,差异无统计学意义(P>0.05),两组C反应蛋白比较,差异有统计学意义(P<0.05),狼疮性肾炎组高于对照组。见表1。
2.2 狼疮性肾炎组与对照组血清IL-18、IL-34水平比较
狼疮性肾炎组与对照组的血清IL-18和IL-34水平比较,差异有统计学意义(P<0.05),狼疮性肾炎组高于对照组。见表2。
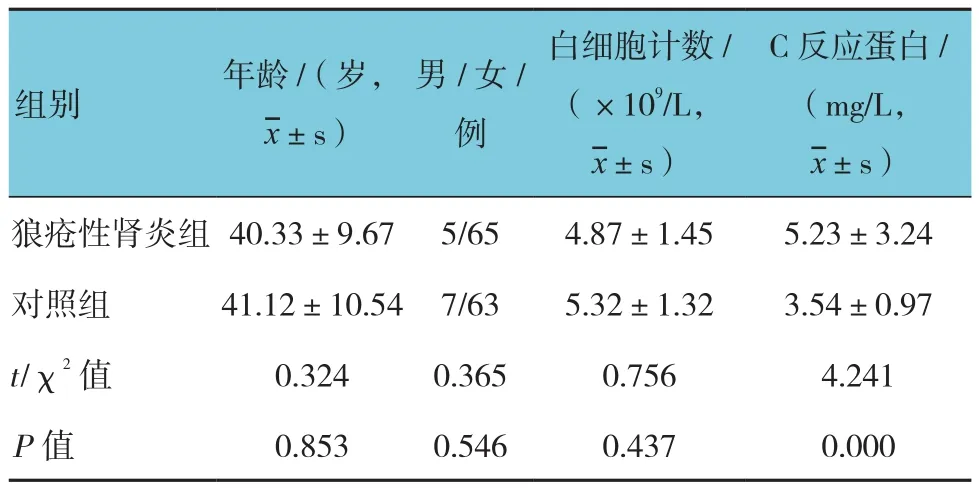
表1 狼疮性肾炎组与对照组患者临床资料比较 (n =70)
表2 狼疮性肾炎组与对照组血清IL-18、IL-34水平比较(n =70,ng/L,±s)
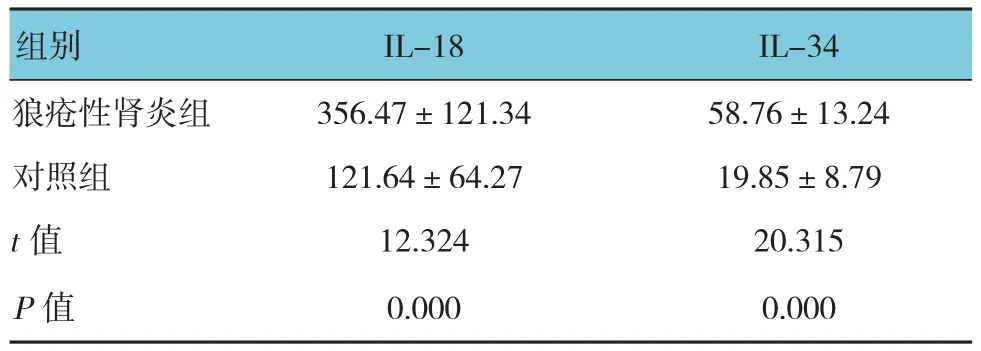
表2 狼疮性肾炎组与对照组血清IL-18、IL-34水平比较(n =70,ng/L,±s)
组别 IL-18 IL-34狼疮性肾炎组 356.47±121.34 58.76±13.24对照组 121.64±64.27 19.85±8.79 t值 12.324 20.315 P值 0.000 0.000
2.3 狼疮性肾炎活动组与非活动组血清IL-18、IL-34水平比较
狼疮性肾炎活动组与非活动组血清IL-18和IL-34水平比较,差异有统计学意义(P<0.05),狼疮性肾炎活动组高于非活动组。见表3。
2.4 狼疮性肾炎患者血清IL-18、IL-34水平与实验室指标的相关性
狼疮性肾炎患者血清IL-18、IL-34水平与C反应蛋白、24 h尿蛋白、ds-DNA、SLEDAI评分呈正相关(P<0.05),狼疮性肾炎患者血清IL-34水平与补体C3呈负相关(P<0.05)。见表4。
2.5 狼疮性肾炎患者血清IL-18、IL-34水平与病理结果的相关性
狼疮性肾炎患者血清IL-18水平与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润,肾小球增生性改变、肾小球炎症细胞浸润,肾间质纤维化呈正相关(P<0.05)。狼疮性肾炎患者血清IL-34水平与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润,肾小球增生性改变、肾小球炎症细胞浸润,肾间质纤维化、肾间质炎症细胞浸润呈正相关(P<0.05)。见表5。
表3 狼疮性肾炎活动组与非活动组血清IL-18、IL-34水平比较 (ng/L,±s)
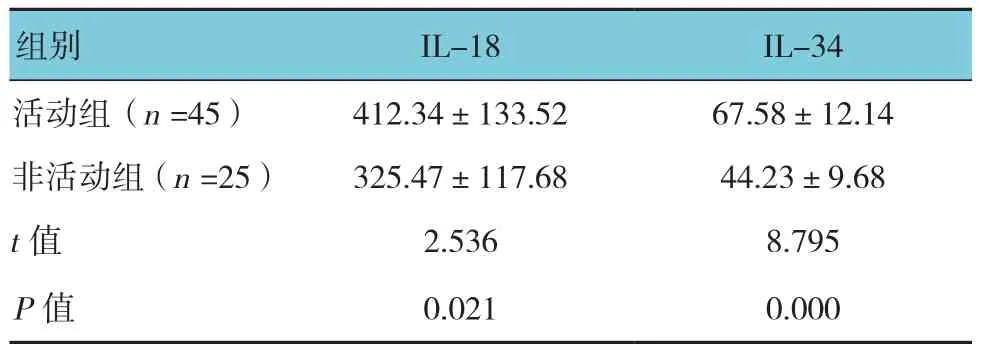
表3 狼疮性肾炎活动组与非活动组血清IL-18、IL-34水平比较 (ng/L,±s)
组别 IL-18 IL-34活动组(n =45) 412.34±133.52 67.58±12.14非活动组(n =25) 325.47±117.68 44.23±9.68 t值 2.536 8.795 P值 0.021 0.000
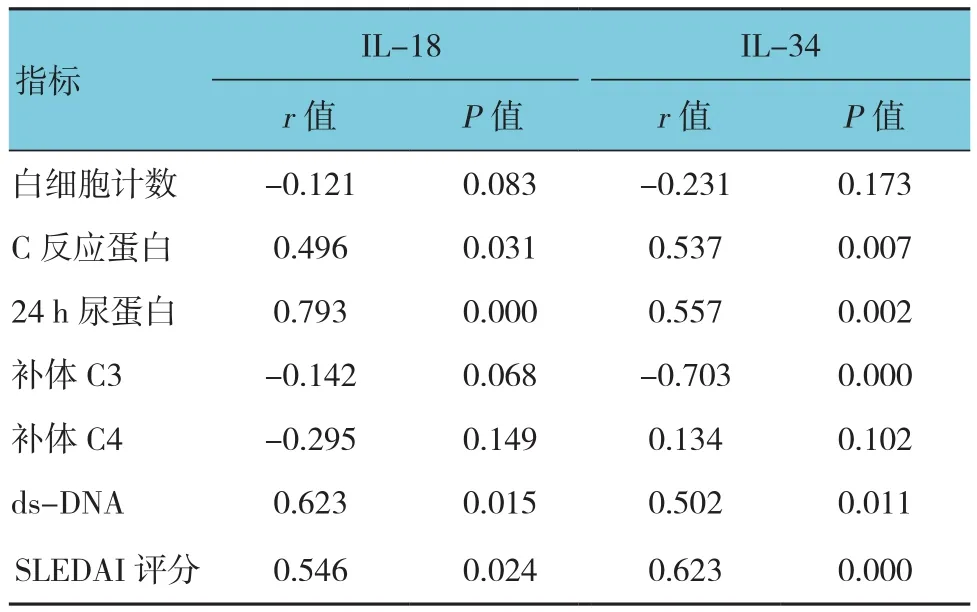
表4 狼疮性肾炎患者实验室指标与血清IL-18、IL-34水平的相关性

表5 狼疮性肾炎患者病理结果与血清IL-18、IL-34水平的相关性
3 讨论
IL-18由活化的巨噬细胞产生,具有多种生物学活性,可促进NK细胞、T细胞的增殖和活化,可激发多种炎症反应,使Th细胞分化、增殖形成Th1细胞。IL-18可刺激外周血单个核细胞和T细胞产生干扰素-γ,可刺激Th2细胞产生各种细胞因子,可增加NK细胞上FasL的表达,导致其介导的细胞毒性反应[7-8],因此IL-18在免疫反应中具有重要作用,IL-18在免疫性疾病的发病中具有重要作用[9-10]。本研究结果发现,狼疮性肾炎患者血清IL-18水平升高,狼疮性肾炎活动组IL-18水平较非活动组高,血清IL-18水平与C反应蛋白、24 h尿蛋白、ds-DNA、SLEDAI评分呈正相关,与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润、肾小球增生性改变、肾小球炎症细胞浸润、肾间质纤维化呈正相关。IL-18参与狼疮性肾炎的发病,可反应狼疮性肾炎的活动性,可通过炎症反应加重肾脏的损害,其机制可能与IL-18促进NK细胞、T细胞的增殖和活化,刺激外周血单个核细胞和T细胞产生干扰素-γ,刺激Th2细胞产生细胞因子,激发炎症反应等有关[11]。
IL-34为集落刺激因子-1受体的配体之一,独立于集落刺激因子-1发挥作用,可活化巨噬细胞,促进巨噬细胞活化、增殖、分化和聚集,促进相应细胞活性因子分泌[12-13];IL-34对巨噬细胞的作用与集落刺激因子-1存在差异,IL-34对集落刺激因子-1受体的丝裂原活化蛋白激酶、受体下游黏附斑激酶、络氨酸位点的激活较集落刺激因子-1强,对巨噬细胞分泌单核细胞趋化因子的作用较集落刺激因子-1弱,对细胞膜趋化因子受体和补体3a受体表达的促进作用较集落刺激因子-1强[14-15]。研究发现,IL-34在狼疮小鼠的肾脏中表达升高[16]。本文对狼疮性肾炎患者血清IL-34水平进行研究,结果发现,狼疮性肾炎患者血清IL-34水平升高,狼疮性肾炎活动组IL-34水平较非活动组高,血清IL-34水平与C反应蛋白、24 h尿蛋白、ds-DNA、SLEDAI评分呈正相关,与补体C3呈负相关,与肾小管上皮细胞变性、肾小管白细胞管型、肾小管炎症细胞浸润、肾小球增生性改变、肾小球炎症细胞浸润、肾间质纤维化、肾间质炎症细胞浸润呈正相关。可见,狼疮性肾炎患者存在明显的炎症反映,血清IL-34水平可反应狼疮性肾炎的活动性,血清IL-34水平升高加重患者的临床症状,IL-34可能通过炎症反应加重肾小管、肾小球及肾间质的损伤。系统性红斑狼疮由于大量循环免疫复合物的形成,大量补体被消耗,其补体的下降程度和病情活动程度相关,免疫复合物沉积肾小球引起狼疮肾炎的发生,临床上补体C3下降程度常作为狼疮肾炎活动度的判断指标,而狼疮肾炎患者血清IL-34水平升高,与血清补体C3水平呈负相关。原始巨噬细胞具有比较强的可塑性,活化性巨噬细胞在狼疮性肾炎中发挥直接损伤作用,巨噬细胞是肾组织转化生长因子-β的主要来源之一,转化生长因子-β对上皮细胞死亡和成纤维细胞的增生具有促进作用。由此推测,IL-34通过活化巨噬细胞,参与狼疮性肾炎的发病,且在狼疮性肾炎的肾脏慢性病变中发挥重要作用,可能对狼疮性肾炎肾脏的纤维化和增生具有促进作用[17]。
[1]JARYAL A, VIKRANT S. Current status of lupus nephritis[J]. Indian J Med Res, 2017, 145(2): 167-178.
[2]CHEN Y, SUN J, ZOU K, et al. Treatment for lupus nephritis: an overview of systematic reviews and meta-analyses[J]. Rheumatol Int, 2017, 37(7): 1089-1099.
[3]WAWROCKI S,dRUSZCZYNSKA M, KOWALEWICZKULBAT M, et al. Interleukin 18 (IL-18) as a target for immune intervention[J]. Acta Biochim Pol, 2016, 63(1): 59-63.
[4]卢芬, 李旭, 李玮, 等. 白细胞介素18抗体对重症肌无力小鼠模型的治疗作用[J]. 中华神经科杂志, 2016, 49(6): 445-450.
[5]SANCHEZ-NIÑO Md, SANZ A B, ORTIZ A. Chronicity following ischaemia-reperfusion injurydepends on tubularmacrophage crosstalk involving two tubular cell-derived CSF-1R activators: CSF-1 and IL-34[J]. Nephroldial Transplant, 2016, 31(9): 1409-1416.
[6]王苗苗, 王冰, 马梓健, 等. 白细胞介素-34对类风湿关节炎患者滑膜成纤维细胞增殖及趋化因子表达的影响[J]. 中华风湿病学杂志, 2016, 20(4): 220-223.
[7]KOCH K N, MÜLLER A. Helicobacter pylori activates the TLR2/ NLRP3/caspase-1/IL-18 axis to induce regulatory T-cells, establish persistent infection and promote tolerance to allergens[J]. Gut Microbes, 2015, 6(6): 382-387.
[8]HAND T W. Interleukin-18: the bouncer at the mucosal bar[J]. Cell, 2015, 163(6): 1310-1312.
[9]曾立平, 潘能浪, 陈伟烈, 等. 丙型肝炎病毒感染对艾滋病患者高效抗逆转录病毒治疗中血浆白细胞介素18水平及免疫重建的影响[J]. 国际流行病学传染病学杂志, 2016, 43(6): 370-376.
[10]CHEN Y L, CHEN Y S, HUNG Y C, et al. Improvement in T helper 1-related immune responses in BALB/c mice immunized with an HIV-1 gag plasmid combined with a chimeric plasmid encoding interleukin-18 and flagellin[J]. Microbiol Immunol, 2015, 59(8): 483-494.
[11]GANDHAPUDI S K, TAN C, MARINO J H, et al. IL-18 acts in synergy with IL-7 to promote ex vivo expansion of T lymphoid progenitor cells[J]. J Immunol, 2015, 194(8): 3820-3828.
[12]SAN SEGUNDOd, RUIZ P, IRURE J, et al. Serum levels of interleukin-34during acute rejection in liver transplantation[J]. Transplant Proc, 2016, 48(9): 2977-2979.
[13]邬秀娣, 孙晓彤, 汤亚微, 等. 强直性脊柱炎患者血清白细胞介素-1家族细胞因子和白细胞介素-34水平的检测[J]. 中华风湿病学杂志, 2016, 20(5): 331-334.
[14]FOUCHER Ed, BLANCHARD S, PREISSER L, et al. IL-34-and M-CSF-induced macrophages switch memory T cells into Th17 cells via membrane IL-1[J]. Eur J Immunol, 2015, 45(4): 1092-1102.
[15]邬秀娣, 汤亚微, 孙晓彤, 等. 系统性红斑狼疮患者血清白细胞介素-1家族及白细胞介素-34水平[J]. 中华临床免疫和变态反应杂志, 2016, 10(2): 112-116.
[16]GUILLONNEAU C, BÉZIE S, ANEGON I. Immunoregulatory properties of the cytokine IL-34[J]. Cell Mol Life Sci, 2017, 74(14): 2569-2586.
[17]ZHOU R P, WU X S, XIE Y Y, et al. Functions of interleukin-34 and its emerging association with rheumatoid arthritis[J]. Immunology, 2016, 149(4): 362-373.
Levels of serum IL-18 and IL-34 in patients with lupus nephritis and their significance*
Mei-lan Liu, Fu-zhe Ma, Hao Wu, Xue-ting Sang, Jia Li, Ying Xu
(Department of Nephrology, the First Hospital of Jilin University, Changchun, Jilin 130021, China)
ObjectiveTo investigate the levels of serum interleukin 18 (IL-18) and interleukin 34 (IL-34) in patients with lupus nephritis and their significance.MethodsSeventy cases of patients with lupus nephritis were collected as lupus nephritis group, and 70 healthy subjects were collected as control group in the First Hospital of Jilin University from January 2013 todecember 2016. The patients with lupus nephritis weredivided into active group (SLEDAI ≥10) and inactive group (SLEDAI <10) according to Systemic Lupus Erythematosusdisease Activity Score (SLEDAI) -2000 score, each group had 25 cases. The clinicaldata of the two groups were collected. The serum IL-18 and IL-34 levels were measured by ELISA.ResultsThe levels of serum IL-18 and IL-34 in the lupus nephritis group were higher than those in the control group (P< 0.05). The levels of serum IL-18 and IL-34 in the active group were higher than those in the inactive group (P< 0.05). The levels of serum IL-18 and IL-34 in the patients with lupus nephritis were positively correlated with C-reactive protein, 24-h urinary protein,ds-DNA and SLEDAI score (P< 0.05). There was a negative correlation between serum IL-34 level and complement C3 level in the patients with lupus nephritis (P< 0.05). The serum IL-18 level was positively correlated with renal tubular epithelial celldegeneration, renal tubular leukocyte casts, in flammatory cell in filtration in renal tubules, glomerular hyperplasia, glomerular in flammatory cell in filtration and renal interstitial fibrosis in the patients with lupus nephritis (P< 0.05). The serum IL-34 level in the patients with lupus nephritis was positively correlated with renal tubular epithelial celldegeneration, leukocyte casts, renal tubular in flammatory cell in filtration, glomerular hyperplasia, glomerular in flammatory cell in filtration, renal interstitial fibrosis and in flammatory cell in filtration (P< 0.05).ConclusionsThe serum IL-18 and IL-34 levels are elevated in the patients with lupus nephritis, and in positive correlation withdisease activity and pathological changes.
lupus nephritis; interleukin 18; interleukin 34
10.3969/j.issn.1005-8982.2018.02.010
1005-8982(2018)02-0053-04
R593.242
A
2016-07-20
国家自然科学基金(No:81641064);吉林省省级产业创新专项资金项目(No:2016C041-2);吉林省教育厅“十三五”科学技术研究规划项目(No:JJKH20170841KJ)
许颖,E-mail:mccxy@163.com
(童颖丹 编辑)
