Ac-SDKP通过调节HDAC6和HSP90抑制矽肺纤维化的机制研究*
2018-01-10李红垒徐丁洁郭地利耿玉聪高学敏李世峰徐洪杨方魏中秋
李红垒,徐丁洁,郭地利,耿玉聪,高学敏,李世峰,徐洪,杨方,魏中秋
(华北理工大学 1.医学实验研究中心,2.中医学院,3.病理学系,河北 唐山 063210)
Ac-SDKP通过调节HDAC6和HSP90抑制矽肺纤维化的机制研究*
李红垒1,徐丁洁2,郭地利1,耿玉聪1,高学敏1,李世峰1,徐洪1,杨方1,魏中秋3
(华北理工大学 1.医学实验研究中心,2.中医学院,3.病理学系,河北 唐山 063210)
目的探讨Ac-SDKP通过对组蛋白去乙酰化酶6(HDAC6)、热休克蛋白90(HSP90)的调节,抑制大鼠矽肺纤维化的作用机制。方法非暴露式支气管内灌注法复制大鼠矽肺模型,分为对照4周组、矽肺模型4周组、对照8周组、矽肺模型8周组、Ac-SDKP抗纤维化治疗组和Ac-SDKP预防治疗组。采用转化生长因子-β1(TGF-β1)诱导原代培养新生大鼠肺成纤维细胞向肌成纤维细胞分化,并予以Ac-SDKP和HDAC6特异性抑制剂TCS HDAC6 20b预处理。采用苏木精-伊红染色法观察病理形态变化,免疫组织化学法、Western blot检测Ⅰ型胶原、α-平滑肌肌动蛋白(α-SMA)、HDAC6及HSP90的表达。结果免疫组织化学法结果显示,HDAC6和HSP90阳性表达主要位于矽结节内,给予Ac-SDKP抗纤维化治疗或预防治疗均能抑制Ⅰ型胶原、α-SMA、HDAC6及HSP90蛋白表达的上调。而TGF-β1能诱导大鼠成纤维细胞α-SMA阳性表达,同时伴随HDAC6和HSP90蛋白表达上调,而予以TCS HDAC6 20b或Ac-SDKP预处理均能抑制该变化。结论Ac-SDKP能够通过对HDAC6和HSP90信号的调节,在体内外抑制矽肺大鼠肌成纤维细胞分化和胶原沉积,从而发挥抗矽肺纤维化的作用。
Ac-SDKP;肺纤维化;HDAC6;HSP90
矽肺病是我国最严重的职业病,占职业病报告总例数的90%左右,其主要病理特征为矽结节形成和间质纤维化[1]。本课题组前期采用蛋白质组学技术研究发现乙酰化微管蛋白α(acetylated α-tubulin,α-Ac-Tub)在矽肺模型组表达下调,而Ac-SDKP抗纤维化治疗或预防治疗能够上调其表达,提示α-Ac-Tub可能是Ac-SDKP抗矽肺纤维化作用的靶蛋白之一[2]。α-Tub乙酰化位点位于其第40位赖氨酸残基,主要依赖组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histonedeacetylase,HDAC)的调节[3-4]。有关研究表明,HDAC6具有非组蛋白底物的特异性,主要作用于α-Tub、热休克蛋白90(heat shock protein 90,HSP90)和皮动蛋白的去乙酰化[5-7]。因此,本研究拟通过支气管灌注二氧化硅SiO2复制矽肺大鼠模型,结合体外转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导的肌成纤维细胞分化模型,观察Ac-SDKP对HDAC6和HSP90信号的调节作用,进一步完善其抗纤维化作用的可能机制。
1 材料与方法
1.1 材料
SiO2粉尘购置于美国Sigma公司,药物微量释放泵(Alzet 2 ml)购置于美国Durect公司,Ac-SDKP(H-1156)购置于瑞士Bachem AG公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔抗购置于美国Eptomics公司,HDAC6兔抗、Ⅰ型胶原兔抗均购置于美国Abcam公司,HSP90购置于美国BD Transduction Laboratories公司。
1.2 方法
1.2.1 实验动物及模型的复制SPF级成年雄性Wistar大鼠60只,质量(180±10)g,订购于北京维通利华实验动物技术有限公司(动物许可证:SCXK京20090003),在华北理工大学动物实验中心屏障实验室饲养。大鼠随机分成6组:①对照4周组:一次性支气管灌注生理盐水1 ml,腹腔包埋含2 ml生理盐水的微量缓释泵,饲养4周后处理;②矽肺模型4周组:一次性支气管灌注含50 mg/ml SiO2的生理盐水1 ml,腹腔包埋含2 ml生理盐水的微量缓释泵,饲养4周后处理;③对照8周组:一次性支气管灌注生理盐水1 ml,腹腔包埋含2 ml生理盐水的微量缓释泵,饲养8周后处理;④矽肺模型8周组:一次性支气管灌注含50 mg/ml SiO2的生理盐水1 ml,腹腔包埋含2 ml生理盐水的微量缓释泵,饲养8周后处理;⑤Ac-SDKP抗纤维化治疗组:一次性支气管灌注含50 mg/ml SiO2的生理盐水1 ml,腹腔包埋含2 ml生理盐水的微量缓释泵,4周后更换为含Ac-SDKP 800μg/(kg·d)的微量缓释泵,继续饲养至第8周处理;⑥Ac-SDKP预防治疗组:灌尘前48 h腹腔包埋含Ac-SDKP 800μg/(kg·d)的微量缓释泵,一次性支气管灌注含50 mg/ml SiO2的生理盐水1 ml,饲养8周后处理。实验结束后,右下肺固定、包埋切片;其余组织-80℃冷冻。
1.2.2 肺成纤维细胞培养及分组原代培养大鼠肺成纤维细胞,取2代细胞用于实验研究。实验分组:①对照组:空白培养基(无胎牛血清的DMEM培养基)孵育细胞;②TGF-β1诱导组:空白培养基+ TGF-β15 ng/ml诱导;③Ac-SDKP预处理组:空白培养基+Ac-SDKP 10~8 mol/L预处理1 h后,给予TGF-β15 ng/ml共孵育;④TCS HDAC6 20b预处理组:空白培养基+HDAC6特异性抑制剂TCS HDAC6 20b 10~6 mol/L预处理1 h后,给予TGF-β15 ng/ml共同孵育。
1.2.3 苏木精-伊红染色法(hematoxylin-eosin staining,HE)石蜡切片二甲苯脱蜡,梯度乙醇水化,苏木素染色5 min,流水冲洗,0.117 mol/L盐酸乙醇分化数秒,流水冲洗返蓝,伊红染色1 min,逐步梯度乙醇脱水、二甲苯透明,中性树胶封片,光学显微镜下观察肺组织病理形态。
1.2.4 免疫组织化学染色法切片常规脱蜡至水,高压修复,0.3%双氧水H2O2封闭内源性过氧化物酶,HDAC6(1∶100)和HSP90(1∶100)4℃孵育过夜,二抗37℃、30 min,DAB显色,镜下控制,轻度复染,常规脱水透明封片,检测HDAC6和HSP90的表达。
1.2.5 Western blot检测提取肺组织或成纤维细胞蛋白,Brafford法测定蛋白浓度,聚丙烯酰胺凝胶电泳,电转至PVDF膜,5%牛血清白蛋白封闭1 h,一抗I型胶原(1∶500)、α-SMA(1∶500)、HDAC6(1∶500)、HSP90(1∶500)、GAPDH(1∶1 000)4℃孵育过夜,二抗(1∶5 000)37℃孵育30 min。ECL发光试剂显色,采用Image-Pro-plus图像处理软件对条带进行分析,以目的蛋白光密度值与GAPDH内参蛋白光密度值的比值作为该蛋白的相对表达量,检测I型胶原、α-SMA、HDAC6及HSP90蛋白的表达
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用单因素方差分析,两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠矽肺模型病理形态学变化特点
HE染色结果显示,对照组肺泡壁薄,结构清晰,间质无明显炎症细胞浸润。矽肺模型组肺组织内可见肺泡壁均呈不同程度增宽,且有明显的矽结节形成,多由巨噬细胞和增生的成纤维细胞构成。其中矽肺模型4周组以细胞性结节多见,而矽肺模型8周组可见多个矽结节融合,纤维细胞性结节多见。经Ac-SDKP抗纤维化治疗或预防治疗后,矽结节数量和面积较矽肺模型8周组减少,肺组织纤维化程度减轻。见图1。
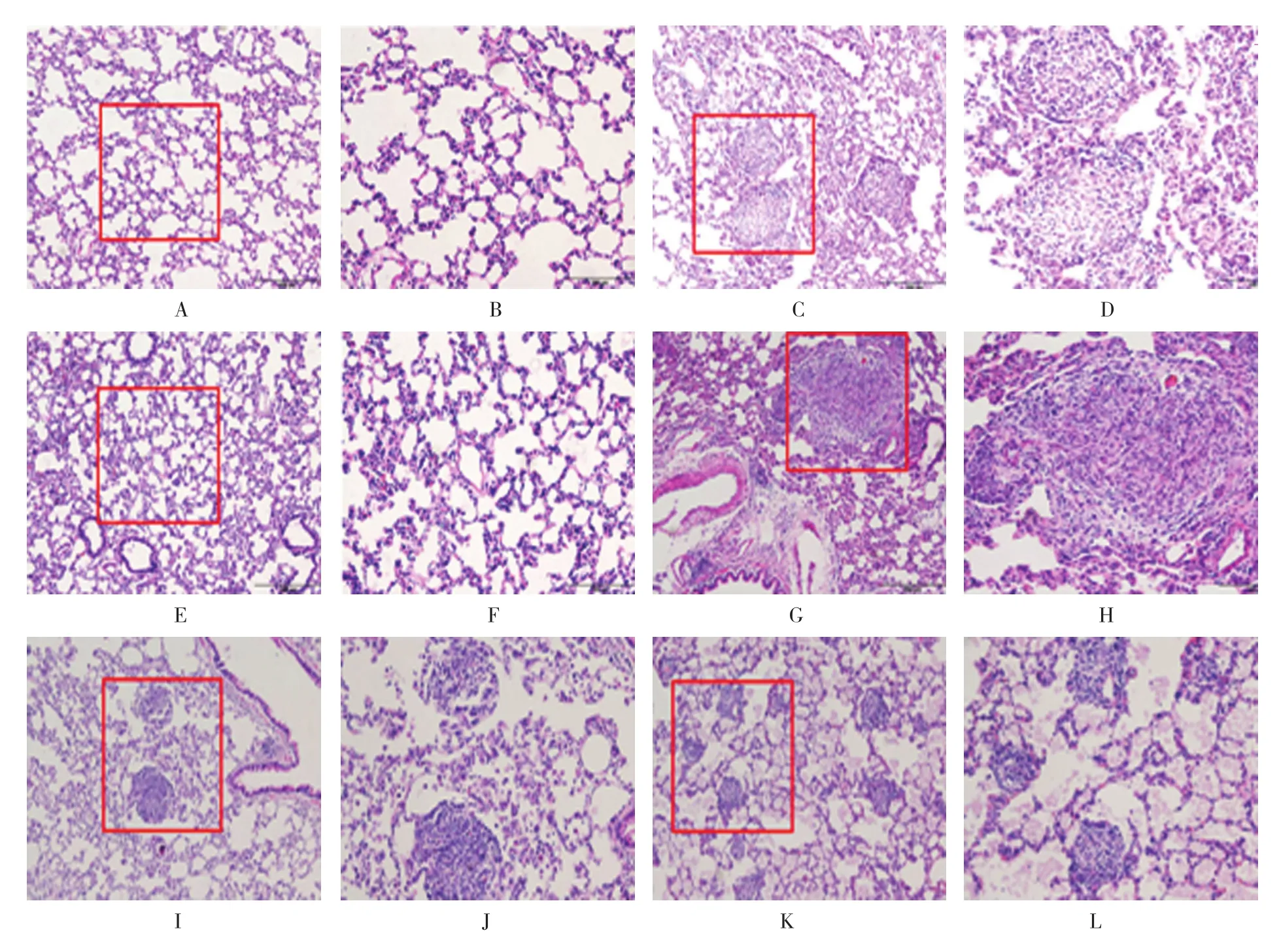
图1 矽肺大鼠肺组织病理形态学变化 (HE染色)
2.2 Ac-SDKP对矽肺大鼠Ⅰ型胶原、α-SMA、HDAC6及HSP90表达的调节作用
免疫组织化学染色结果显示,HDAC6和HSP90在对照组中表达于支气管上皮细胞和部分肺泡Ⅱ型上皮细胞,其中在支气管上皮细胞胞浆内阳性表达,偶见胞核内表达,而在肺泡Ⅱ型上皮细胞中以胞核表达为主;在矽肺模型组中,除具有上述表达特点外,在巨噬细胞中阳性表达较为显著,多位于矽结节和间质纤维化区域,以胞浆显色为主。与矽肺模型8周组相比,Ac-SDKP抗纤维化治疗和预防治疗组矽结节明显减小,HDAC6和HSP90阳性表达减弱。见图2、3。
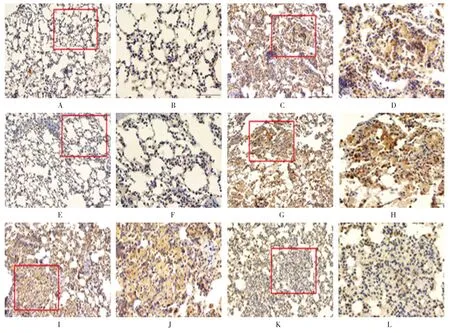
图2 HDAC6在矽肺大鼠肺组织中的定位和表达 (免疫组织化学染色)
Western blot检测结果显示,HDAC6和HSP90在矽肺模型组较相应时间点对照组表达增加,其中HDAC6上调至相应时间点对照组的2.04和1.60倍,HSP90上调至1.58和1.81倍;Ac-SDKP抗纤维化治疗和预防治疗后HDAC6和HSP90表达较矽肺模型8周组下降,其中HDAC6表达分别下调至矽肺模型8周组的87.07%和75.57%,HSP90分别下调至76.09%和69.29%,对照4周组、矽肺模型4周组、对照8周组、矽肺模型8周组、Ac-SDKP抗纤维化治疗组、Ac-SDKP预防治疗组的HDAC6、HSP90蛋白比较,经方差分析,差异有统计学意义(F =41.780和 30.893,均P =0.000)。α-SMA和I型胶原在矽肺模型组分别较相应时间点对照组表达增加,其中矽肺模型4周组α-SMA和I型胶原表达量是对照4周组的1.73和1.95倍,矽肺模型8周组α-SMA和I型胶原表达量是对照8周组的2.15和1.84倍;而Ac-SDKP抗纤维化治疗和预防治疗组α-SMA和I型胶原表达较矽肺8周组下降,α-SMA分别下调至矽肺8周组的65.31%和70.15%,I型胶原分别下调至矽肺8周组的77.67%和69.13%,对照4周组、矽肺模型4周组、对照8周组、矽肺模型8周组、Ac-SDKP抗纤维化治疗组、Ac-SDKP预防治疗组的α-SMA、I型胶原蛋白比较,经方差分析,差异有统计学意义(F =23.517和37.349,均P =0.000)。见表1和图4。
2.3 Ac-SDKP在TGF-β1诱导的肌成纤维细胞转分化过程中对HDAC6、HSP90的调节作用
Western blot结果显示,I型胶原、α-SMA、HDAC6和HSP90在TGF-β1诱导组较对照组表达增加,分别上调1.68、1.76、1.70和1.85倍;分别给予Ac-SDKP、TCS HDAC6 20b预处理后,与TGF-β1诱导组相比,I型胶原、α-SMA、HDAC6和HSP90表达下降,其中I型胶原的表达分别是TGF-β1诱导组的68.69%和60.59%,α-SMA的表达分别是TGF-β1诱导组的64.98%和56.10%,HDAC6的表达分别是TGF-β1诱导组的76.60%和61.81%,HSP90的表达分别是TGF-β1诱导组的56.16%和47.95%。对照组、TGF-β1诱导组、Ac-SDKP预处理组、TCS HDAC6 20b预处理组的I型胶原、α-SMA、HDAC6、HSP90蛋白比较,经方差分析,差异有统计学意义(F=72.707、55.804、29.799和81.115,均P=0.000)。见表2和图5。
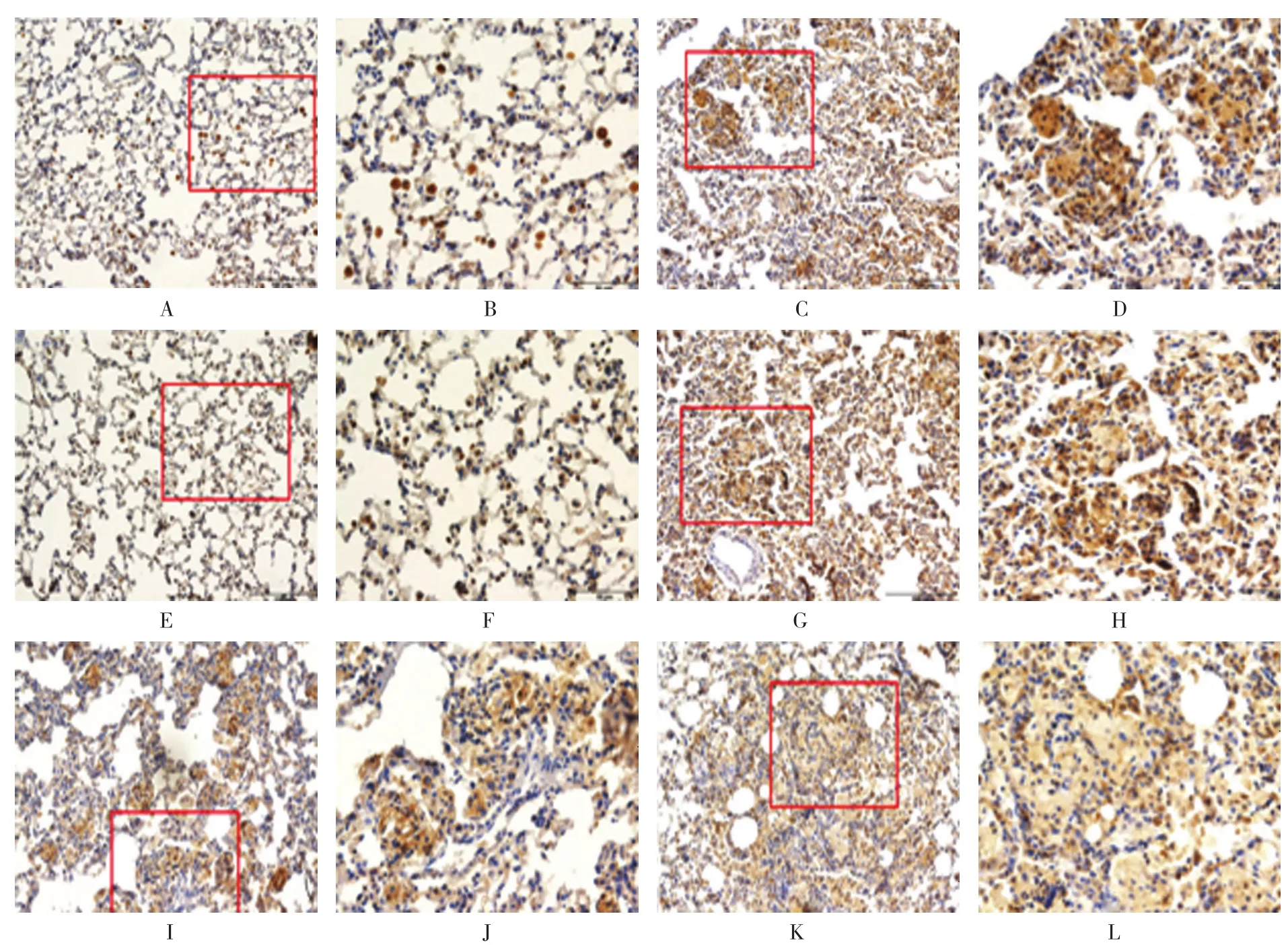
图3 HSP90在矽肺大鼠肺组织中的定位和表达 (免疫组织化学染色)
表1 Ac-SDKP对矽肺大鼠肺内Ⅰ型胶原、α-SMA、HDAC6及HSP90蛋白表达的调节 (n =4,±s)

表1 Ac-SDKP对矽肺大鼠肺内Ⅰ型胶原、α-SMA、HDAC6及HSP90蛋白表达的调节 (n =4,±s)
注:1)与对照4周组比较,P <0.05;2)与对照8周组比较,P <0.05;3)与矽肺8周组比较,P <0.05
组别 I型胶原 α-SMA HDAC6 HSP90对照4周组 0.553±0.056 0.488±0.048 0.445±0.057 0.553±0.062矽肺模型4周组 1.143±0.0611) 0.813±0.0831) 0.890±0.0551) 0.935±0.0581)对照8周组 0.695±0.122 0.400±0.111 0.515±0.069 0.495±0.066矽肺模型8周组 1.233±0.0622) 0.950±0.1082) 0.900±0.0722) 0.905±0.0692)Ac-SDKP抗纤维化治疗组 0.985±0.1013) 0.623±0.0743) 0.743±0.0573) 0.700±0.0573)Ac-SDKP预防治疗组 0.833±0.0913) 0.603±0.0623) 0.563±0.0423) 0.610±0.0823)F值 37.349 23.517 41.780 30.893 P值 0.000 0.000 0.000 0.000
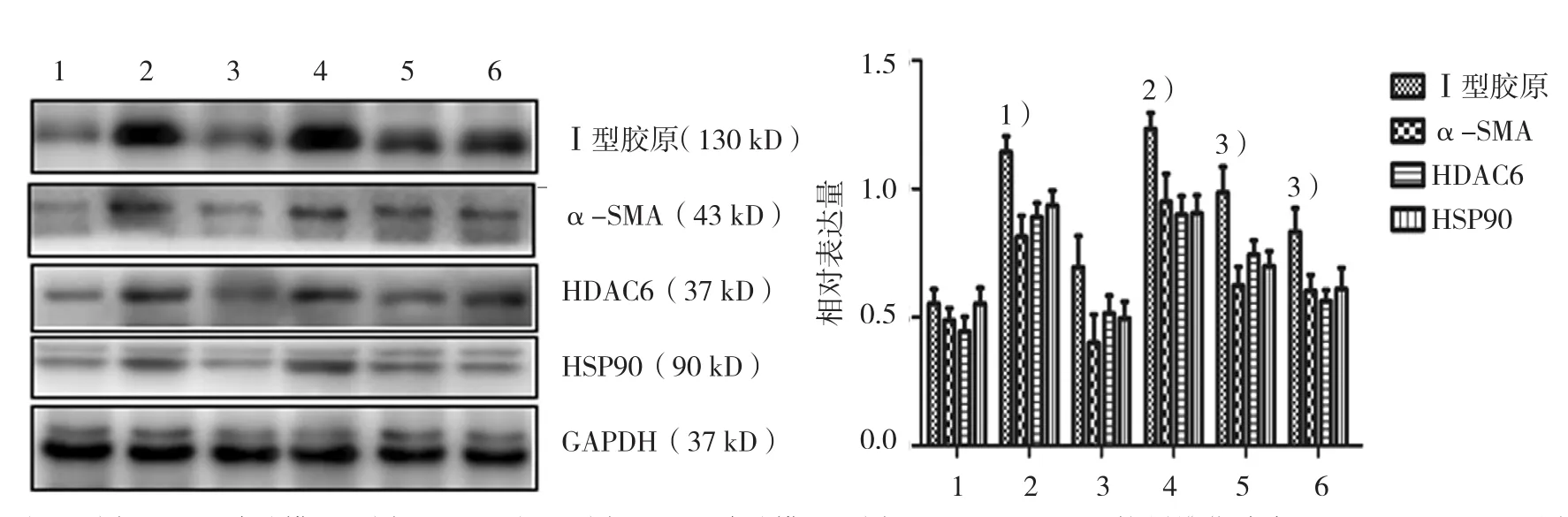
图4 Ⅰ型胶原、α-SMA、HDAC6及HSP90在肺组织中的表达
表2 Ac-SDKP对TGF-β1诱导的肌成纤维细胞Ⅰ型胶原、α-SMA、HDAC6及HSP90表达的调节作用 (n =4,±s)
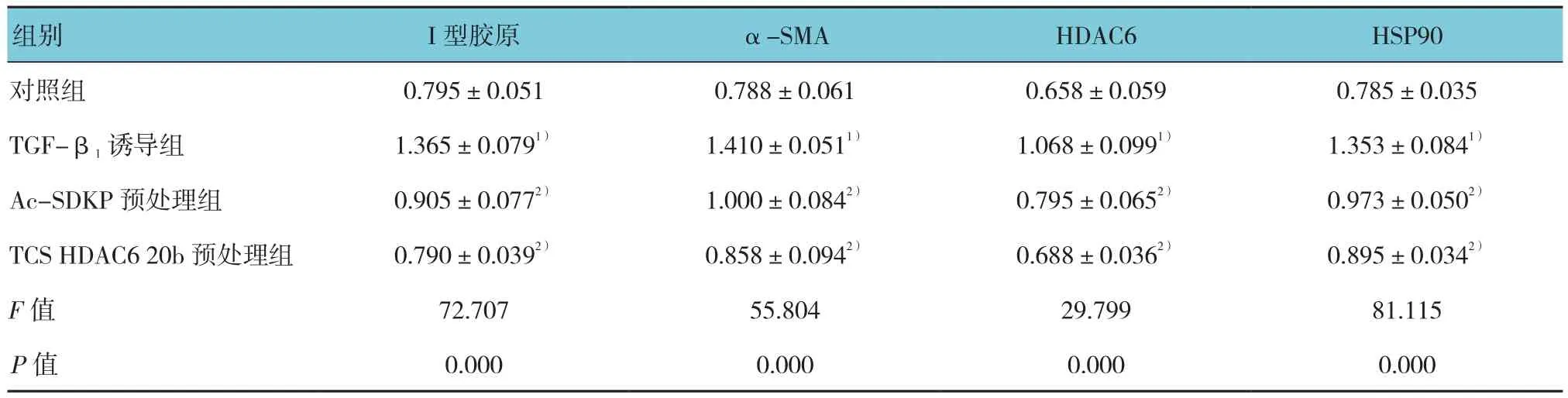
表2 Ac-SDKP对TGF-β1诱导的肌成纤维细胞Ⅰ型胶原、α-SMA、HDAC6及HSP90表达的调节作用 (n =4,±s)
注:1)与对照组比较,P <0.05;2)与TGF-β1诱导组比较,P <0.05
组别 I型胶原 α-SMA HDAC6 HSP90对照组 0.795±0.051 0.788±0.061 0.658±0.059 0.785±0.035 TGF-β1诱导组 1.365±0.0791) 1.410±0.0511) 1.068±0.0991) 1.353±0.0841)Ac-SDKP预处理组 0.905±0.0772) 1.000±0.0842) 0.795±0.0652) 0.973±0.0502)TCS HDAC6 20b预处理组 0.790±0.0392) 0.858±0.0942) 0.688±0.0362) 0.895±0.0342)F值 72.707 55.804 29.799 81.115 P值 0.000 0.000 0.000 0.000
3 讨论
Ac-SDKP是一种生理性造血系统的生长抑制因子。近年来研究表明,Ac-SDKP在诸多器官纤维化动物模型(心、肾、肺、肝)中,Ac-SDKP均能够抑制靶器官胶原的沉积,减轻致病因素导致的器官纤维化的程度[8-10]。本课题组前期研究发现,Ac-SDKP能够调节α-Ac-Tub信号,发挥抑制矽肺大鼠肌成纤维细胞分化和胶原沉积的作用[2]。作为调节α-Tub去乙酰化的主要蛋白,HDAC6可被TGF-β1诱导并促进α-Ac-Tub的去乙酰化,参与上皮-间质转化的调控,而抑制HDAC6的表达,能够阻断TGF-β1/Smad3信号的活化[11-12]。ROCK信号活化能够磷酸化TPPP1,使其失去对HDAC6的抑制作用,促进α-Tub的去乙酰化,从而诱导细胞增殖、侵袭及迁移[13-14]。HDAC6基因敲除或HDAC6选择性抑制剂Tubastatin A,能够改善Ang Ⅱ诱导的心肌肥大和纤维化程度,并维持心肌收缩能力和左心室功能,起到一定的心血管保护作用[15]。提示针对HDAC6信号的阻断能够发挥拮抗器官纤维化的作用。而HSP90是HDAC6的经典下游底物,可由HDAC6脱乙酰化而激活[16]。HSP90抑制剂17-AAG能够抑制TGF-β1信号的活化,从而减轻肾纤维化病变程度[17],同时还能够抑制氧化应激损伤,改善硫代乙酰胺所致的肝损伤,降低星状细胞活性[18]。然而,Ac-SDKP是否能够通过调节HDAC6及其特异底物HSP90信号,并发挥相应的抗纤维化作用,目前仍不清楚。
本实验免疫组织化学法结果显示,在α-SMA阳性表达的矽结节和间质纤维化区域,HADC6和HSP90表达增强。Western blot检测结果也显示,与对照组相比,矽肺模型4和8周组的α-SMA、I型胶原、HADC6、HSP90的蛋白表达量增加。体外实验结果显示,TGF-β1诱导刺激成纤维细胞可增强HADC6和HSP90蛋白的表达,同时伴随着肌成纤维细胞分化和I型胶原的合成,而TCS HDAC6 20b预处理组与TGF-β1诱导组比较,α-SMA、I型胶原、HDAC6和HSP90表达均下调,阻断了肌成纤维细胞分化。提示,针对HDAC6信号的阻断,能够抑制肌成纤维细胞分化和胶原沉积,其可能是器官纤维化的一个新的靶向治疗方法。
进一步研究发现,给予Ac-SDKP抗纤维化治疗和预防后,能够逆转HADC6和HSP90水平的升高,从而抑制TGF-β1诱导的肌成纤维细胞分化和I型胶原蛋白的表达。提示Ac-SDKP能够通过对HADC6和HSP90蛋白信号的阻断,从而抑制肌成纤维细胞分化和胶原沉积,这可能是Ac-SDKP抗矽肺纤维化作用新的机制之一。
[1]王娟. 珐菲亚参胶囊辅助大容量全肺灌洗术治疗煤工尘肺的临床效果观察[J]. 现代医学, 2016, 44(2): 239-241.
[2]李世峰, 高学敏, 徐丁洁, 等. A-SDKP调节乙酰化微管蛋白α抑制矽肺肌成纤维细胞转分化的研究[J]. 中华劳动卫生职业病杂志, 2015, 33(11): 816-821.
[3]MOBLEY R J, RAGHUd,dUKE Ld, et al. MAP3K4 controls the chromatin modifier HDAC6during trophoblast stem cell epithelial-to-mesenchymal transition [J]. Cell Rep, 2017, 18(10): 2387-2400.
[4]dEMOS-DAVIES K M, FERGUSON B S, CAVASIN M A, et al. HDAC6 contributes to pathological responses of heart and skeletal muscle to chronic angiotensin-II signaling[J]. Am J Physiol Heart Circ Physiol, 2014, 307(2): H252-H258.
[5]SKOGE R H, ZIEGLER M. SIRT2 inactivation reveals a subset of hyperacetylated perinuclear microtubules inaccessible to HDAC6[J]. J Cell Sci, 2016, 129(15): 2972-2982.
[6]dESKIN B, LASKY J, ZHUANG Y, et al. Requirement of HDAC6 for activation of Notch1 by TGF-β1[J]. 2016, 8(6): 31086.
[7]TAO H, YANG J J, SHI K H, et al. Epigenetic factors MeCP2 and HDAC6 control alpha-tubulin acetylation in cardiac fibroblast proliferation and fibrosis[J]. In flamm Res, 2016, 65(5): 415-426.
[8]GONZÁLEZ G E, RHALEB N E, NAKAGAWA P, et al. N-acetylseryl-aspartyl-lysyl-proline reduces cardiac collagen cross-linking and inflammation in angiotensin II-induced hypertensive rats[J]. Clin Sci (Lond), 2014, 126(1): 85-94.
[9]ZUO Y, CHUN B, POTTHOFF S A, et al. Thymosin β4 and itsdegradation product, Ac-SDKP, are novel reparative factors in renal fibrosis[J]. Kidney Int, 2013, 84(6): 1166-1175.
[10]ZHANG L, XU L M, CHEN Y W, et al. Antifibrotic effect of N-acetyl-seryl-aspartyl-lysyl-proline on bileduct ligation induced liver fibrosis in rats[J]. World J Gastroenterol, 2012, 18(37): 5283-5288.
[11]WANG Z, CHEN C, FINGER S N, et al. Suberoylanilide hydroxamic acid: a potential epigenetic therapeutic agent for lung fibrosis[J]. Eur Respir J, 2009, 34(1): 145-155.
[12]HASHIMOTO-KOMATSU A, HIRASE T, ASAKA M, et al. Angiotensin II induces microtubule reorganization mediated by adeacetylase SIRT2 in endothelial cells[J]. Hypertens Res, 2011, 34(8): 949-956.
[13]SCHOFIELD A V, STEEL R, BERNARD O. Rho-associated coiled-coil kinase (ROCK) protein controls microtubuledynamics in a novel signaling pathway that regulates cell migration[J]. The Journal of Biological Chemistry, 2012, 287(52): 43620-43629.
[14]SCHOFIELD A V, GAMELL C, SURYADINATA R, et al. Tubulin polymerization promoting protein 1 (Tppp1) phosphorylation by Rho-associated coiled-coil kinase (rock) and cyclin-dependent kinase 1 (Cdk1) inhibits microtubuledynamics to increase cell proliferation[J]. The Journal of Biological Chemistry, 2013, 288(11): 7907-7917.
[15]WILLIAMS K A, ZHANG M, XIANG S Y, et al. Extracellular signal-regulated kinase (ERK) phosphorylates histonedeacetylase 6 (HDAC6) at serine 1035 to stimulate cell migration[J]. J Biol Chem, 2013, 288(46):dOI: 10.1074/jbc.M113.472506.
[16]JOSHI Ad, BARABUTIS N, BIRMPAS C, et al. Histonedeacetylase inhibitors prevent pulmonary endothelial hyperpermeability and acute lung injury by regulating heat shock protein 90 function[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(12): L1410-1419.
[17]NOH H, KIM H J, YU M R, et al. Heat shock protein 90 inhibitor attenuates renal fibrosis throughdegradation of transforming growth factor-beta type II receptor[J]. Laboratory Investigation, 2012, 92(11): 1583-1596.
[18]ABU-ELSAAD N M, SERRYA M S, EL-KAREF A M, et al. The heat shock protein 90 inhibitor, 17-AAG, attenuates thioacetamide induced liver fibrosis in mice[J]. Pharmacological Reports, 2016, 68(2): 275-282
Effect of Ac-SDKP on expressions of HDAC6 and HSP90 in lungs of rats with silicosis*
Hong-lei Li1,ding-jie Xu2,di-li Guo1, Yu-cong Geng1, Xue-min Gao1, Shi-feng Li1, Hong Xu1,
Fang Yang1, Zhong-qiu Wei3
(1. Medical Research Center, 2. Institute of Traditional Chinese Medicine, 3.department of Pathology, North China University of Science and Technology, Tangshan, Hebei 063210, China)
ObjectiveTo investigate the effect of N-acetyl-seryl-aspartyl-lysyl-proline (Ac-SDKP) on the expressions of histonedeacetylase 6 (HDAC6) and heat shock protein 90 (HSP90) in the process of fibroblast differentiation.MethodsRats were instilled with silica through trachea to establish silicotic models. The rats weredivided into 4-week control group, 4-week silicosis group, 8-week control group, 8-week silicosis group, Ac-SDKP treatment group and Ac-SDKP pre-treatment group. Myofibroblasts induced by TGF-β1 were pretreated with TCS HDAC6 20b, the specific inhibitor of Ac-SDKP and HDAC6. Routine HE staining was used to observe the pathomorphology. The expressions of α-SMA, collagen I, HDAC6 and HSP90 were measured by immunohistochemistry and Western blot.ResultsThe expressions of HDAC6 and HSP90 were increased in the silicotic nodules of the rat lungs; upon the treatment or pre-treatment with Ac-SDKP, the expressions of collagen I, α-SMA, HDAC6 and HSP90 weredecreased. TGF-β1 induced the α-SMA expression in rat fibroblasts and up-regulated the expressions of HDAC6 and HSP90; moreover, pre-treatment with Ac-SDKP or TCS HDAC6 20b inhibited the TGF-β1-induced expressions of these factors.ConclusionsAc-SDKP inhibits myofibroblast differentiation and collagendeposition, which is related with regulation of HDAC6 and HSP90.
N-acetyl-seryl-aspartyl-lysyl-proline; fibrosis; HDAC6; HSP90
10.3969/j.issn.1005-8982.2018.02.001
1005-8982(2018)02-0001-07
R135.2
A
2016-11-29
国家自然科学基金(No:81472953);河北省自然科学基金(No:H2016209107);华北理工大学大学生创新项目(No:X2016315)
魏中秋,E-mail:wzq3725185@163.com
(童颖丹 编辑)
