维拉帕米介导食管癌细胞多药耐药及细胞凋亡的实验研究
2018-01-09翁呈韬张腾跃刘亚贝樊高飞范平生
翁呈韬, 张腾跃, 刘亚贝, 樊高飞, 吴 旸 ,范平生
(安徽省肿瘤医院 肿瘤内科, 安徽 合肥, 230031)
论著
维拉帕米介导食管癌细胞多药耐药及细胞凋亡的实验研究
翁呈韬, 张腾跃, 刘亚贝, 樊高飞, 吴 旸 ,范平生
(安徽省肿瘤医院 肿瘤内科, 安徽 合肥, 230031)
目的探讨维拉帕米提高食管癌化疗药物敏感性及促进细胞凋亡的影响。方法采用CCK-8法检测紫杉醇、顺铂、5-氟尿嘧啶对于4种食管癌细胞系(EC109、EC9706、KYSE-450、TE-1)的IC50值(IC501); 用维拉帕米(4.91 μg/mL)联合上述化疗药物处理每种细胞, CCK8法检测维拉帕米联合上述化疗药物针对上述4种食管癌细胞株(EC109, EC9706, KYSE-450和TE-1) IC50值(IC502); 以前期实验得出的VER逆转化疗耐药能力差异最为显著的一对食管癌细胞为研究对象, Annexin V-PI双染法检测食管癌细胞凋亡。结果紫杉醇在KYSE-450和EC9706的IC50值明显大于EC109和TE-1, 顺铂在TE-1细胞中IC50值明显小于其他3种细胞, 5-氟尿嘧啶在EC109中IC50值明显高于在其他3种细胞。加用维拉帕米后, 4种食管癌细胞系(EC109, EC9706, KYSE-450和TE-1)针对紫杉醇、顺铂、5-氟尿嘧啶的IC50值均不同程度下降,提示维拉帕米均不同程度提高了上述3种化疗药物的敏感性。其中,顺铂组未加入维拉帕米前, EC109, EC9706, KYSE-450与TE-1相比,均存在不同程度耐药性,加入维拉帕米后,针对EC9706 IC50值变化倍数较大(15.2倍),提示逆转敏感; 针对EC109IC50值变化倍数较小(1.6倍),提示逆转耐受。结论维拉帕米逆转EC9706的阿霉素效率指数最高(15.2倍),与EC109细胞相比有显著性差异(1.6倍)。提示EC9706(DDP)对维拉帕米的逆转敏感,而EC109(DDP)对维拉帕米的逆转耐受。维拉帕米有可能通过促进细胞调亡途径提高其逆转化疗耐受的能力,从而增强化疗药物敏感性。
维拉帕米; 食管癌; 耐药性; 逆转能力; 细胞凋亡
食管癌是临床上常见的消化系统恶性肿瘤之一, 50%~60%的患者已为晚期肿瘤, 5年生存率仅为14%, 若存在远处转移,其1年内总体生存率不足50%[1]。晚期食管癌患者多釆用化疗、放疗结合手术的综合治疗,化疗在其中起着重要的作用[2]。现有的化疗药物主要包括顺铂、5-氟尿嘧啶、紫杉类、去甲长春新碱、依立替康、希罗达等,多采用联合化疗的方法[3-4]。维拉帕米是一种临床用于心脏疾患的钙离子通道阻滞剂,研究[5-6]表明其具有逆转肿瘤细胞多药耐药(MDR)的作用。为探讨维拉帕米逆转食管癌细胞的化疗耐药性,本研究拟通过检测维拉帕米改变3种化疗药物(紫杉醇、顺铂、5-氟尿嘧啶)对4种食管癌细胞株(EC109、EC9706、KYSE-450、TE-1)的IC50值的影响,筛选出维拉帕米逆转敏感和逆转耐受细胞株及对应用的化疗药物,现报告如下。
1 材料与方法
1.1 细胞株及实验材料
食管癌细胞株(EC109、EC9706、KYSE-450、TE-1)由本科实验室留存; 紫杉醇(PTX, 扬子江药业, 60 mg/支),顺铂(DDP,江苏豪森, 30 mg/支), 5-氟尿嘧啶(5-FU, 江苏南通精华制药, 0.25 g/10 mL), 维拉帕米(Verapamil, 上海禾丰制药, 5 mg/2 mL), 由本院药剂科提供; CCK-8试剂盒购自日本同仁化学研究所; V-PI双染细胞凋亡试剂盒购自武汉碧云天生物科技公司。
1.2 实验方法
1.2.1 细胞培养: 人食管癌细胞株以含10%FCS的高糖DMEM培养液,在37 ℃、5% CO2及饱和湿度条件下进行常规培养,用0.25%胰酶消化处理对数生长期的人食管癌细胞株细胞, 24 h换液,当细胞呈单层致密状分布时,用PBS冲洗, 0.25%胰蛋白酶消化后以1∶3传代,取对数生长期的细胞进行实验。
1.2.2 化疗药物及维拉帕米给药浓度: 化疗药物进行1∶4或1∶5稀释,5-FU终浓度设置为200、40、8、1.6和0.32 μg/mL; DDP设置为0.25、1、4、16、64 μg/mL; 紫杉醇为0.25、1、4、16、64 μg/mL; 维拉帕米设置为1.5、3.0、6.0、12.0、24.0 μg/mL 的5个浓度梯度。
1.2.3 4种食管癌细胞系化疗药物耐药特性的测定: 取对数生长期食管癌细胞 , 0.25%胰酶消化后用高糖DMEM制成单细胞悬液, 2×105个/mL细胞密度接种于96孔培养板中(100 μL/孔),置37 ℃, 5%CO2孵箱内培养12 h。加入用高糖DMEM稀释的不同浓度的化疗药物,每个剂量设3个复孔(对照组分为PBS处理组和空白对照组),培养72 h后,再加入CCK8试剂(10 μL/孔),培养1 h后,以PBS处理组为对照,测定每组的OD450值,以药物浓度为横轴, OD450为纵轴,绘制浓度-效应曲线,确定半数抑制浓度(IC501)。实验至少重复3次。
1.2.4 维拉帕米逆转肿瘤细胞耐药实验: 用固定浓度的维拉帕米(4.91 μg/mL)联合化疗药物处理每种细胞, CCK8法检测该化疗药物针对4种食管癌细胞系(EC109、EC9706、KYSE-450、TE-1) IC50值(IC502)。
1.2.5 维拉帕米逆转化疗药物耐药能力判定: 维拉帕米逆转化疗药物耐药效率指数,以IC501/IC502结果判定,值越大说明能力越强。
1.2.6 Annexin V-PI双染法检测食管癌细胞凋亡率: 本研究以实验步骤1.2.5得出的VER逆转ADM化疗耐药能力差异最为显著的一对食管癌细胞为对象进行细胞凋亡检测,每个细胞分成4组,即正常组(NC)、单用VER组(VER)、单用化疗药物组、VER联合化疗药物组,考虑化疗药物毒性及后续实验,化疗药物剂量选择该细胞株IC501值1/5倍浓度,VER剂量4.91 μg/mL。
采用10%FBS的RMPI-1640在6孔板中培养细胞24 h至汇合度为70%左右,胰酶消化后用10%FBS的培养基终止胰酶作用, 1 000 r/min、4 ℃离心5 min, 并用预冷的PBS清洗2次,将细胞重悬于100 μL binding buffer, 再加入 2 μL的 Annexin V-FITC, 混匀,避光于冰上放置15 min, 加入400 μL PBS,每个样品在临上流式细胞仪前再加1 μL的PI溶液,吹匀后迅速检测食管癌细胞凋亡率。
1.3 统计学分析
连续型变量以均数±标准差进行统计学描述,数据分析采用Excel (Microsoft, Redmond, WA) 或者 Prism (Prism 4.0, GraphPad Inc, La Jolla, CA, USA)进行单因素方差分析或者Mann-Whitney U检验,实验均重复3次以上,P<0.05为差异有统计学意义
2 结 果
2.1 4种食管癌细胞系对紫杉醇、顺铂、5-氟尿 嘧啶耐药性判定的分析
作者通过CCK-8分析法对4种食管癌细胞系(EC109、EC9706、KYSE-450、TE-1)对3种化疗药物(紫杉醇、顺铂、5-氟尿嘧啶)IC50实验结果显示,紫杉醇在KYSE-450和EC9706的IC50值明显大于EC109和TE-1, 顺铂在TE-1细胞中IC50值明显小于其他3种细胞, 5-氟尿嘧啶在EC109中IC50值明显高于在其他3种细胞。KYSE-450和EC9706对紫杉醇耐药性大于EC109和TE-1; BEL-EC9706、EC109、KYSE-450对顺铂耐药性大于TE-1, EC109对5-氟尿嘧啶耐药性显著大于其他3种细胞。见表1、2。

表1 3种化疗药物对4种食管癌细胞系IC501值

表2 3种化疗药物对4食管癌细胞系IC50相对值
2.2 3种化疗药物分别联合维拉帕米逆转食管 癌细胞化疗耐药特性的判定
为了研究维拉帕米逆转食管癌耐药性的机制,作者需要选择维拉帕米逆转效果最好的食管癌细胞系及对应的化疗药物作为研究对象。因此,作者用固定浓度的维拉帕米(4.91 μg/mL)联合化疗药物处理每种细胞, CCK8法检测固定浓度的维拉帕米联合化疗药物针对4种食管癌细胞系(EC109, BEL-EC9706, KYSE-450和TE-1) IC50值。研究发现,加用维拉帕米后, 4种食管癌细胞系(EC109, BEL-EC9706, KYSE-450和TE-1)针对紫杉醇、顺铂、5-氟尿嘧啶的IC50值均不同程度下降,提示维拉帕米均不同程度提高了上述3种化疗药物的敏感性。见表3。

表3 维拉帕米(4.91 μg/mL)联合化疗药物对4食管癌细胞系IC502值
2.3 维拉帕米逆转化疗药物耐药能力判定
维拉帕米逆转化疗药物耐药效率指数,以IC501/IC502结果判定,值越大说明能力越强。其中,顺铂组未加入维拉帕米前, EC109, EC9706, KYSE-450与TE-1相比,均存在不同程度耐药性; 加入维拉帕米后,针对BEL-EC9706 IC50值变化倍数较大(15.2倍),提示逆转敏感; 针对EC109IC50值变化倍数较小(1.6倍),提示逆转耐受。结果表明,维拉帕米逆转EC9706的顺铂效率指数最高(15.2倍),与EC109细胞相比有显著差异(1.6倍)。提示BEL-EC9706(顺铂)对维拉帕米的逆转敏感,而EC109(顺铂)对维拉帕米的逆转耐受。见表4。

表4 维拉帕米逆转化疗药物耐药效率指数(IC501/IC502)
2.4 Annexin V-PI双染法检测食管癌细胞凋亡
本研究以实验2.3得出的VER逆转顺铂化疗耐药能力差异最为显著的一对食管癌细胞(EC109和EC9706)为研究对象检测食管癌细胞凋亡,如图1所示,针对EC109细胞,NC组、VER组、DDP组、VER+DDP组细胞凋亡分别为2.1%、4%、15.4%、18.6%; 针对EC9706细胞, NC组、VER组、DDP组、VER+DDP组细胞凋亡分别为0.1%、3.1%、12.5%、22.1%。如图2所示,与NC组相比, VER组细胞凋亡率无显著差异(P>0.05); 针对EC109细胞, DDP组与VER+DDP组相比,细胞凋亡率有显著差异(P<0.05), 针对EC9706细胞, DDP组与VER+DDP组相比,细胞凋亡率有显著差异(P<0.01)。这说明,维拉帕米有可能通过促进细胞调亡途径提高其逆转化疗耐受的能力,从而增强化疗药物敏感性。
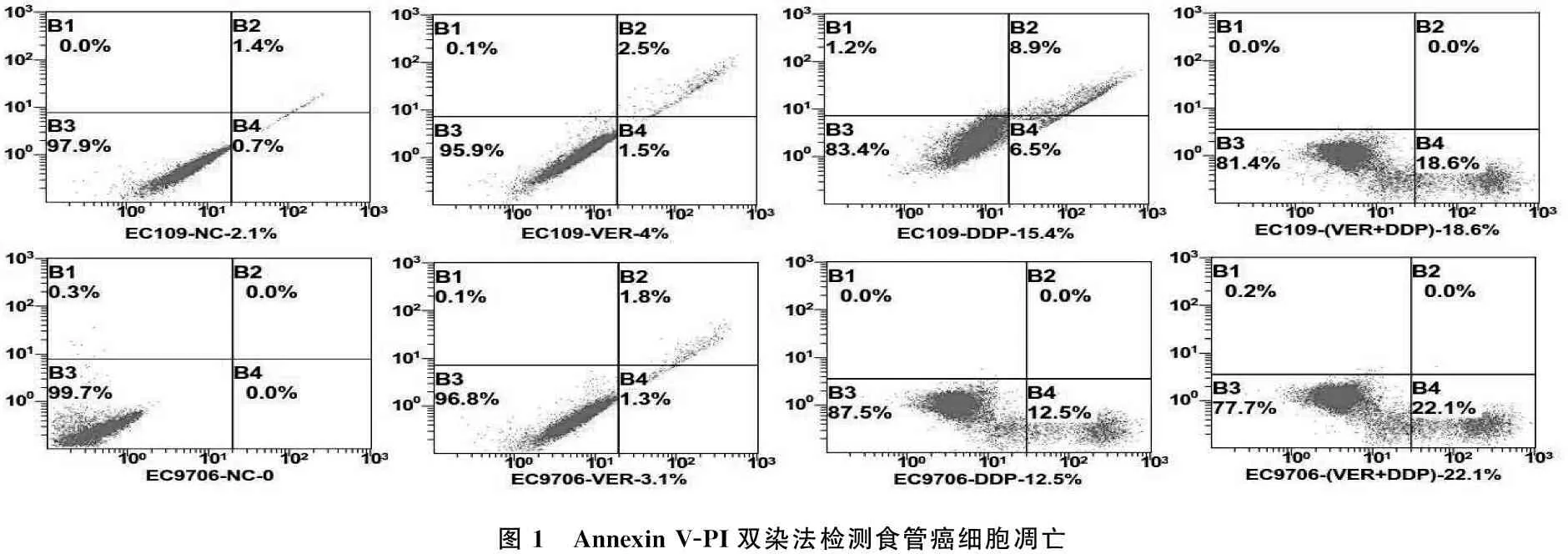
图1 AnnexinV-PI双染法检测食管癌细胞凋亡
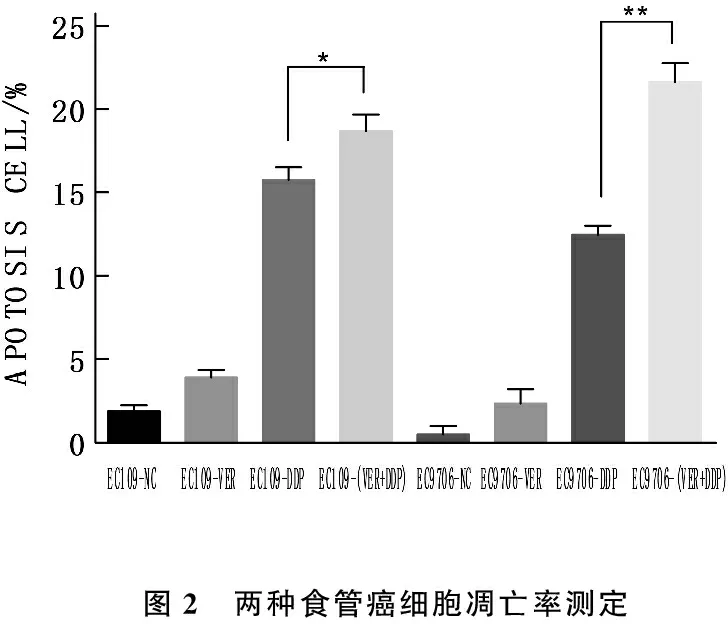
图2 两种食管癌细胞凋亡率测定
3 讨 论
食管癌是世界上最常见的恶性肿瘤之一[7], 中国则是世界上食管癌发病率和死亡率最高的国家,每年新发病例约25万,占全世界新发病例的50%以上[8]。目前化疗是晚期食管癌最主要的治疗手段之一,但化疗过程中出现的多药耐药(MDR)现象严重影响了临床的化疗效果。作者通过CCK-8分析法对4种食管癌细胞系(EC109、EC9706、KYSE-450、TE-1)对3种化疗药物(紫杉醇、顺铂、5-氟尿嘧啶)IC50实验结果显示,紫杉醇在KYSE-450和EC9706的IC50值明显大于EC109和TE-1, 顺铂在TE-1细胞中IC50值明显小于其他3种细胞, 5-氟尿嘧啶在EC109中IC50值明显高于在其他3种细胞。KYSE-450和EC9706对紫杉醇耐药性大于EC109和TE-1; EC9706、EC109、KYSE-450对顺铂耐药性大于TE-1, EC109对5-氟尿嘧啶耐药性显著大于其他3种细胞。这说明,食管癌细胞对不同化疗药物存在不同程度的耐药性。
维拉帕米静脉应用导致的心血管毒性限制了其作为一种逆转化疗耐药的药物的临床应用,我课题组通过动脉介入灌注维拉帕米联合化疗药物,明显提高了临床疗效,且未见明显心血管毒副反应,但仍有部分患者疗效欠佳[9-13], 这说明,不同患者对维拉帕米的治疗反应是不同的,这可能与维拉帕米逆转不同食管癌细胞的能力有明显差异相关。本研究以4种食管癌细胞株为研究对象,开展维拉帕米提高食管癌细胞的化疗敏感性的研究。研究[14-16]发现,加用维拉帕米后, 4种食管癌细胞系(EC109, EC9706, KYSE-450和TE-1)针对紫杉醇、顺铂、5-氟尿嘧啶的IC50值均不同程度下降,提示维拉帕米均不同程度提高了上述3种化疗药物的敏感性。其中,顺铂组未加入维拉帕米前, EC109, EC9706, KYSE-450与TE-1相比,均存在不同程度耐药性,加入维拉帕米后,针对BEL-EC9706 IC50值变化倍数较大(15.2倍),提示逆转敏感; 针对EC109 IC50值变化倍数较小(1.6倍),提示逆转耐受。结果表明,维拉帕米逆转EC9706的顺铂效率指数最高(15.2倍),与EC109细胞相比有显著性差异(1.6倍)。提示BEL-EC9706(顺铂)对维拉帕米的逆转敏感,而EC109(顺铂)对维拉帕米的逆转耐受。
为进一步探讨维拉帕米提高化疗药物敏感性可能机制,作者以VER逆转顺铂化疗耐药能力差异最为显著的一对食管癌细胞(EC109和EC9706)为研究对象检测食管癌细胞凋亡,针对EC109细胞, NC组、VER组、DDP组、VER+DDP组细胞凋亡分别为2.1%、4%、15.4%、18.6%; 针对EC9706细胞, NC组、VER组、DDP组、VER+DDP组细胞凋亡分别为0.1%、3.1%、12.5%、22.1%。针对EC109细胞, DDP组与VER+DDP组相比,细胞凋亡率有显著性差异(P<0.05), 针对EC9706细胞, DDP组与VER+DDP组相比,细胞凋亡率有显著性差异(P<0.01), 这说明,维拉帕米有可能通过促进细胞调亡途径提高其逆转化疗耐受的能力,从而增强化疗药物敏感性。
总之,维拉帕米逆转EC9706的顺铂效率指数最高(15.2倍),与EC109细胞相比有显著性差异(1.6倍)。提示EC9706(DDP)对维拉帕米的逆转敏感,而EC109(DDP)对维拉帕米的逆转耐受。维拉帕米有可能通过促进细胞调亡途径提高其逆转化疗耐受的能力,从而增强化疗药物敏感性。
[1] Tomaszek S, Cassivi S D. Esophagectomy for the treatment of esophageal cancer[J]. Gastroenterol Clin North Am, 2009, 38(1): 169-81.
[2] ValverdeC M, Macarulla T, Casado E, et al. Novel targets in gastric and esophageal cancer[J]. Crit Rev Oncol Hematol, 2006, 59(2): 128-38.
[3] McCabe M L, DIamini Z. The molecular mechanisms of oesophageal cancer[J]. Int Immunopharmacol, 2005, 5(7/8): 1113-30.
[4] 孔帅, 李乐平, 靖昌庆. 消化道恶性肿瘤多药耐药机制的研究进展[J]. 中国现代普通外科进展, 2009, 12(8): 706-709.
[5] Baumert C, Hilgeroth A. Recent advances in the development of P-gp inhibitors. Anticancer Agents Med Chem, 2009, 9(4): 415-36.
[6] Dönmez Y, Akhmetova L,seri ÖD, et al. Effect of MDR modulators verapamil and promethazine on gene expression levels of MDR1 and MRP1 in doxorubicin-resistant MCF-7 cells[J]. Cancer Chemother Pharmacol, 2010, 67(4): 823-8.
[7] Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[8] Ke L. Mortality and incidence trends from esophagus cancer in selected geographic areas of China circa 1970-90[J]. Int J Cancer, 2002, 102(3): 271-274.
[9] Pingsheng F, Tengyue Z, Qiang H, et al. Basic and clinical research on the therapeutic effect of intervention in primary liver cancer by targeted intra-arterial verapamil infusion[J]. Cell Biochem Biophys, 2011, 62(1): 59-67.
[10] Huang J, Duan Q, Fan P, et al. Clinical evaluation of targeted arterial infusion of verapamil in the interventional chemotherapy of primary hepatocellular carcinoma[J]. Cell Biochem Biophys, 2011, 59(2): 127-32.
[11] Liu Y, Lu Z, Fan P, et al. Clinical Efficacy of Chemotherapy Combined with Verapamil in Metastatic Colorectal Patients[J]. Cell Biochem BiopHys, 2011, 61(2): 393-8.
[12] Ning Z, Chen D, Liu A, et al. Efficacy of Chemotherapy Combined with Targeted Arterial Infusion of Verapamil in Patients with Advanced Gastric Cancer[J]. Cell Biochem Biophys, 2013: 311-8.
[13] Jia W, Zhu Z, Zhang T, et al. Treatment of malignant ascites with a combination of chemotherapy drugs and intraperitoneal perfusion of verapamil[J]. Cancer Chemother Pharmacol, 2013, 71(6): 1585-90.
[14] 刘晓滨, 祁丽, 张文轩. 黄芪多糖逆转Ec109/DDP食管癌细胞顺铂耐药的可能机制[J]. 癌症进展, 2017, 15(1): 29-31.
[15] 李敏, 轩小燕, 黄玉敏, 等. 药物诱导与耐药基因转染两种方法建立的人食管癌顺铂耐药细胞系的比较[J]. 广东医学, 2012, 33(6): 726-729.
[16] 唐悦, 龚光明, 柳璐璐, 等. GST-π表达水平与人食管鳞癌耐顺铂的关系研究[J]. 中国现代医学杂志, 2014, 24(8): 30-34.
Experimentalstudyofverapamilmediatedapoptosisofesophagealcancercellsandmulti-drugresistance
WENGChengtao,ZHANGTengyue,LIUYabei,FANGaofei,WUYang,FANPingsheng
(DepartmentofOncology,AnhuiTumorHospital,Hefei,Anhui, 230031)
ObjectiveTo investigate the effect of verapamil on chemosensitivity and apoptosis of esophageal cancer cells.MethodsThe IC50values(IC501) of three kinds of chemotherapy drugs: paclitaxel, cisplatin, and 5-fluorouracil were detected by CCK-8 method in 4 kinds of esophageal cancer cell lines (EC109, EC9706, KYSE-450, TE-1). Each cell was processed by verapamil (4.91 μg/mL) combined with the chemotherapy treatment above, IC50(IC502) value was detected by CCK8 assay combined with chemotherapy for the verapamil of the 4 esophageal carcinoma cell lines (EC109, EC9706, KYSE-450 and TE-1). A pair of esophageal cancer cells with the most significant reversal of the resistance to chemotherapy by VER detected by the previous experiments were included as research objects, and Annexin V-PI double staining method was used to detect the apoptosis of esophageal cancer cells.ResultsThe IC50values of paclitaxel in KYSE-450 and EC9706 cell lines were significantly higher than that in EC109 and TE-1. The IC50values of cisplatin in TE-1 cells were significantly less than those in the other three cells, while the IC50values of 5-fluorouracil in EC109 were significantly higher than that in other three cell lines. After adding verapamil, the IC50values of paclitaxel, cisplatin and 5-fluorouracil in four esophageal cancer cell lines (EC109, EC9706, KYSE-450 and TE-1) all decreased to different degrees, and the above three kinds of chemotherapeutic drugs had increased their sensitivity to varying degrees. Among them, the cisplatin group before adding verapamil had different degrees of resistance compared with EC109, EC9706, KYSE-450, TE-1. After joining verapamil, IC50value change for the EC9706 multiplied for 15.2 times, suggesting that the reversal was sensitive; IC50value change for EC109 was 1.6 times smaller, suggesting that the reversal was tolerant.ConclusionVerapamil reversal of EC9706 adriamycin has highest efficiency index (15.2 times), there was significant difference compared with the EC109 cells (1.6 times). Tipthe EC9706 (DDP) sensitivity to the reversal of verapamil, and EC109 (DDP) reverse resistance of verapamil. Verapamil may enhance the ability to reverse chemotherapy tolerance by promoting cell apoptosis, thereby enhancing the sensitivity of chemotherapeutic drugs.
verapamil; esophageal cancer; drug resistance; reversal ability, apoptosis
2017-07-20
国家自然基金(81172364, 81201576); 安徽省自然科学基金(1408085MH211);安徽省卫生厅重点科研项目(2010A006)
范平生
R 735.1
A
1672-2353(2017)24-001-05
10.7619/jcmp.201724001
