芍药愈伤组织中体细胞胚发育过程的组织细胞学观察
2018-01-09魏冬霞郑严仪于晓南
魏冬霞 张 滕 郑严仪 于晓南
(北京林业大学园林学院/国家花卉工程技术研究中心,北京 100083)
芍药愈伤组织中体细胞胚发育过程的组织细胞学观察
魏冬霞 张 滕 郑严仪 于晓南*
(北京林业大学园林学院/国家花卉工程技术研究中心,北京 100083)
以芍药(PaeonialactifloraPall.)3个芍药品种的茎段、叶片、叶柄为外植体,诱导体细胞胚发生,并采用石蜡切片法对该发育过程进行组织细胞学观察。结果表明:‘Going Bananas’的茎段愈伤诱导率达100%,增殖率在4.0以上,表现最佳;非胚性愈伤组织最佳诱导、增殖培养基为WPM+IAA 1.0 mg·L-1+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1+TDZ 0.5 mg·L-1+CH 0.625 g·L-1;愈伤组织转入到1/2 MS(Ca2+加倍)+2,4-D 2.0 mg·L-1+ABA 0.5 mg·L-1或ZT 1.0 mg·L-1的培养基中,连续暗培养90后得到胚性愈伤;之后转入到成熟培养基1/2MS(Ca2+加倍)+6-BA 1.0 mg·L-1+NAA 0.2 mg·L-1中,见光培养60 d,逐渐发育至球形胚和心形胚。在石蜡切片观察中,芍药的体细胞胚起源方式包括外起源和内起源两个途径。在外起源方式中包括单个表层细胞的外起源和多个表层下细胞的共同起源。3种方式的区别主要在于起始的位置和起始细胞数量,后期均形成原胚结构。胚性细胞的分裂方式为对称分裂,未发现不对称分裂细胞的存在。
芍药;体细胞胚;起源方式;组织细胞学
芍药(PaeonialactifloraPall.)为芍药科(Paeoniaceae)芍药属(Paeonia)多年生宿根草本植物,是中国传统名花,已有4 000多年的栽培历史[1]。其传统繁殖方法主要集中在分株和播种上,但繁殖方法效率低下,难以满足市场需求。随着细胞生物学的兴起,很多植物利用细胞全能性,通过组织培养技术建立起了再生体系,并进一步开展了分子生物学研究[2]。在芍药的组织培养工作中,目前较成熟的体系是地下芽的相关组培工作,但仍然存在着生根困难[3],难以移栽成活以及取材不足的问题[4]。在愈伤组织诱导和再分化研究中,更是困难重重,主要问题在于不定芽的分化困难[5]以及严重的愈伤组织褐化和玻璃化等问题[6]。因此目前成熟的芍药再生体系的还没有建立,这也制约了本学科的深入发展[7]。
体细胞胚的发生途径为芍药的组织培养提供了更多成功的可能性,因为其同时具有芽端和根端,较易发育为完整植株,且该方法繁殖效率高,一块常规大小的愈伤组织可以产生几十个成熟的体细胞胚[8~9]。体细胞胚发生方式存在两种途径,一是直接发生途径,多是通过培养合子胚,诱导胚轴上的胚性细胞进行继续分裂,直接萌发出体细胞胚[10];二是间接发生途径,即通过愈伤组织直接诱导产生体细胞胚,进行植株再生[11]。两种方法相比较,间接发生途径取材范围更广泛,且出胚率较高,对于那些不结实的植物种类显得更加弥足珍贵[12]。芍药在体细胞胚诱导方面的研究鲜有报道,该过程的形态学和组织细胞学观察前人更是未有涉及。本试验中的3个品种皆为国外引进,具有较高观赏价值,因为高度杂合,具有天然的不结实特性。因此本试验通过间接发生途径诱导体细胞胚的发生,探讨胚性愈伤组织诱导和发育的培养条件要求,结合石蜡切片揭示芍药体细胞胚起源方式与发育过程的组织细胞形态变化,为进一步优化芍药体细胞胚发生体系提供参考依据,同时为下一步开展芍药遗传转化体系建立良好的技术平台。
1 材料和方法
1.1 试验材料
3个芍药品种均取自北京市昌平区小汤山实验苗圃,分别为1个伊藤杂种‘Going Bananas’芍药,2个3倍体品种‘Roselette’芍药和‘Red Charm’芍药,3个品种均是2009年从荷兰引至北京驯化培养后表现良好的健康植株。在3月中旬芍药的抽茎期或展叶期阶段,采集各品种的叶片、茎段和叶柄为外植体。
1.2 愈伤组织诱导和增殖
首先采用“两步消毒法”进行外植体的消毒处理[13],接种时将叶片切成0.5 cm×0.5 cm见方的小块,每个小方块带有一段主脉;茎段、叶柄横切成0.1~0.3 cm的薄片。基本培养基配方为IAA 1.0 mg·L-1+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1+TDZ mg·L-10.5+CH 0.625 g·L-1,基本培养基类型包括以下4种:WPM、MS、1/2MS、1/2MS(Ca2+加倍)。每种外植体每个处理接种10个培养皿,每个培养皿接种5~7个外植体,重复3次,30 d后观察记录各处理的愈伤组织诱导情况。之后选择各品种诱导率最高的处理,在原培养基中继代1次(30 d)。该过程均为暗培养。
1.3 体细胞胚的诱导和发育
选取增殖表现最佳的愈伤组织,以WPM为基本培养基,添加TDZ 0.05 mg·L-1+L-P 0.5 g·L-1,采用L9(34)三水平四因素正交设计(表1),进行胚性愈伤组织的诱导。每种处理接种10瓶,重复3次。连续暗培养90 d,每30 d继代一次。
挑取淡黄色水润愈伤组织转入以下3种培养基,进行体细胞胚的诱导和成熟:①1/2MS(Ca2+加倍)+6-BA 1.0 mg·L-1+2,4-D 0.2 mg·L-1;②1/2MS(Ca2+加倍)+6-BA 1.0 mg·L-1+NAA 0.2 mg·L-1;③1/2MS(Ca2+加倍)。各处理见光培养60 d,每30 d继代1次,温度23~25℃,光照周期16 h·d-1,光照强度1 800 lx,培养室空气相对湿度65%左右。
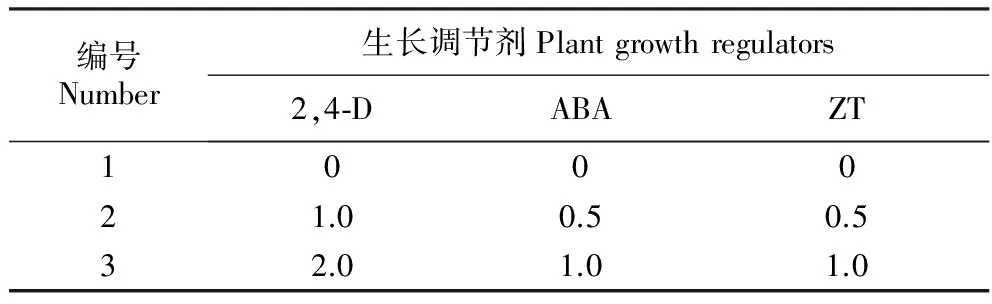
表1 3种生长调节剂的正交设计
1.4 体细胞胚发生过程的组织形态学观察
将上述胚性愈伤组织发育过程中的样品用德国产Leica体视显微镜DM2500进行形态学观察。照相后,再将样品用FAA固定,真空抽气,直至样品沉入瓶底。24 h后,依次进行脱水、透明、浸蜡、包埋、切片(厚度10 μm)、粘片、展片、脱蜡、复水、番红固绿染色、封片等程序后制作成石蜡切片。将切片置于德国产Leicas光学显微镜DM 2500下观察胚性细胞形成与分裂、体细胞胚发生与发育等过程。
2 结果与分析
2.1 启动培养和增殖培养的最佳处理组合
从诱导率上看,‘Going Bananas’、‘Roselette’、‘Red Charm’3个品种的最佳外植体类型均为嫩茎,最高诱导率分别为100%、83.33%、45.71%,其对应的最佳基本培养基类型为WPM培养基、1/2MS(Ca2+加倍)培养基、1/2MS(Ca2+加倍)培养基(表2)。各品种在原最佳培养基中继代1次后,增殖倍数均在3.00以上,尤其是品种‘Going Bananas’,增殖率为4.05,表现出旺盛的分裂能力。此时愈伤组织的类型均为淡黄色团块状(表3)。

表2 3个品种愈伤组织诱导情况

表3 3个品种的愈伤组织增殖率
2.2 体细胞胚的诱导和发育
选取增殖最佳的品种‘Going Bananas’的愈伤组织进行胚性愈伤组织诱导,在9种培养基中得到4种愈伤组织类型,分别为淡黄色致密型、白色透明型、淡黄色松散型、淡黄色水润型。7号培养基中愈伤组织增殖倍数最大,达到4.63,8号培养基次之,增殖率为4.52,且两种愈伤组织表面凸起明显,整体湿润有韧性。结合石蜡切片观察,确定为胚性愈伤组织。通过方差分析可知,2,4-D浓度为诱导其出现的最重要因素(表4)。
7号、8号培养基中的胚性愈伤组织见光培养后均缓慢转为绿色。转入到①号成熟培养基后,愈伤组织一直保持在淡黄色水润状态,未见进一步发育;转入到②号培养基后,愈伤组织表面的颗粒状凸起愈加明显,后期可以剥离出单个球形小颗粒;③号培养基中的愈伤组织前期凸起加强,后期生长迟缓。上述愈伤组织连续见光培养60 d后,表面变红、硬化,生长缓慢,没有进一步成熟发育。
2.3 胚性愈伤组织的形态学观察
品种‘Going Bananas’的愈伤组织在7号和8号培养基中表现为淡黄色水润状,其颗粒化明显,质地坚韧(图1:B);见光培养后,胚性愈伤组织慢慢变绿,表面颗粒化突起愈加明显,肉眼可见(图1:C);另一些为非胚性愈伤组织,呈现大型团块状,外表浅黄色偏白,无明显凸起,质地疏松较脆(图1:A)。体式显微镜下,胚性愈伤组织表面可见明显凸起颗粒(图1:D),内部呈现淡黄色光泽(图1:E)。从组织细胞学角度观察两种细胞形态,胚性细胞体积较小,排列规整紧密,边界明显,细胞质浓,细胞核大且易被染色,液泡较少或无液泡,具有旺盛的细胞分裂能力(图1:F中黑色箭头所指);非胚性细胞体积大,排列不规则,细胞核较小,不易被染色(图1:F中白色箭头所指)。两种细胞形态差别较大,边界明显,很容易区分。

图1 ‘Going Bananas’芍药两种愈伤组织形态比较 A.非胚性愈伤组织外观;B.胚性愈伤组织外观;C.胚形愈伤组织的颗粒状凸起;D.体式显微镜下胚性愈伤组织外部观察;E.体式显微镜下胚形愈伤组织内部观察;F.两种细胞形态比较Fig.1 Morphology comparison of two kinds callus of ‘Going bananas’ A. Appearance of non-embryonic callus;B. Appearance of embryonic callus;C. Granular protrusions of embryonic callus;D. Appearance of embryonic callus under stereo microscope;E. Internal observation of embryonic callus under stereo microscope;F. Comparison of cell morphology of two callus types
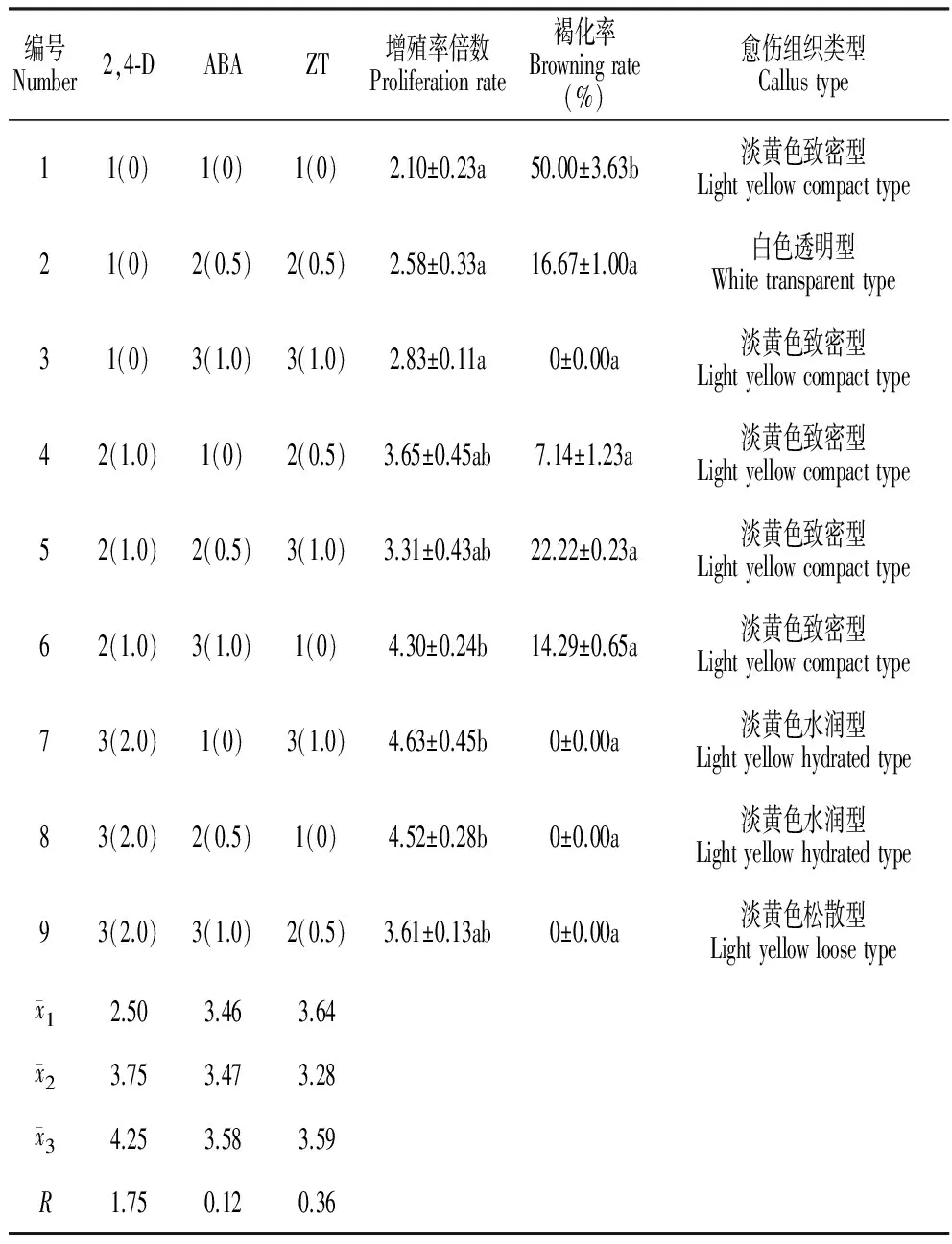
表4 生长调节剂对‘Going Bananas’胚性愈伤组织诱导的影响
2.4 芍药愈伤组织中体细胞胚起源过程的组织细胞学观察
经大量切片观察发现,芍药体细胞胚既可起源于胚性愈伤组织表层单个细胞或是多个表层下细胞,又可起源于愈伤组织内部细胞,且以外起源为主,其具体起源过程如下。
单个表层细胞起始的外起源过程:在胚性愈伤组织诱导培养基中,愈伤组织表层个别细胞在外源激素的作用下向外分裂形成单个突出于外表的胚性细胞,其体积大而圆,细胞质浓,细胞核大而染色深。在该细胞下还有一个长条形细胞(图2:A)。头部圆细胞经过多次分裂在愈伤组织表面形成一个致密的胚性细胞团凸起(图2:B),其中的胚性细胞体积小、排列紧密、边界规则;下方长条形细胞通过多次分裂产生更多的长条形细胞,两种细胞共同构成原胚(图2:C)。该类型的起源方式形成的原胚与母体联系较少,大部分结构裸露在外部空间,在位置效应作用下,孤立的细胞团能有效地减少与周围细胞的信息交流,尽早形成生理和形态上的隔离,从而启动新的细胞分化,进行独立的体细胞胚后熟发育。
多个表皮下细胞共同起源过程:位于表层愈伤组织下方的细胞层的某些细胞细胞核变大,细胞质变得稠密,随后经过对称分裂(图2:D),在表层细胞下形成更大的胚性细胞分布范围(图2:E),后期出现具有多个分裂中心的、相对孤立的胚性细胞团(图2:F)。随后胚性细胞团开始分化出现极性,包括细胞质浓厚的头部圆球状区域和液泡化伸长的基部(图2:G)。随着发育的进行,头部的细胞通过垂周分裂(图2:H黑色箭头所示)形成类表皮层,最终形成具有完整类表皮(图2:I黑色箭头所示)的原胚。胚性细胞通过有丝分裂产生多个胚性细胞团,并由此发育形成原胚。
胚性愈伤组织内起源过程:位于愈伤组织内部的单个胚性细胞启动分裂形成由几个细胞组成的胚性细胞团(图3:A),这些胚性细胞呈小而规则的正方形,排列紧密,与四周大而松散的普通细胞区别明显。胚性细胞继续分裂,并且逐渐出现两极化趋势,分生出头部和柄部(图3:B)。头部细胞仍然由小而规则的正方形细胞组成,柄部细胞呈现出明显的长条形,两部分共同构成了原胚。通过胚性细胞的进一步分裂,原胚继续增大、成熟,可见明显的‘胚头’和‘胚柄’结构(图3:C)。新的原胚的产生有两种途径,一是通过上述方式,由内部胚性细胞分裂和两极化而来(图3:D);二是成熟原胚头部细胞继续纵向分裂,在‘胚头’的中间部位形成类表皮层(图3:E)使‘胚头’一分为二,产生新的‘胚头’结构。该新生的‘胚头’结构后期再产生极性,形成新的成熟原胚。原胚细胞继续分裂并向愈伤组织表层方向生长,其周围的薄壁细胞逐渐解体消失,最后突破愈伤组织表层,突出于母体组织,此时它仍通过‘胚柄’与母体组织连接(图3:F)。但由内起源产生的原胚表面不像外起源产生的原胚光滑,表面还附着部分残留的细胞碎片。

图2 体细胞胚在愈伤组织表层的外起源过程 A.愈伤组织表面形成的单个圆球状胚性细胞和长条形胚性细胞(箭头所指);B.胚性细胞团;C.原胚(右侧)和原胚团(左);D.表皮下少量同时分裂的胚性细胞;E.大范围的胚性细胞团;F.多个胚性细胞团中心;G.类表皮结构出现;H.垂周分裂出的类表皮(黑色箭头);I.完整的类表皮(黑色箭头)和发育不一的原胚团Fig.2 Exogenous origin process of somatic embryos on callus surface A. Single embryonic cell formed on the surface of callus(marked by arrow);B. The embryogenic cell mass in the surface layer;C. Proembryo(the right side) and proembryo mass(the left side);D. Simultaneous division of embryogenic cells under the surface layer; E. Larger range of embryogenic cell mass;F. Multiple embryogenic cell mass centers;G. Appearance of protoderm-like layer;H. Anticlinal division(black arrow);I. Complete protoderm-like layer(black arrow) and proembryo mass with different development degree

图3 体细胞胚在愈伤组织中的内起源过程 A.位于愈伤组织内部的少数胚性细胞;B.胚性细胞团出现两极化;C.发育成熟的原胚结构;D.原胚的产生方式(一);E.原胚的产生方式(二);F.突出表层细胞的原胚Fig.3 Endogenous origin process of somatic embryos inside callus A. A few embryonic cells in the internal of callus;B. Polarized embryonic cell mass;C. Mature proembryo;D. The first generating mode of proembryo;E. The second generating mode of proembryo;F. Proembryo which just came out of the callus
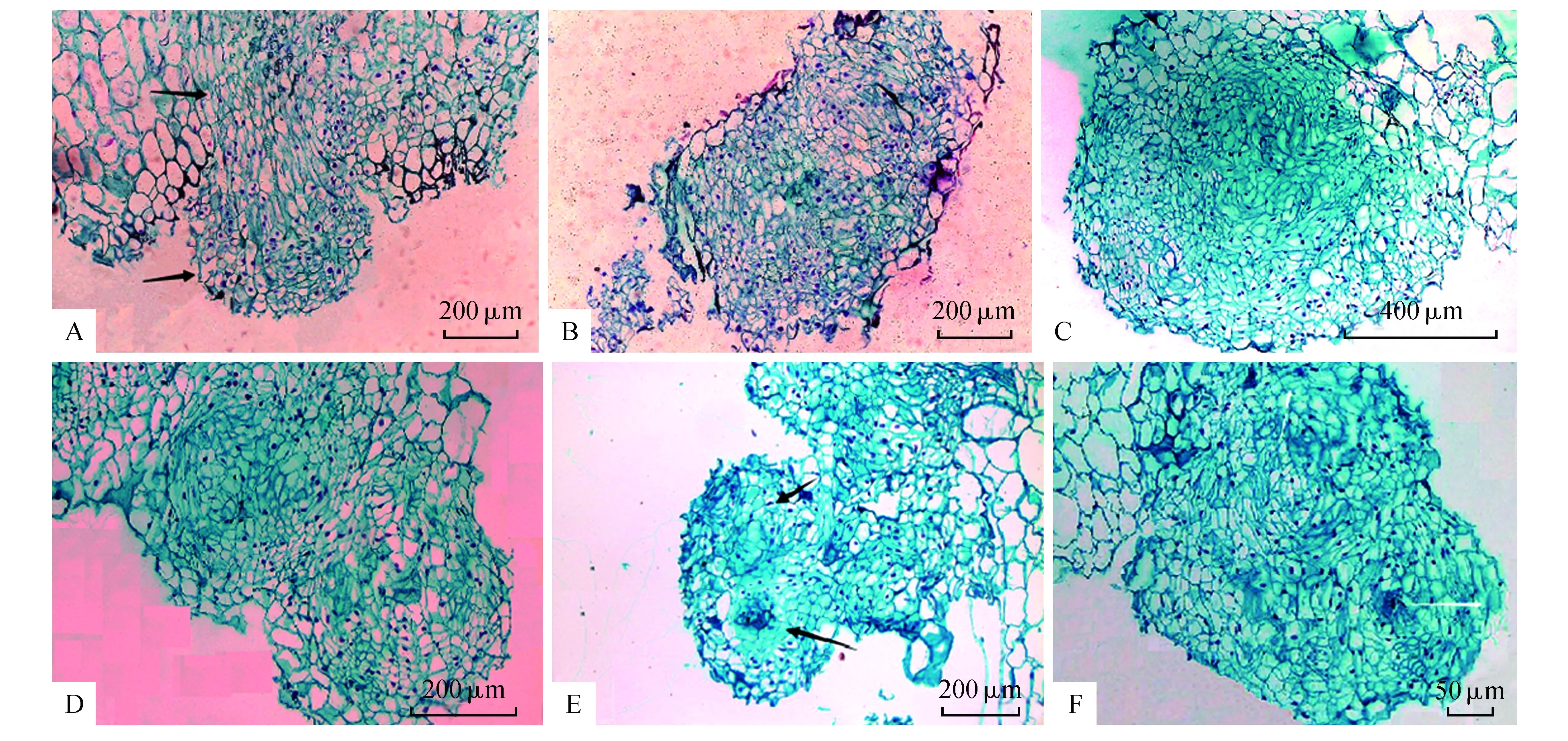
图4 芍药早期胚的组织细胞学观察 A.原胚;B.脱离母体的原胚团;C.早期球形胚;D.球形胚形成类表皮;E.球形胚内部的两个分裂中心;F.心形胚Fig.4 Morphological and histological observation of the origin of early somatic embryos of herbaceous peony A. Proembryo;B. The proembryo totally broke through the callus;C. Early globular embryo;D. Globular embryo with class epidermis;E. Two split centers inside globular embryo;F. Heart embryo
2.5 芍药早期体细胞胚发育的组织细胞学观察
突破表层的原胚(图4:A),头部细胞生长加速,细胞分裂旺盛,表面更加光滑,顶部圆而突出;而基部长条形细胞则慢慢空泡化,逐渐解体,原胚与母体分离(图4:B)或者仅通过少量的解体细胞,附着在母体表面(图4:C)。随后,每个圆球形的细胞团表层逐渐形成完整的类表皮(图4:D),此时发育到球形胚时期。球形胚的内部细胞继续进行分裂,同时形成两个分裂中心(图4:E),分裂中心通过旺盛的分裂活动,产生大量细胞,使得球形胚体积增大,并且向两侧前方突出,最终形成似心脏形状的结构,称为心形胚(图4:F)。心形胚之后并没有继续发育,而是停留在了该阶段。
3 讨论
体细胞胚发生的具体条件因植物种类、基因型、外植体类型等的不同而相差很大[14]。本试验中,品种‘Going Bananas’的茎段外植体表现最佳,高浓度的2,4-D和长时间的暗培养是胚性细胞出现的决定因素,这与其他物种的研究结果一致[15~16]。在胚性愈伤组织成熟后期去除2,4-D,并辅以6-BA和NAA,成功诱导原胚发育为球形胚和心形胚。有很多植物的体细胞胚均是在去除2,4-D的培养基上辅以少量激素或不加任何激素得来的[17~18]。
通过石蜡切片观察发现,芍药体细胞胚起源的方式十分多样,同时存在着内起源与外起源两种方式,而外起源发生方式又可以分为单细胞表层外起源和多细胞表层下外起源。在其他植物种类中,也普遍存在同时具有多种起源途径的情况[19~20]。比较3种具体外起源方式的效果,发现主要区别在于原胚的发生量上。在多细胞外起源方式中,胚性细胞团往往形成多个细胞分裂中心,极大地保证了体细胞胚的发生数量和发生速度。另外,通过观察细胞分裂方式发现,胚性细胞均是对称分裂的,当然由于不同的品种和培养基以及观察方式的局限性都会导致很难确定原始的不对称分裂的存在[21],因此就从本次切片观察来看,胚性细胞采用对称分裂方式。而且,在胚性细胞团中,除大量的胚性细胞外,还存在少量体积较大的薄壁细胞。这些少量的薄壁细胞在胚性细胞团中主要分布在分裂中心的边缘地带,在原胚结构中主要分布在‘胚头’的中心区域,但是其数量一直占细胞总量的极小部分。这些薄壁细胞的存在也说明各个细胞在同一激素水平的诱导下,接受激素(2,4-D等)诱导转变成胚性细胞的能力存在差异,这一现象在其他植物种类中也曾出现[14]。
但是,本次实验体细胞胚只发育到心形胚阶段,并没有进一步向下发育。通过参考其他物种的体胚诱导研究结果,发现尽管不同物种的体胚起源有差异,但后期体胚发育非常相似,体胚进入球形胚阶段后,转移到低浓度水平或不含激素的培养基中继续进行见光培养,即可自动进行体胚的成熟和发育,最终得到子叶胚[22~24]。但这一相通的培养方式显然对芍药不适用,推测这和物种的特性有关,可能芍药的体胚后成熟过程相较于其他物种要求更加严格的培养条件。相似情况在其他物种的实验中也曾遇到[25~27],适宜的成熟培养方式还需要后期进行深入探讨。
综上所述,芍药的体细胞胚发生过程相当复杂,从多方式的起源发育到严格的体胚后熟阶段,其生理生化和形态学变化涉及到多种基因的调控[28~29]。因此,要深入探讨造成体细胞胚发生初期的这种差异性的机理以及后期的严格成熟条件要求,尚需进一步实验验证。
1.秦魁杰.芍药[M].北京:中国林业出版社,2004.
Qin K J.Peony[M].Beijing:China Forestry Publishing House,2004.
2.薛银芳,赵大球,周春华,等.芍药组织培养的研究进展[J].北方园艺,2012(4):167-170.
Xue Y F,Zhao D Q,Zhou C H,et al.Research advances of herbaceous peony tissue culture[J].Northern Horticulture,2012(4):167-170.
3.Tian D,Tilt K M,Dane F,et al.Comparison of shoot induction ability of different explants in herbaceous peony(PaeonialactifloraPall.)[J].Scientia Horticulturae,2010,123(3):385-389.
4.吴红娟.芍药品种地下芽诱导及愈伤组织培养研究[D].北京:北京林业大学,2011.
Wu H J.Underground buds induction and callus cultivation ofPaeonialactifloracultivars[D].Beijing:Beijing Forestry University,2011.
5.于晓南,吴红娟,潘瞳.4个品种芍药愈伤组织的诱导及分化[J].湖南农业大学学报:自然科学版,2011,37(2):166-171.
Yu X N,Wu H J,Pan T.Callus induction and differentiation of four peony cultivars[J].Journal of Hunan Agricultural University:Natural Sciences,2011,37(2):166-171.
6.曲文静.芍药组织培养及褐化研究[D].北京:北京林业大学,2014.
Qu W J.Studies on tissue culture and browning ofPaeonialactifloraPall[D].Beijing:Beijing Forestry University,2014.
7.Raghavan V.One hundred years of zygotic embryo culture investigations[J].In Vitro Cellular & Developmental Biology-Plant,2003,39(5):437-442.
8.Kocak M,Izgu T,Sevindik B,et al.Somatic embryogenesis of turkishCyclamenpersicumMill[J].Scientia Horticulturae,2014,172:26-33.
9.Piovan A,Caniato R,Filippini R.Somatic embryogenesis and glucosinolate/myrosinase system in vulnerableBrassicarepandasubsp.Glabrescens(Poldini) Gómez-Campo[J].Scientia Horticulturae,2014,172:317-324.
10.Aboshama H M S.Direct somatic embryogenesis of pepper(CapsicumannuumL.)[J].World Journal of Agricultural Sciences,2011,7(6):755-762.
11.Solís-ramos L,Nahuath-dzib S,Andrade-torresA,et al.Indirect somatic embryogenesis and morphohistological analysis inCapsicumchinense[J].Biologia,2010,65(3):504-511.
12.Jana S,Sivanesan I,Lim M Y,et al.In vitro zygotic embryo germination and somatic embryogenesis through cotyledonary explants ofPaeonialactifloraPall[J].Flower Research Journal,2013,21(1):17-22.
13.魏冬霞,高凯,袁燕波,等.观赏芍药幼胚不定芽离体诱导研究[J].植物研究,2016,36(2):190-194.
Wei D X,Gao K,Yuan Y B,et al.Adventitious bud induction with immature embryo of herbaceous peony[J].Bulletin of Botanical Research,2016,36(2):190-194.
14.崔凯荣,邢更生,周功克,等.植物激素对体细胞胚胎发生的诱导与调节[J].遗传,2000,22(5):349-354.
Cui K R,Xing G S,Zhou K G,et al.The induced and regulaotry effects of plant hormones in somatic embryogenesis[J].Hereditas,2000,22(5):349-354.
15.何业华,方少秋,马均,等.菠萝愈伤组织中体细胞胚起源过程的组织细胞学观察[J].园艺学报,2010,37(5):689-696.
He Y H,Fang S Q,Ma J,et al.Histocytology observation on the somatic embryogenesis inAnanascomosuscallus[J].Acta Horticulturae Sinica,2010,37(5):689-696.
16.易星,陈己任,胡博文,等.‘月月红’月季体细胞胚胎发生和植株再生研究[J].园艺学报,2014,41(4):781-788.
Yi X,Chen J R,Hu B W,et al.Studies on somatic embryogenesis and plant regeneration inRosachinensis‘Yueyuehong’[J].Acta Horticulturae Sinica,2014,41(4):781-788.
17.温伟,崔建国,张罡,等.松属树种体胚发生研究进展[J].辽宁林业科技,2010(3):44-47.
Wen W,Cui J G,Zhang G,et al.Advances in somatic embryogenesis of Pine genus[J].Liaoning Forestry Science and Technology,2010(3):44-47.
18.臧顺,陈启武.辣椒营养器官离体培养中体胚发生研究进展[J].中国蔬菜,2013,1(22):9-14.
Zang S,Chen Q W.Research progress on pepper somatic embryogenesisinvitroculture[J].China Vegetables,2013,1(22):9-14.
19.吴泽,钟雄辉,曹兴,等.百合类体细胞胚和体细胞胚的形态学与组织学研究[J].园艺学报,2014,41(8):1716-1722.
Wu Z,Zhong X H,Cao X,et al.Morpho-histological study of somatic embryo-like structures and somatic embryos in lily[J].Acta Horticulturae Sinica,2014,41(8):1716-1722.
20.项伟波,赵金凯,吴家胜,等.香榧体细胞胚发生、发育的形态与细胞学观察[J].园艺学报,2015,42(8):1477-1486.
Xiang W B,Zhao J K,Wu J S,et al.Morphological and cytological observation of somatic embryogenesis and development inTorreyagrandis‘Merrillii’[J].Acta Horticulturae Sinica,2015,42(8):1477-1486.
21.吴健,王鸿昌,罗弦,等.唐菖蒲体细胞胚起源、发育的形态与组织细胞学观察[J].园艺学报,2012,39(12):2413-2420.
Wu J,Wang H C,Luo X,et al.Morphological and histological observation of somatic embryogenesis inGladiolushybridus[J].Acta Horticulturae Sinica,2012,39(12):2413-2420.
22.张启香,胡恒康,王正加,等.山核桃间接体细胞胚发生和植株再生[J].园艺学报,2011,38(6):1063-1070.
Zhang Q X,Hu H K,Wang J Z,et al.Indirect somatic embryogenesis and plant regeneration ofCaryacathayensis[J].Acta Horticulturae Sinica,2011,38(6):1063-1070.
23.Kamenetsky R,Dole J.Herbaceous peony(Paeonia):Genetics,physiology and cut flower production[J].Floriculture and Ornamental Biotechnology,2012,6(S1):62-77.
24.鲁娇娇,严瑞,何香杉,等.朱顶红‘Red Lion’胚性愈伤组织诱导及体细胞胚发生[J].园艺学报,2016,43(12):2451-2460.
LU J J,YAN R,HE X S,et al.The embryonic callus induction and somatic embryogenesis ofHippeastrumvittatum‘Red Lion’[J].Acta Horticulturae Sinica,2016,43(12):2451-2460.
25.Johri B M,Bhojwani S S.Embryo morphogenesis in the stem parasiteScurrulapulverulenta[J].Annals of Botany,1970,34(136):680-690.
26.曾吉恕.甘蔗体细胞培养中的胚状体发生[J].植物生理学报,1979,5(4):411-416.
Zeng J S.In vitro embryogenesis from somatic leaf callus of sugar cane[J].Acta Phytophysiologia Sinica,1979,5(4):411-416.
27.吴元立,严学成.银杏成熟胚培养的细胞组织学观察[J].林业科技,1998,34(4):8-13.
Wu Y L,Yan X C.The mature embryo ofGinkgobilobaL.:in vitro culture and its cytohistological studies[J].Scientia Silvae Sinicae,1998,34(4):8-13.
28.邢更妹,李杉,崔凯荣,等.植物体细胞胚发生中某些机理探讨[J].自然科学进展,2000,10(8):684-692.
Xing G S,Li S,Cui K R,et al.Study on some mechanisms of embryogenesis in plants[J].Advances in Natural Science,2000,10(8):684-692.
29.栾爱萍,何业华,林文秋,等.菠萝AcSERK1启动子的转录起始位点及胚性细胞特异性鉴定[J].园艺学报,2016,43(11):2251-2256.
Luan A P,He Y H,Lin W Q,et al.Identification of transcription start site of AcSERK1 and its embryospecific cell promoter in pineapple[J].Acta Horticulturae Sinica,2016,43(11):2251-2256.
Graduate Training and Development Program of Beijing Municipal Commission of Education(BLCXY201629);National Natural Science Foundation of China(31400591)
introduction:WEI Dong-Xia(1991—),female,postgraduate,research direction:plant tissue culture.
date:2017-05-17
HistocytologyObservationontheSomaticEmbryogenesisinHerbaceousPeonyCallus
WEI Dong-Xia ZHANG Teng ZHENG Yan-Yi YU Xiao-Nan*
(College of Landscape Architecture,Beijing Forestry University,Beijing 100083)
The stem segments, leaves and petioles of three herbaceous peony was used as explants for somatic embryogenesis. Paraffin method was used for morphological and histological observation of somatic embryogeneris. The main conclusions were as follows: callus induction rate from stems of ‘Going Bananas’ was 100%. Proliferation rate of the callus was over 4.0. The best induction and proliferation medium of inducting callus was WPM+IAA 1.0 mg·L-1+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1+TDZ 0.5 mg·L-1+CH 0.625 g·L-1. Embryogenic callus generated after transferred the callus to 1/2 MS(Ca2+doubled)+2,4-D 2.0 mg·L-1+ABA 0.5 mg·L-1or ZT 1.0 mg·L-1medium of a constantly dark cultivation of 90 d. Globular embryos and heart embryos were generated after transferred the embryogenic callus to 1/2MS(Ca2+doubled)+6-BA1.0 mg·L-1+NAA 0.2 mg·L-1medium for a constantly illumination cultivation of 60 d. There are exogenous and endogenous origins of somatic system. Exogenous includes origins from individual surface cells and origins from multiple subcritical cells. The difference of three ways lies mainly in starting position and starting cells number, they will all generated proembryo later. The splitting of embryogenic cells was symmetrical and the presence of asymmetric splitting cells was not found.
herbaceous peony;somatic embryo;origin;histocytology
北京市教育委员会科学研究与研究生培养共建项目资助(BLCXY201629);国家自然科学基金(31400591)
魏冬霞(1991—),女,硕士研究生,主要从事芍药组织培养方面的研究。
* 通信作者:E-mail:yuxiaonan626@126.com
2017-05-17
* Corresponding author:E-mail:yuxiaonan626@126.com
S682.1+2
A
10.7525/j.issn.1673-5102.2018.01.007
