左旋精氨酸对急性心肌梗死大鼠血管新生的影响及心肌保护作用
2018-01-09罗礼云李玥彭湖危小良林岫芳
罗礼云 李玥 彭湖 危小良 林岫芳
基础研究
左旋精氨酸对急性心肌梗死大鼠血管新生的影响及心肌保护作用
罗礼云 李玥 彭湖 危小良 林岫芳
目的 观察左旋精氨酸干预对急性心肌梗死(AMI)大鼠心肌梗死边缘区血管新生的影响及心肌保护作用。方法 冠状动脉结扎法建立大鼠AMI模型,30只SD雄性大鼠被随机分为3组:假手术组、生理盐水对照组及左旋精氨酸干预组。在冠状动脉结扎后4周,超声心动图测量大鼠心脏左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)、左室射血分数(LVEF)、左室短缩分数(LVFS),Masson染色测定梗死面积,ELISA法检测各组大鼠血浆脑钠尿肽(BNP)水平;采用免疫组织化学技术检测大鼠心肌梗死边缘区CD31阳性的内皮细胞数量及α-SMA阳性平滑肌细胞数量,以评估新生血管情况,Western blot检测梗死边缘区内皮型一氧化氮合成酶(eNOS)及胶原-Ⅰ蛋白含量。结果 冠状动脉结扎术后4周,与生理盐水对照组相比,左旋精氨酸干预组 LVEF(48.20%比 35.20%,P<0.01)、LVFS(24.10%比 17.38%,P<0.01)明显升高,而LVEDD(7.82 mm 比 9.06 mm,P<0.01)及 LVESD(6.29 mm 比 7.32 mm,P<0.01)降低;梗死面积明显缩小(25.11%比 35.02%,P<0.01);血浆 BNP水平亦较低(872.33 pg/ml比 1203 pg/ml,P<0.01);而梗死边缘区CD31阳性的内皮细胞高于生理盐水对照组(101.4/mm2比34.8/mm2,P<0.01),α-SMA阳性平滑肌细胞密度亦高于对照组(20.2/mm2比7.2/mm2,P<0.01);梗死周围区eNOS蛋白水平高于对照组,而胶原-Ⅰ蛋白含量则低于对照组(P<0.01)。结论 左旋精氨酸干预可促进AMI大鼠梗死心肌边缘区毛细血管及小动脉新生,减少胶原-1蛋白含量,促进eNOS的表达,并具有改善左心收缩功能、降低血浆BNP水平、缩小梗死面积的心肌保护作用。
急性心肌梗死; 血管新生; 左旋精氨酸
为减少急性心肌梗死(acute myocardial infarction,AMI)患者死亡率,改善其心功能及临床转归,应用辅助性治疗方法改善AMI预后的手段包括干细胞移植、细胞因子治疗的研究受到国内外学者的重视[1]。治疗性血管新生(therapeutic neovascularization)是一种有前景的治疗缺血性心脏病的方法,是指采取一定的治疗措施促进缺血区或其边缘区血管新生,通过促进缺血区域侧支循环的开放及新生血管的形成,从而缓解心肌缺血[2,3]。在诸多可能促进血管生长的物质中,左旋精氨酸(L-Arginine)因其具有促进血管新生及改善血管内皮功能的双重作用而成为研究的热点[4]。
左旋精氨酸是一种半必需氨基酸,可在缺氧条件下上调缺氧诱导因子表达,降低各种因子在缺氧条件下对内皮细胞的损伤及改善血管内皮功能,对缺血区域血管新生具有明显的促进作用[5],但左旋精氨酸是否可改善心肌梗死后心室重塑尚未完全明确。本研究拟从血管新生及对心肌胶原-1表达的影响两方面探讨左旋精氨酸心肌保护作用的机制。
1 材料与方法
1.1 动物和试剂 30只SPF级雄性SD(Sprague-Dawley)大鼠,体重 250~300 g,由中山大学实验动物中心提供。戊巴比妥钠购自上海西唐科技有限公司,重组PIGF-2购自美国R&D Systems公司,抗CD31抗体、一抗胶原-Ⅰ购自美国Abcam公司,α-平滑肌肌动蛋白(α-SMA)抗体购自美国Novus公司,大鼠血浆脑钠尿肽ELISA试剂盒由武汉华美生物科技(CUSABIO)提供。
1.2 大鼠急性心肌梗死模型建立及分组 大鼠被随机分为假手术组、生理盐水对照组及左旋精氨酸组,每组10只。大鼠心肌梗死模型建立步骤如下[6]:称重后1%戊巴比妥(30~45 mg/kg)腹腔内注射麻醉,经口行气管插管成功后连接小动物呼吸机(呼吸机参数:呼吸比2∶1,潮气量30 ml/kg,呼吸频率65~80次/min),于左胸前区第3、4肋间行胸廓切开术,暴露心脏,撕开心包膜,左心耳下缘2~3 mm处用6-0缝合线结扎左冠状动脉,进针深度约2 mm(假手术组只穿线,不结扎)。结扎后肉眼可见结扎局部下方和左心室前壁呈灰白至发绀,Ⅱ导联心电图R波增高伴明显切迹(ST段抬高)并持续15 min以上即为心肌梗死结扎成功标志。确认模型建立成功后10 min,逐层缝合胸腔,逐渐撤停呼吸机恢复自主呼吸。待大鼠呼吸稳定清醒后拔出气管插管,放入笼内继续饲养(室温24℃~26℃)。术后24 h进行分组干预。生理盐水对照组:应用生理盐水灌胃,剂量为 10 ml·kg-1·d-1,直至术后 4 周。左旋精氨酸治疗组:应用左旋精氨酸灌胃治疗,剂量为100 mg·kg-1·d-1,直至术后 4 周。假手术组:只开胸,不结扎冠状动脉。
1.3 超声心动图评估心脏结构及功能 冠状动脉结扎术前及术后4周,麻醉状态下进行大鼠经胸超声心动图检查(飞利浦IE33,12 MHZ探头),以胸骨旁短轴切面,M超测量左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)。左室短缩分数(LVFS)=(LVEDD-LVESD)/LVEDD×100%。根据Teichholz公式[7]计算左室射血分数(LVEF):左室收缩末体积(LVESV)=(7.0×LVESD3)/(2.4+LVESD)左室舒张末体积(LVEDV)=(7.0×LVEDD3)/(2.4+LVEDD)左室射血分数(LVEF)=(LVEDV-LVESV)/LVEDV×100%
1.4 Masson染色梗死面积测定 冠脉结扎后4周,处死大鼠后迅速开胸切取心脏,用生理盐水清洗并去除心腔内残余血液,在长轴中点处垂直于长轴将左心室一分为二,心尖侧的一半心肌组织于4%甲醛溶液中固定,保存24 h后经石蜡包埋,取5 μm厚的切片行病理组织学检查。Masson染色定量测定梗死面积,坏死瘢痕组织被染为蓝色,存活心肌组织被染为红色。应用图像处理软件Image J测量梗死面积并取平均值[8]。梗死面积=(瘢痕内弧长+瘢痕外弧长)/(外周长+内周长)×100%。
1.5 ELISA法检测各组大鼠血浆脑钠尿肽(BNP)浓度 冠脉结扎后4周,戊巴比妥腹腔注射麻醉,切取心脏标本前先从腹主动脉抽取动脉血,以3000 r/min离心10 min,去除颗粒后分装保存于-70℃冰箱备用。按照大鼠钠尿肽ELISA检测试剂盒(CBS-E07972R,CUSABIO,中国)说明书提供的实验步骤进行检测[9]。
1.6 免疫组化检测梗死边缘区血管新生 采用免疫组化技术检测大鼠心肌梗死边缘区血小板-内皮细胞黏附分子(CD31)阳性的内皮细胞数量,评估新生毛细血管情况;检测抗α平滑肌肌动蛋白(α-SMA)阳性平滑肌细胞数量,以评估新生小动脉情况[10]。将组织切片在室温中放置60 min或60℃恒温箱中烘烤20 min,脱蜡和水化后用蒸馏水或PBS配置新鲜的3%H2O2,室温封闭5~10 min,PBS洗3次,每次2 min。滴加封闭液,室温10 min,滴加一抗(抗CD31抗体/α-SMA抗体),4℃过夜,滴加羊抗或兔IgG抗体-HRP多聚体,室温孵育1 h,DAB显色,蒸馏水洗后脱水、透明,中性树脂50 μl封片,选择5个梗死区视野,计算CD31阳性微血管数量(200倍目镜下)及α-SMA阳性血管数量(100倍目镜下)。
1.7 Western blot检测梗死边缘区胶原-1蛋白含量 收集细胞蛋白后,采用6%聚丙烯酰胺凝分离目的蛋白,经SDS-PAGE电泳后将蛋白转至PVDF膜上,5%脱脂牛奶封闭后,将一抗胶原-Ⅰ(使用浓度1∶3000)4℃孵育过夜后,用TBST每次7 min洗2次后,用相应的稀释好的二抗(HRP标记山羊抗兔二抗,使用浓度1∶3000)室温下孵育1~2 h后,TBST每次7 min洗3次后,行化学发光显影(ECL)[11]。用Image J分析目标条带的光密度值。以bata-actin(使用浓度1∶5000)作为内参照,比较不同处理后蛋白表达的差异。
1.8 统计学方法 应用IBM SPSS 21.0统计软件进行统计分析。数据采用±s表示,多组间均数比较采用单因素方差分析(正态分布资料)或Kruskal-Wallis检验(非正态分布资料),两组间均数比较采用Post-hoc检验。P<0.05表示差异有统计学意义。
2 结果
2.1 超声心动图对大鼠心功能的评估 在冠脉结扎前,超声心动图测得LVEDD、LVESD、LVEF及LVFS各项指标在各组大鼠之间比较未见统计学差异(P>0.05)。冠脉结扎后4周,超声心动图检查发现心肌梗死组(对照组)大鼠心室前壁运动减弱或消失,反映心室收缩功能的指标LVEF、LVFS较假手术组显著降低,LVEDD及LVESD则显著升高(P<0.01)。与生理盐水对照组相比,左旋精氨酸组LVEF、LVFS明显升高,而LVEDD及LVESD明显降低(P<0.01)。见表1、图 1。
2.2 梗死面积测定 冠脉结扎后4周,Masson染色结果见图2。与生理盐水对照组相比,左旋精氨酸组梗死面积明显减小(P<0.01),见表2。
表1 三组大鼠超声心动图结果比较(±s)

表1 三组大鼠超声心动图结果比较(±s)
注:LVEDD:左室舒张末内径;LVESD:左室收缩末内径;LVEF:左室射血分数;LVFS:左室短缩分数。与假手术组比较,aP<0.05;与生理盐水组比较,bP<0.01
组别 LVEDD(mm) LVESD(mm) LVEF(%) LVFS(%)假手术组 6.61±0.86 3.94±0.20 79.06±2.89 43.10±3.24生理盐水组 9.06±0.23a 7.32±0.30a 35.20±0.91a 17.38±0.64a左旋精氨酸组 7.82±0.36ab 6.29±0.17ab 48.20±1.06ab 24.10±0.50ab
表2 三组大鼠梗死面积比较(±s)

表2 三组大鼠梗死面积比较(±s)
注:与生理盐水组比较,aP<0.01
组别 梗死面积(%)假手术组 0生理盐水组 35.02±2.40左旋精氨酸组 25.11±2.17a
2.3 各组大鼠血浆BNP浓度比较 单因素方差分析发现,三组间BNP浓度存在明显差异(P<0.01)。进一步两组间比较(Post-hoc检验)发现,假手术组血浆BNP浓度最低;与生理盐水组相比,左旋精氨酸组血浆BNP浓度水平明显降低(P<0.01,表3)。
表3 三组大鼠血浆BNP浓度比较(±s)

表3 三组大鼠血浆BNP浓度比较(±s)
注:与假手术组比较,aP<0.01;与生理盐水组比较,bP<0.01
组别 血浆 BNP 浓度(pg/ml)假手术组 141.00±10.62生理盐水组 1203.00±100.64a左旋精氨酸组 872.33±78.90ab
2.4 各组大鼠梗死周围区新生血管比较 各组大鼠梗死周围区内皮细胞中CD31免疫组织化学测定结果见图3。单因素方差分析发现,毛细血管密度(CD31阳性细胞数量/mm2)在各组间存在差异(P<0.05),其中假手术组最高(169.20±5.78)/mm2;Post-hoc检验发现,左旋精氨酸组毛细血管密度为(101.40±6.74)/mm2,高于生理盐水组的(34.80±5.15)/mm2(P<0.01,表4)。α-SMA阳性细胞数量在各组之间亦存在明显差异(图4),假手术组为(42.00±4.56)/mm2,高于其他两组;左旋精氨酸组小动脉密度(α-SMA阳性细胞数量/mm2)(20.20±3.12)/mm2,明显高于对照组(7.2±1.72)/mm2(P<0.01)。见表5。
2.5 大鼠梗死周围区内皮型一氧化氮合成酶(eNOS)及胶原-Ⅰ蛋白表达水平检测 心肌梗死后4周,Western blot检测到生理盐水组eNOS表达水平最低,而左旋精氨酸组eNOS表达水平较对照组显著升高;假手术组胶原-Ⅰ蛋白含量最低,以假手术组作为参照,与生理盐水组相比,左旋精氨酸组胶原-1蛋白含量较低(P<0.01)。见图5。
表4 三组大鼠梗死周围区CD31阳性细胞数量比较(±s)
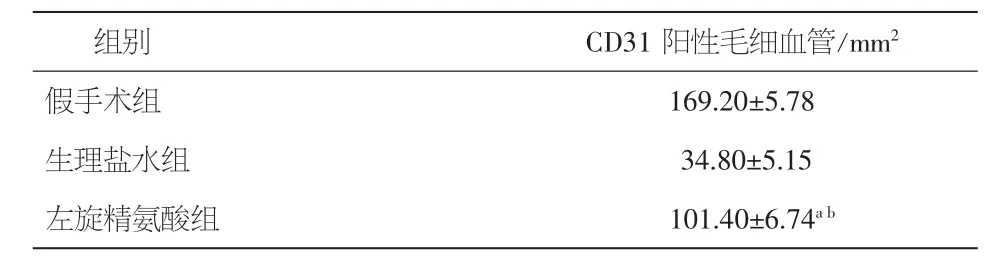
表4 三组大鼠梗死周围区CD31阳性细胞数量比较(±s)
注:与假手术组比较,aP<0.01;与生理盐水组比较,bP<0.01
假手术组 169.20±5.78生理盐水组 34.80±5.15左旋精氨酸组 101.40±6.74ab
表5 三组大鼠梗死周围区小动脉数量比较(±s)

表5 三组大鼠梗死周围区小动脉数量比较(±s)
注:与假手术组比较,aP<0.01;与生理盐水组比较,bP<0.01
假手术组 42.00±4.56生理盐水组 7.20±1.72a左旋精氨酸组 20.20±3.12ab
3 讨论
目前成熟的再灌注治疗特别是直接经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)可迅速开通AMI患者的梗死相关动脉,尽快恢复心肌正常血供是改善患者预后的关键[12]。但相当部分患者由于条件所限并未得到及时再灌注治疗,即使进行再灌注治疗,术中的再灌注损伤及无复流的发生导致心肌微循环组织水平灌注仍不理想,这部分患者常出现明显的心室重塑并最终导致心力衰竭的发生。
本研究观察了左旋精氨酸干预对AMI大鼠血管新生的影响及心肌保护作用。结果发现,左旋精氨酸干预可提高AMI大鼠左室射血分数,缩小梗死面积,增加毛细血管及小动脉新生;且发现左旋精氨酸干预组血浆BNP水平降低明显,而BNP是心功能不全严重程度及预后不良较为特异性的生物标志物。本研究发现,在心肌梗死后4周大鼠梗死周围区心肌eNOS表达明显下降,而左旋精氨酸干预可增强eNOS表达,据此我们推测左旋精氨酸对血管新生的促进作用主要与其对eNOS表达的影响相关。本研究还初步探讨了左旋精氨酸干预对梗死后心肌间质重构的关键成分胶原-1的影响,结果发现左旋精氨酸可减少心肌梗死慢性期梗死周围区心肌内胶原-1的含量。
关于左旋精氨酸对血管新生影响及心肌保护作用的机制尚未完全明确。动物实验发现,大鼠心肌梗死后早期心肌内皮型一氧化氮合成酶(eNOS)mRNA表达明显降低[13],其机制可能与血浆及左心室梗死区、边缘区的非对称性二甲基精氨酸(Asymmetric dimethylarginine,ADMA) 浓度升高有关[14]。ADMA可抑制eNOS的活性,而eNOS的主要作用为催化精氨酸转化为瓜氨酸和一氧化氮(NO),后者是强有力的内源性血管舒张因子,可抑制白细胞黏附及血小板聚集,维持内皮细胞功能的稳定,若NO合成不足,则会影响心肌组织水平灌注及血管新生[15]。左旋精氨酸是一种半必需氨基酸,是一氧化氮合成酶的底物,可在缺氧条件下上调缺氧诱导因子表达,降低各种因子在缺氧条件下对内皮细胞的损伤[16],此外,左旋精氨酸可拮抗ADMA对内皮细胞增殖的抑制作用[5]。它虽不能使体内的ADMA水平下降,但可恢复L-Arginine/ADMA比值,从而拮抗ADMA的效应,增加eNOS mRNA的表达及其活性。研究表明,eNOS在AMI后血管新生及心肌重塑方面发挥着重要作用,eNOS基因敲除大鼠缺血区心肌血管新生明显受到抑制[17,18]。
本研究发现,PIGF的心肌保护作用还可能与其对梗死周围区心肌内胶原-Ⅰ蛋白表达的影响相关。胶原-Ⅰ是细胞间基质的主要成分,在心肌梗死后心肌纤维化过程中扮演重要角色,调节胶原合成已成为治疗心室重塑的重要靶点[19]。左旋精氨酸减少心肌梗死慢性期梗死周围区心肌内胶原-Ⅰ表达的可能机制为:随着新生血管增加,心肌组织缺血、缺氧得到改善,基质金属蛋白酶组织抑制因子-2(TIMP-2)及基质金属蛋白酶-2(MMP-2)表达增加,导致胶原-Ⅰ降解增加[20]。
血管新生的发现是缺血性心脏病治疗的一大进步。然而,诸多促进血管生成的细胞因子在动物实验获得较好的治疗效果,但在人体进行临床试验却未能取得预期效果。越来越多的研究表明,之所以会出现上述情况,与患者的选择差异、应用时机、新生血管成熟等多种因素相关;另外,给药途径、药物载体、药物剂量等问题尚未解决,大规模应用于临床实践尚需进一步加强对其作用机制及安全性方面的研究[21]。
(本文图片见封三)
[1]Singh P,Sethi N,Kaur N,et al.Revascularization in Severe Left Ventricular Dysfunction:Does Myocardial Viability Even Matter?Clin Med Insights Cardiol,2015,9:105-109.
[2]Lassaletta AD,Chu LM,Sellke FW.Therapeutic neovascularization for coronary disease:current state and future prospects.Basic Res Cardiol,2011,106:897-909.
[3]Takeda Y,Uemura S,Iwama H,et al.Treatment with recombinant placental growth factor(PIGF)enhances both angiogenesis and arteriogenesis and improves survival after myocardial infarction.Circ J,2009,73:1674-1682.
[4]Voisine P,Bianchi C,Khan TA,et al.Normalization of coronary microvascular reactivity and improvement in myocardial perfusion by surgical vascular endothelial growth factor combined with oral supplementation of L-Arginine in a porcine model of endothelial dysfunction.J Thoral cardiocasc Surg,2005,129:1414-1420.
[5]何晋,谢秀梅,方叶青,等.L-精氨酸抑制非对称性二甲基精氨酸对内皮祖细胞的增殖作用.中国动脉硬化杂志,2007,15:751-754.
[6]Chen J,Zheng S,Huang H,et al.Mesenchymal Stem Cells Enhanced Cardiac Nerve Sprouting via Nerve Growth Factor in a Rat Model of Myocardial Infarction.Current Pharmaceutical Design,2014,20:2023-2029.
[7]Wykrzykowska JJ,Rosinberg A,Lee SU,et al.Autologous cardiomyotissue implantation promotes myocardial regeneration,decreases infarct size,and improves left ventricular function.Circulation,2011,123:62-69.
[8]Chen G,Nayan M,Duong M,et al.Marrow stromal cells for cell-based therapy:the role of antiinflammatory cytokines in cellular cardiomyoplasty.Ann Thorac Surg,2010,90:190-197.
[9]Li J,Yin FF,Hou YL.Early diagnosis of rats with acute myocardial infarction by measurement of brain natriuretic peptide.Exp Ther Med,2013,5:1201-1205.
[10]Rendell MS,Finnegan MF,Pisarri T,et al.A comparison of the cutaneous microvascular properties of the spontaneously hypertensive rat and the Wistar-Kyoto rat.Comp Biochem Physiol A Mol Integr Physiol,1999,122:399-406.
[11]Voisine P,Bianchi C,Khan TA,et al.Normalization of coronary microvascular reactivity and improvement in myocardial perfusion by surgical vascular endothelial growth factor combined with oral supplementation of L-arginine in a porcine model of endothelial dysfunction.J Thoral cardiocasc Surg,2005,129:1414-1420.
[12]中华医学会心血管病学分会.2015急性ST段抬高型心肌梗死诊断和治疗指南.中华心血管病杂志,2015,5:380-393.
[13]陆东风,龙冠洲,石姝梅.急性心肌梗死大鼠心脏内皮型一氧化氮合酶基因表达减少及左旋精氨酸增加内皮型一氧化氮合酶基因表达.中华心血管病杂志,2004,10:713.
[14]Gray GA,Patrizio M,Sherry L,et al.Immunolocalisation and activity of DDAHⅠandⅡin the heart and modification postmyocardial infarction.Acta Histochem,2010,112:413-423.
[15]Theilmeier G,Chan JR,Zalpour S,et al.Adhesiveness of Mononuclear Cells in Hyperchole sterolemic Humans is normalized by Dietary L-Arginine.Arteriosclero Thromb Vasc Biol,1997,17:3557-3564.
[16]Martínez-Romero R,Canuelo A,Siles E,et al.Nitric oxide modulates hypoxia-inducible factor-1 and poly(ADP-ribose)polymerase-1 cross talk in response to hypobaric hypoxia.J Appl Physiol,2012,112:816-823.
[17]Fraccarollo D,Widder JD,Galuppo P,et al.Improvement in left ventricular remodeling by the endothelial nitric oxide synthase enhancer AVE9488 after experimental myocardial infarction.Circulation,2008,118:818-827.
[18]Landmesser U,Engberding N,Bahlmann FH,et al.Statin-induced improvement of endothelial progenitor cell mobilization,myocardial neovascularization, left ventricular function, and survival after experimental myocardial infarction requires endothelial nitric oxide synthase.Circulation,2004,110:1933-1939.
[19]Bornstein P.Matricellular proteins:an overview.J Cell Commun Signal,2009,3:163-165.
[20]Lu ZX,Mao LL,Lian F,et al.Cardioprotective activity of placental growth factor in a rat model of acute myocardial infarction:nanoparticle-based delivery versus direct myocardial injection.BMC Cardiovasc Disord,2014,14:53.
[21]Antonio D,Lassaletta Louis M,Chu Frank W,et al.Therapeutic neovascularization for coronary disease:current state and future prospects.Basic Res Cardiol,2011,106:897-909.
Effect of angiogenesis and cardioprotective activity of L-Arginine in a rat model of acute myocardial infarction
LUO Li-yun*,LI Yue,PENG Hu,et al.*Department of Cardiology,the Fifth Affiliated Hospital of Sun Yat-Sen University,Zhuhai 519000,China
LIN Xiu-fang,E-mail:linxiufang_126@126.com
ObjectiveTo investigate the effect of angiogenesis in peri-infarct area of the L-Arginine therapy for acute myocardial infarction rats and its cardioprotective activity.MethodsThe AMI rat model was established by ligation of the left anterior descending of coronary arteries.Thirty male Sprague-Dawley rats were randomly divided into three groups:sham group,normal saline group(control group)and L-Arginine group.Four weeks after ligation and treatment,cardiac function,scar area,plasma concentration of BNP,angiogenesis and arteriogenesis,myocardial collagen Ⅰ protein expression were studied.Echocardiography,Masson staining,enzyme-linked immunosorbent assay,immunehistochemistry,western blot were performed.ResultsFour weeks after ligation,compared with the control group,LVEF(48.20%vs 35.20%,P<0.01),LVFS(24.10%vs 17.38%,P<0.01)were higher in L-Arginine group,while LVEDD(7.82 mm vs 9.06 mm,P<0.01)and LVESD(6.29 mm vs 7.32 mm,P<0.01)decreased obviously.Average scar percentage and plasma concentration of BNP were lower in L-Arginine group(872.33 pg/ml vs 1203 pg/ml,P<0.01).The mean CD31-positive microvessels(101.4/mm2vs 34.8/mm2,P<0.01)and α-SMA positive microvessels of the peri-infarct area (20.2/mm2vs 7.2/mm2,P<0.01)were higher in L-Arginine group,while collagen Ⅰ protein content was decreased in this group(P<0.01).ConclusionL-Arginine intervention improves cardiac function and reduces infarction size in AMI rats,the possible mechanism is related to dual function of promoting angiogenesis and arteriogenesis,reducing collagen Ⅰ expression is also one of the important mechanisms.
Acute myocardial infarction; Angiogenesis; L-Arginine
珠海市科技局课题(项目编号:2015A1009)
519000 广东省珠海市,中山大学附属第五医院心血管内科(罗礼云、彭湖、危小良、林岫芳),老年病科(李玥)
林岫芳,E-mail:linxiufang_126@126.com
10.3969/j.issn.1672-5301.2017.12.024
Q95-33;R542.2+2
A
1672-5301(2017)12-1140-05
2017-05-17)
