活性肽-N对D-半乳糖致衰老小鼠的作用效果
2018-01-08刘洪吉尤倩倩袁靖琳兰海静李全阳
陈 燏,刘洪吉,2,尤倩倩,袁靖琳,宋 奇,郝 丹,刘 栋,兰海静,李全阳,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.洁翼流体技术(上海)有限公司,上海 201404)
活性肽-N对D-半乳糖致衰老小鼠的作用效果
陈 燏1,刘洪吉1,2,尤倩倩1,袁靖琳1,宋 奇1,郝 丹1,刘 栋1,兰海静1,李全阳1,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.洁翼流体技术(上海)有限公司,上海 201404)
为了探讨一种新型抗衰老活性因子——活性肽-N食用后的抗衰老作用,本研究通过给小鼠连续皮下注射D-半乳糖(200 mg/(kg·d),以体质量计,下同)建立衰老模型,造模的同时开始灌胃2.5、25.0、125.0 µg/(kg·d)活性肽-N复乳,连续9 周。分别采用旷场实验和Morris水迷宫实验检测小鼠的运动探究能力和学习记忆能力。上述行为学实验后,对小鼠血清中谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、丙二醛(malondialdehyde,MDA)含量及脑组织中的乙酰胆碱酯酶(acetyl cholinesterase,AChE)活力进行测定。结果表明,与衰老模型组相比,活性肽-N复乳高剂量组能显著提高衰老小鼠的运动探究能力,改善其学习记忆能力,提高血清中的GSH-Px活力28.38%(P<0.05),降低MDA含量26.19%(P<0.05),同时降低脑组织中的AChE活力23.26%(P<0.05)。综合结果表明该活性肽-N对D-半乳糖致衰老小鼠具有明显的抗衰老作用。
活性肽-N复乳;D-半乳糖;抗衰老;学习记忆
人的衰老是一种高度复杂的自然现象。它不仅受到遗传因素的影响[1],也受到饮食的重要影响,而且后者的比重更大[2]。人的饮食极其复杂,而衰老又是一个漫长的过程,因此研究饮食与衰老之间的关系非常困难,但又无法回避,所以从重要的影响因子入手,探索饮食与衰老的关系或许是一条有效途径。而生物活性肽作为饮食中的功能性因子,具有成分明确、用量小等优点,在机体的抗衰老制剂开发上具有良好前景[3-4]。目前研究已经发现了一系列生物活性肽,如抗氧化肽、细胞调节肽、神经保护肽[5-7]。
活性肽-N是8 个氨基酸组成的寡肽(Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln),是活性依赖性神经保护蛋白中的活性片段[8]。该活性肽的发现源于对人体活性肠肽的研究[9],它是血管活性肠肽刺激神经胶质细胞产生的一种神经营养因子,由于其具有很强的神经保护作用而受到重视。由于它的分子质量较小,目前该活性肽样品皆由生物合成。一系列研究表明,活性肽-N对神经损伤的治疗上具有广阔的应用前景[10-12]。在肌萎缩性脊髓侧索硬化小鼠模型中,皮下注射活性肽-N能减少tau蛋白的异常过度磷酸化,保护轴突转运免受损害[11]。脑麻痹新生小鼠模型通过腹腔注射活性肽-N能显著减少其神经元凋亡数量[12]。在不可逆的局灶性脑缺血大鼠模型中,静脉注射活性肽-N能有效减少其脑部梗死面积[13]。近期的研究表明,活性肽-N在急性回肠炎小鼠模型中还具有显著的全身性抗炎作用[14]。目前国外关于活性肽-N的研究很多,国内则比较少见,它作为一种天然的神经保护肽,具有无毒副作用、安全性高的特点[12]。在大部分研究中,活性肽-N均是通过注射的方式使用的,现有报道资料中还鲜见有关活性肽-N口服抗衰老活性的研究报道。与注射给药这种方式相比,口服更易被接受,它不仅服用方便,还能大大减轻生理痛苦,增加安全性,也更像是一种食品。因此,对活性肽-N口服制剂的抗衰老作用进行探索十分必要。
肽类物质直接口服在胃肠道内易被各种消化酶降解、失活导致生物利用度变差[15]。而W/O/W型复乳具有多重乳膜结构,可提高多肽类药物的稳定性,在避免其在胃肠道中因分解而失活的同时,还可以促进肠上皮细胞对多肽类药物的透过性。活性肽-N已经是活性依赖神经保护因子上的最小活性片段,Pappenheimer等[16]已经证明八肽可以直接通过肠道上皮细胞,其吸收机制可能与旁路转运吸收途径有关。故本实验首先将活性肽-N制备成W/O/W型复乳,再将其作用于D-半乳糖致衰老小鼠模型,探索该种因子的抗衰老作用,以期为下一步新型抗衰老食品的研发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
12 周龄SPF级昆明小鼠,雌雄各半,体质量(33±3) g(实验动物生产许可证号:SCXK(桂)2014-002),购自广西医科大学实验动物中心,饲养温度控制在(24±2) ℃,相对湿度(60±10)%,12 h昼夜交替,自由饮食饮水。所有小鼠均统一饲喂小鼠维持饲料,饲料购自北京科澳协力饲料有限公司,饲料符合GB 13078—2001《饲料卫生标准》和GB 14924.3—2010《实验动物配合饲料营养成分》。
W/O/W型活性肽-N复乳由广西大学食品与科学工程实验室自制;活性肽-N(纯度>95%)由某公司合成,氨基酸序列Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln,分子质量824.9 Da。
D-半乳糖 美国Sigma公司;吡拉西坦片(一种促思维记忆药) 湖南迪诺制药有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、乙酰胆碱酯酶(acetyl cholinesterase,AChE)试剂盒、考马斯亮蓝蛋白测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
Morris DMS-2型水迷宫 中国医学科学院;旷场测试系统 西班牙Panlab公司;Pico17低温冷冻离心机美国Thermo公司;JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;METASH UV-5200紫外-可见分光光度计 上海元析仪器有限公司;TG16W微量高速离心机 长沙平凡仪器仪表有限公司;JRA-2数显磁力搅拌水浴锅 金坛市科杰仪器厂;WGL-125B电热鼓风干燥箱 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 W/O/W型活性肽-N复乳的制备
参照李丽娜[17]的两步法制备,并稍作改进。首先将油相(V(液体石蜡)∶V(司盘-80)=1∶1)和内水相(活性肽-N溶于0.5 g/100 mL海藻酸钠)分别在水浴中加热至40 ℃,边搅拌边往油相中缓缓加入内水相,经磁力搅拌30 min得W/O初乳。进一步将外水相(1.0 g/100 mL壳聚糖、5.0 g/100 mL吐温-80和0.2 g/100 mL CaCl2溶液)同样在水浴中加热至40 ℃,边搅拌边将W/O初乳缓缓加入外水相中,经磁力搅拌30 min后,再用超声波细胞破碎机超声30 min,即得W/O/W型活性肽-N复乳。
1.3.2 动物分组及处理
72 只小鼠随机分为6 组,每组12 只,雌雄各半,分为年轻对照组、衰老模型组、吡拉西坦组、活性肽-N复乳低、中、高剂量组。除年轻对照组外,其他5 组每日上午颈背部皮下注射200 mg/kg D-半乳糖(以体质量计,下同),年轻对照组每日注射等体积的生理盐水。造模同时各组开始给予相应处理,每天在注射结束1 h之后进行灌胃,参考李军等[18]的方法进行,以吡拉西坦组作为阳性对照组,灌胃剂量为600 mg/(kg·d),活性肽-N复乳低、中、高剂量组灌胃剂量分别为2.5、25.0、125.0 µg/(kg·d),年轻对照组和衰老模型组每日灌胃等体积的蒸馏水,连续给药9 周。每周称量体质量1 次。
1.3.3 旷场实验
旷场实验于造模的第9周开始进行。使用一开口的黑色塑胶制测试箱(100 cm×100 cm×30 cm),箱底被等分成25 个正方形的方格(20 cm×20 cm),小鼠先被放进测试箱中适应环境3 min后开始实验,每只小鼠进行1 次测试。参照文献[19],将小鼠放入旷场行为测试箱的中心位置,让其在旷场中自由探索环境5 min,记录其在5 min内跨越的方格总数和后肢直立数,每一次实验之后,用75%乙醇及时清理干净旷场测试箱中粪便及尿液,以避免之前小鼠所留下的气味对后续实验造成影响。
1.3.4 Morris水迷宫实验
旷场实验结束后第二天开始进行Morris水迷宫实验,方法参照文献[20]进行。实验连续进行6 d,前5 d为定位航行实验,第6天为空间探索实验。定位航行实验方法:每天训练4 次,每次将小鼠分别从不同的入水点面向池壁放入水中,同时开始计时,记录小鼠从入水到找到水下隐藏平台所需的时间,即逃避潜伏期。如果60 s内未成功找到平台,则将小鼠引导到平台上,并让其在台上站立10 s,此时逃避潜伏期记为60 s。空间探索实验方法:第6天撤去水中平台,固定水池中任一象限的一个位置作为入水点,让小鼠在池内游泳60 s找寻平台,并记录小鼠60 s内的逃避潜伏期、穿越原平台所在位置总次数、在原平台所在象限的游泳时间及游泳速度。
1.3.5 标本采集处理与生化指标的检测
行为学实验之后,所有小鼠禁食、禁水12 h,然后称量体质量,摘除眼球取血,所采集血液于4 ℃、3 000 r/min离心15 min,取上清液分装,冻存于-80 ℃。
取血后,小鼠迅速脱颈处死,冰上取出脑组织,迅速冻存于-80 ℃。检测当日取出脑组织,称量质量,加入其质量9 倍体积的生理盐水,使用玻璃匀浆器在冰水浴中进行匀浆,获得10%脑组织匀浆,将匀浆液于4 ℃、3 000 r/min离心10 min,取匀浆上清液进行检测。
按照试剂盒说明书,分别对血清中的GSH-Px活力、MDA含量、脑组织中的AChE活力和蛋白含量进行检测。
1.4 数据统计分析
采用SPSS 19.0软件进行统计分析,结果表示为±s,组间比较采用单因素方差分析。P<0.05表示差异显著。
2 结果与分析
2.1 活性肽-N复乳对小鼠体质量的影响

表1 活性肽-N复乳对D-半乳糖致衰老小鼠体质量的影响(n=12)Table 1 Effect of active peptide-N multiple emulsion on body weight of D-galactose-induced aging mice (n= 12)
小鼠体质量的增长情况是反映其生长发育状况的重要指标之一[21]。由表1可知,各组小鼠之间的初始体质量并无明显差别(P>0.05)。而灌胃活性肽-N复乳后,小鼠的体质量分析结果表明,长期注射D-半乳糖对小鼠的体质量增长无显著作用。与年轻对照组和衰老模型组相比,活性肽-N复乳各剂量组的体质量差别不显著(P>0.05)。Magen等[22]的研究证明滴鼻给予每只Thy1-aSyn小鼠15 µg活性肽-N不会对它们的体质量增长产生不良影响。本研究发现活性肽-N复乳在2.5~125.0 µg/(kg·d)的灌胃剂量范围内也未对D-半乳糖致衰老小鼠的体质量增长产生影响,说明活性肽-N复乳对D-半乳糖致衰老小鼠的生长发育无不良影响。
2.2 旷场实验结果分析

表2 活性肽-N复乳对D-半乳糖致衰老小鼠运动探究能力的影响(n=12)Table 2 Effect of active peptide-N multiple emulsion on exploration ability D-galactose-induced aging mice (n= 12)
旷场实验主要是检测小鼠在新环境中的自主行为和运动探究能力[23]。由表2可知,衰老模型组与年轻对照组相比,小鼠穿越方格数和后肢直立次数均极显著减少(P<0.01),说明D-半乳糖致衰老小鼠模型的运动探究能力受到严重损害。与衰老模型组相比,吡拉西坦组、活性肽-N复乳中、高剂量组穿越方格数均显著增加(P<0.05,P<0.01),说明活性肽-N复乳能减轻致衰老因子的伤害,促进衰老小鼠的自主运动能力。同时,各实验组的后肢直立次数较衰老模型组均有所增加,其中活性肽-N复乳中、高剂量组与衰老模型组的差异达到显著水平(P<0.05,P<0.01),说明活性肽-N复乳能够在一定程度上提高衰老小鼠的探究能力。Merenlenger-Wagner等[10]的研究表明鼻饲活性肽-N能降低精神分裂症小鼠的自主活动,具有抗焦虑作用。目前尚鲜见关于活性肽-N复乳对衰老模型小鼠运动能力的影响方面的研究,本研究发现活性肽-N复乳能显著抵消甚至逆转衰老所致实验小鼠运动探究能力的下降。
2.3 Morris水迷宫结果分析
2.3.1 定位航行实验

表3 活性肽-N复乳对D-半乳糖衰老小鼠在水迷宫中逃避潜伏期的影响(n=12)Table 3 Effect of active peptide-N multiple emulsion on escape latency of D-galactose-induced aging mice in water maze test (n= 12)
Morris水迷宫实验主要是通过定位航行实验和空间探索实验来评估小鼠的空间学习记忆能力[24]。
表3反映了在5 d的定位航行实验中各组小鼠逃避潜伏期的变化情况,随着训练时间的延长,各组小鼠的逃避潜伏期均有下降,其中年轻对照组总体表现最佳;从第2天开始,衰老模型组小鼠的逃避潜伏期极显著长于年轻对照组(P<0.01),说明衰老模型组小鼠学习记忆能力衰退严重。而吡拉西坦组和活性肽-N复乳中、高剂量组与衰老模型组相比,其逃避潜伏期从第2天到第5天均显著降低(P<0.05,P<0.01),特别在训练的第3天,活性肽-N复乳中、高剂量组的表现甚至略微优于年轻对照组。Alcalay等[25]的研究结果表明老年小鼠经过长期滴鼻活性肽-N,其逃避潜伏期在实验的最后2 d才表现出显著的下降,而本研究中活性肽-N复乳中剂量组和高剂量组的逃避潜伏期均显著低于衰老模型组(P<0.05,P<0.01),对学习记忆损伤的修复效果更优,说明中剂量组和高剂量组的活性肽-N复乳对D-半乳糖致衰老小鼠的空间学习记忆力减退具有良好的逆转能力。
2.3.2 空间探索实验
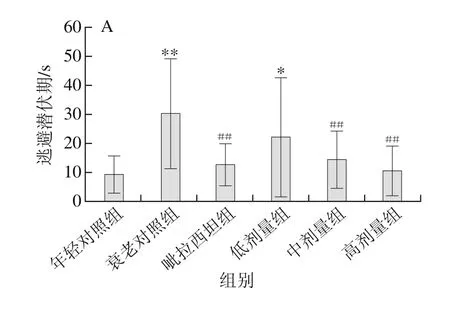

图1 活性肽-N复乳对D-半乳糖衰老小鼠在水迷宫中逃避潜伏期(A)、穿越平台次数(B)、目标象限停留时间(C)、游泳速度(D)的影响(n=12)Fig. 1 Effect of active peptide-N multiple emulsion on escape latency (A),the number of times crossing the platform (B), time spent in target quadrant (C) and swimming speed (D) of D-galactose-induced aging mice in water maze test (n = 12)
由图1可以看出,各组小鼠游泳速度无明显区别。衰老模型组小鼠的逃避潜伏期极显著长于年轻对照组(P<0.01),穿越平台次数和目标象限停留时间较年轻对照组均极显著减少(P<0.01)。而吡拉西坦组、活性肽-N复乳中、高剂量组与衰老模型组相比,其逃避潜伏期极显著下降(P<0.01),活性肽-N低剂量组也有一定程度的下降,但差异不显著(P>0.05)。同时吡拉西坦组、活性肽-N复乳中、高剂量组的穿越平台次数和目标象限停留时间较衰老模型组均显著增加和延长(P<0.05,P<0.01),且与年轻对照组相比无显著差异(P>0.05)。
在水迷宫实验中,各组小鼠的游泳速度无明显差别,而逃避潜伏期、目标象限停留时间和穿越平台次数却出现了显著的组间差异,表明长期注射大剂量的D-半乳糖会损害小鼠的空间学习记忆能力,而服用活性肽-N复乳后能有效改善这种损伤,且高剂量组的作用效果与吡拉西坦组差异不明显,这说明活性肽-N复乳对减缓衰老所致学习记忆衰退具有很好的效果。有研究表明滴鼻给予神经保护肽活性肽-N能缓解缺氧致局部缺血新生大鼠模型的学习记忆损伤,具有神经保护作用[26]。但是目前尚鲜见有关活性肽-N对D-半乳糖致衰老小鼠模型学习记忆作用效果的评价,本研究发现了活性肽-N复乳能减缓D-半乳糖所致的学习记忆障碍。
2.4 活性肽-N复乳对小鼠血清中GSH-Px活力、MDA含量的影响

表4 活性肽-N复乳对D-半乳糖衰老小鼠血清中GSH-Px活力、MDA含量的影响(n=8)Table 4 Effect of active peptide-N multiple emulsion on serum GSH-Px activity and MDA level in D-galactose-induced aging mice (n= 8)
机体氧化应激程度的加剧是衰老发生的重要原因之一,而氧化应激的程度和氧化与抗氧化体系的平衡紧密相关[27]。GSH-Px是体内重要的一类自由基清除剂和抗氧化酶,能有效缓解机体内的氧化损伤,它在H2O2的分解代谢和内源性代谢的过氧化物和氢过氧化物的解毒方面起着关键作用[28],其活力大小是衡量机体抗氧化能力的重要指标。由表4可知,与年轻对照组相比,衰老模型组小鼠血清中GSH-Px活力降低30.12%(P<0.01),说明D-半乳糖致衰老模型的抗氧化能力受到损伤。而与衰老模型组相比,吡拉西坦组和活性肽-N复乳各剂量组血清GSH-Px活力都有所增加,特别是吡拉西坦组与活性肽-N复乳高剂量组的GSH-Px活力的增加幅度分别达到了31.33%和28.38%(P<0.05)。因此,本研究结果表明摄入一定量的活性肽-N复乳能有效提高机体内GSH-Px活力,帮助机体减缓氧化损伤,尤以高剂量组效果最佳,效果接近吡拉西坦组。
MDA是体内脂质过氧化产物,体内产生的自由基会攻击脂质,导致脂质过氧化,从而生成MDA,MDA含量的多少可直接反映机体脂质过氧化水平[29]。因此进一步探究活性肽-N复乳对D-半乳糖致衰老小鼠体内MDA含量变化的影响。由表4可知,衰老模型组血清中MDA含量与年轻对照组相比升高了52.73%(P<0.01),进一步表明衰老模型造模成功。对比衰老模型组,吡拉西坦组和活性肽-N复乳各剂量组的MDA含量均有所降低,特别是吡拉西坦组和活性肽-N复乳高剂量组的MDA含量显著低于衰老模型组,其下降幅度分别为42.50%和26.19%(P<0.05,P<0.01)。因而,本研究结果进一步说明了活性肽-N复乳能提高机体的抗氧化能力。Sethy等[30]的研究表明滴鼻给予活性肽-N对低压缺氧大鼠模型及缺血性新生大鼠模型造成的氧化损伤具有保护作用,而本研究表明活性肽-N复乳能缓解D-半乳糖致衰老模型所造成的氧化损伤,说明活性肽-N复乳具有良好的抗氧化能力。同时,相较于其他研究发现的抗衰老多肽对氧化应激的保护作用所用剂量而言[5],本研究所用的活性肽-N复乳在相当低的剂量下,就能对氧化损伤起到较好的保护作用。
2.5 活性肽-N复乳对小鼠脑组织中AChE活力的影响

表5 活性肽-N复乳对D-半乳糖衰老小鼠脑组织中AChE活力的影响(n=8)Table 5 Effect of active peptide-N multiple emulsion on brain AChE activity of D-galactose-induced aging mice (n= 8)
由表5可知,与年轻对照组相比,衰老模型组的AChE活力极显著上升(P<0.01)。与衰老模型组相比,各实验组AChE活力均有所降低,特别是吡拉西坦组、活性肽-N复乳高剂量组的AChE活性显著降低,两组的下降幅度均为23.26%(P<0.05),说明活性肽-N复乳高剂量组与吡拉西坦组对抑制衰老小鼠脑组织内AChE活力的效果相当。虽然活性肽-N复乳低、中剂量组的AChE活力与衰老模型组相比,差异未达显著性(P>0.05),但其AChE活力的下降幅度也分别达到了13.95%、16.28%。
中枢胆碱能系统与学习记忆密切相关,其功能的紊乱往往被认为与学习记忆功能的衰退有着直接联系[31]。AChE作为中枢胆碱能系统的重要代表物之一,其功能是分解与学习记忆相关的重要的神经递质乙酰胆碱(acetylcholine,ACh),通过检测其活力的高低可以间接推测出脑内ACh含量的高低,同时它也是胆碱能神经系统活性的间接指标[32],因此D-半乳糖致衰老小鼠模型脑组织的中枢胆碱能系统功能下降,主要表现在AChE活力的上升,ACh合成、利用障碍,进而影响小鼠空间学习记忆能力。李婧炜[33]研究发现静脉注射TGN-NP/NAP对阿尔兹海默病小鼠模型的海马和皮层AChE活力均有明显的抑制作用,而本研究则发现,给非病态小鼠灌胃高剂量活性肽-N复乳后,也能显著抑制D-半乳糖致衰老小鼠全脑中的AChE活力,表明活性肽-N复乳对衰老小鼠中枢胆碱能系统有一定的保护作用。此外,大量研究表明提高中枢胆碱能系统的功能是改善D-半乳糖致衰老模型小鼠学习记忆能力的基础[34]。因此,在本研究中,活性肽-N复乳可能是通过对中枢胆碱能系统的保护作用来改善衰老模型小鼠学习记忆损伤的。
综上所述,本研究在固定其他饮食成分的情况下添加活性肽-N复乳,检测其抗衰老活性,以促思维记忆药吡拉西坦作为阳性对照,发现活性肽-N复乳高剂量组(125.0 µg/(kg·d))和吡拉西坦组(600 mg/(kg·d))均能明显提高D-半乳糖致衰老小鼠的学习记忆、运动探究及抗氧化能力(P<0.05,P<0.01),且两者的作用效果均相差不大(P>0.05),但吡拉西坦所用剂量是活性肽-N复乳所用剂量的4 800 倍,提示活性肽-N复乳在极低的剂量下就能具备良好的延缓衰老的作用。Sokolowska等[12]的研究表明活性肽-N对小鼠兴奋毒性脑白质损伤的保护作用具有剂量-效应关系。而在本研究中,旷场实验和Morris水迷宫实验结果显示,活性肽-N复乳3 个剂量组的运动探究能力和学习记忆能力均得到了一定程度的提高,但中、高剂量组表现更佳,而在对血清中GSH-Px活力、MDA含量及脑组织中AChE活力检测时,结果也表明是活性肽-N复乳高剂量组的效果最好,说明活性肽-N复乳对衰老的延缓作用同样具有剂量-效应关系。
3 结 论
本研究利用D-半乳糖致衰老模型对活性肽-N复乳的抗衰老作用进行评价,发现活性肽-N复乳对小鼠生长发育无不良影响,中剂量和高剂量的活性肽-N复乳能明显提高D-半乳糖致衰老小鼠的运动探究能力,改善其学习记忆能力(P<0.05,P<0.01),高剂量的活性肽-N复乳能显著缓解机体的氧化应激水平(降低血清中MDA含量,提高GSH-Px活力)(P<0.05),降低脑组织的AChE活力(P<0.05)。以上结果表明活性肽-N口服制剂对D-半乳糖致衰老小鼠具有明显的抗衰老作用,同时说明活性肽-N复乳在新型抗衰老食品的开发方面具有良好的应用前景。
[1] GOGELE M, PATTARO C, FUCHSBERGER C, et al. Heritability analysis of life span in a semi-isolated population followed across four centuries reveals the presence of pleiotropy between life span and reproduction[J]. The Journals of Gerontology, 2010, 66(1): 26-37.DOI:10.1093/gerona/glq163.
[2] DAVINELLI S, WILLCOX D C, SCAPAGNINI G. Extending healthy ageing: nutrient sensitive pathway and centenarian population[J].Immunity & Ageing, 2012, 9(1): 1-7. DOI:10.1186/1742-4933-9-9.
[3] KORHONEN H, PIHLANTO A. Bioactive peptides: production and functionality[J]. International Dairy Journal, 2006, 16(9): 945-960.DOI:10.1016/j.idairyj.2005.10.015.
[4] KORHONEN H. Milk-derived bioactive peptides: from science to applications[J]. Journal of Functional Foods, 2009, 1(2): 177-187.DOI:10.1016/j.jff.2009.01.007.
[5] 王常青, 任海伟, 王海凤, 等. 黑豆多肽对D-半乳糖衰老小鼠抗氧化能力的影响[J]. 食品科学, 2010, 31(3): 262-266.
[6] ROJAS-RONQUILO R, CRUZ-GUERRERO A, FLORES-NAJERA A,et al. Antithrombotic and angiotensin-converting enzyme inhibitory properties of peptides released from bovine casein by Lactobacillus casei Shirota[J]. International Dairy Journal, 2012, 26(2): 147-154.DOI:10.1016/j.idairyj.2012.05.002.
[7] JAVITT D C, BUCHANAN R W, KEEFE R S E, et al. Effect of the neuroprotective peptide davunetide (AL-108) on cognition and functional capacity in schizophrenia[J]. Schizophrenia Research, 2012,136(1/2/3): 25-31. DOI:10.1016/j.schres.2011.11.001.
[8] BASSAN M, ZAMOSTIANO R, DAVIDSON A, et al. Complete sequence of a novel protein containing a femtomolar-activitydependent neuroprotective peptide[J]. Journal of Neurochemistry,1999, 72(3): 1283-1293. DOI:10.1046/j.1471-4159.1999.0721283.x.
[9] GOZES I, BRENNEMAN D E. A new concept in the pharmacology of neuroprotection[J]. Journal of Molecular Neuroscience, 2000, 14(1/2):61-68. DOI:10.1385/JMN:14:1-2:01.
[10] MERENLENDER-WAGNER A, PIKMAN R, GILADI E, et al. NAP(davunetide) enhances cognitive behavior in the STOP heterozygous mouse: a microtubule-def i cient model of schizophrenia[J]. Peptides,2010, 31(7): 1368-1373. DOI:10.1016/j.peptides.2010.04.011.
[11] JOUROUKHIN Y, OSTRITSKY R, ASSAF Y, et al. NAP(davunetide) modifies disease progression in a mouse model of severe neurodegeneration: protection against impairments in axonal transport[J]. Neurobiology of Disease, 2013, 56: 79-94. DOI:10.1016/j.nbd.2013.04.012.
[12] SOKOLOWSKA P, PASSEMARD S, MOK A, et al. Neuroprotective effects of NAP against excitotoxic brain damage in the newborn mice:implications for cerebral palsy[J]. Neuroscience, 2011, 173: 156-168.DOI:10.1016/j.neuroscience.2010.10.074.
[13] LEKER R R, TEICHNER A, GRIGORIADIS N, et al. NAP, a femtomolar-acting peptide, protects the brain against ischemic injury by reducing apoptotic death[J]. Stroke, 2002, 33(4): 1085-1092.DOI:10.1161/01.STR.0000014207.05597.D7.
[14] HEIMESAAT M M, FISCHER A, KUHL A A, et al. Antiinf l ammatory properties of NAP in acute toxoplasma gondii-induced ileitis in mice[J]. European Journal of Microbiology and Immunology,2015, 5(3): 210-220. DOI:10.1556/1886.2015.00025.
[15] LEE H J. Protein drug oral delivery: the recent progress[J].Archives Pharmacal Research, 2002, 25(5): 572-584. DOI:10.1007/BF02976925.
[16] PAPPENHEIMER J R, DAHL C E, KAMOVSKY M L, et al.Intestinal absorption and excretion of octapeptides composed of D amino acids[J]. Proceedings of the National Academy of Science of the United States of America, 1994, 91(5): 1942-1945. DOI:10.1073/pnas.91.5.1942.
[17] 李丽娜. 担载胰岛素的凝胶新型W/O/W多重乳液的制备[D]. 大连:大连理工大学, 2006: 16-43.
[18] 李军, 林丽文, 辛勤, 等. 绿茶多酚抗衰老作用研究[J]. 食品与药品,2013, 15(2): 106-109.
[19] LIN X, ZHANG S, HUANG R, et al. Protective effect of madecassoside against cognitive impairment induced by D-galactose in mice[J]. Pharmacology Biochemistry and Behavior, 2014, 124: 434-442. DOI:10.1016/j.pbb.2014.07.014.
[20] ZHANG X L, JIANG B, LI Z B, et al. Catalpol ameliorates cognition def i cits and attenuates oxidative damage in the brain of senescent mice induced by D-galactose[J]. Pharmacology Biochemistry and Behavior,2007, 88(1): 64-72. DOI:10.1016/j.pbb.2007.07.004.
[21] 刘贵珊, 杨博, 张泽生, 等. 白藜芦醇对D-半乳糖致衰老小鼠学习记忆能力和脑组织抗氧化能力的影响[J]. 食品科学, 2014, 35(5): 204-207. DOI:10.7506/spkx1002-6630-201405040.
[22] MAGEN I, OSTRITSKY R, RICHTER F, et al. Intranasal NAP(davunetide) decreases tau hyperphosphorylation and moderately improves behavioral deficits in mice overexpressing α-synuclein[J].Pharmacology Research & Perspectives, 2014, 2(5): 1-21.DOI:10.1002/prp2.65.
[23] 常艳芬, 宫文霞, 郑艳红, 等. 黄芩醇提物干预D-半乳糖致衰老大鼠的尿液代谢组学研究[J]. 药学学报, 2016, 51(1): 86-92.DOI:10.16438/j.0513-4870.2015-0597.
[24] SOUZA L C, ANTUNES M S, FILHO C B, et al. Flavonoid chrysin prevents age-related cognitive decline via attenuation of oxidative stress and modulation of BDNF levels in aged mouse brain[J].Pharmacology Biochemistry and Behavior, 2015, 134: 22-30.DOI:10.1016/j.pbb.2015.04.010.
[25] ALCALAY R N, GILADI E, PICK C G, et al. Intranasal administration of NAP, a neuroprotective peptide, decreases anxietylike behavior in aging mice in the elevated plus maze[J]. Neuroscience Letters, 2004, 361(1/2/3): 128-131. DOI:10.1016/j.neulet.2003.12.005.
[26] GREGGIO S, DE PAULA S, DE OLIVEIRA I M, et al. NAP prevents acute cerebral oxidative stress and protects against longterm brain injury and cognitive impairment in a model of neonatal hypoxia-ischemia[J]. Neurobiology of Disease, 2011, 44(1): 152-159.DOI:10.1016/j.nbd.2011.06.018.
[27] 徐成, 卢虹玉, 章超桦, 等. 牡蛎酶解提取物对D-半乳糖致衰小鼠学习记忆的影响[J]. 食品工业科技, 2016, 37(2): 347-351.DOI:10.13386/j.issn1002-0306.2016.02.062.
[28] PENG X Y, KONG B H, YU H Y, et al. Protective effect of whey protein hydrolysates against oxidative stress in D-galactose-induced ageing rats[J]. International Dairy Journal, 2014, 34(1): 80-85.DOI:10.1016/j.idairyj.2013.08.004.
[29] 万全, 王艳梅, 林琳, 等. 黄缘盒龟多肽对D-半乳糖致亚急性衰老小鼠抗氧化能力的影响[J]. 现代食品科技, 2013, 29(9): 2075-2080.DOI:10.13982/j.mfst.1673-9078.2013.09.004.
[30] SETHY N K, SHARMA N K, DAS M, et al. Protein prof i ling reveals antioxidant and signaling activities of NAP (davunetide) in rodent hippocampus exposed to hypobaric hypoxia[J]. Journal of Molecular Neuroscience, 2014, 54(3): 414-429. DOI:10.1007/s12031-014-0381-9.
[31] ZHANG X L, JIN C Z, LI Y C, et al. Catalpol improves cholinergic function and reduces inflammatory cytokines in the senescent mice induced by D-galactose[J]. Food and Chemical Toxicology, 2013, 58:50-55. DOI:10.1016/j.fct.2013.04.006.
[32] RUAN Q W, HU X N, AO H F, et al. The neurovascular protective effects of huperzine A on D-galactose-induced inf l ammatory damage in the rat hippocampus[J]. Gerontology, 2014, 60(5): 424-439.DOI:10.1159/000358235.
[33] 李婧炜. 噬菌体展示技术筛选脑靶向功能肽及其修饰纳米粒的脑内递药研究[D]. 上海: 复旦大学, 2012: 143-145.
[34] QU Z, YANG H G, ZHANG J Z, et al. Cerebralcare granule®, a Chinese herb compound preparation, attenuates D-galactose induced memory impairment in mice[J]. Neurochemical Research, 2016, 41(9):2199-2214. DOI:10.1007/s11064-016-1934-9.
Protective Effect of Active Peptide-N on D-Galactose-Induced Aging in Mice
CHEN Yu1, LIU Hongji1,2, YOU Qianqian1, YUAN Jinglin1, SONG Qi1, HAO Dan1, LIU Dong1, LAN Haijing1, LI Quanyang1,*
(1. College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China;2. JE Flow Tech (Shanghai) Co. Ltd., Shanghai 201404, China)
Herein, we evaluated the effect of active peptide-N as a new anti-aging agent on aging model mice. For this purpose, an aging model was established by subcutaneously injecting mice with D-galactose (200 mg/(kg·d)) once daily for nine weeks. Thereafter, the mice was separately orally administered with multiple emulsion containing active peptide-N at doses of 2.5, 25.0 and 125.0 µg/ (kg·d). The open field and the Morris water maze test were used to evaluate the locomotor activity and learning and memory ability of mice. Furthermore, glutathione peroxidase (GSH-Px) activity and malondialdehyde (MDA) content in the serum, and acetyl cholinesterase (AChE) activity in the brain tissue of mice were measured. The results showed that active peptide-N multiple emulsion could signif i cantly improve the locomotor activity and learning and memory ability of D-galactose-induced aging mice. The activity of serum GSH-Px was improved by 28.38%(P < 0.05), the concentration of serum MDA was decreased by 26.19% (P < 0.05), and the brain AChE activity was increased by 23.26% in the treated groups (P < 0.05) compared with the aging model group. These results demonstrate that active peptide-N multiple emulsion has an obvious anti-aging effect in D-galactose-induced aging mice.
active peptide-N multiple emulsion; D-galactose; anti-aging; learning and memory
10.7506/spkx1002-6630-201801027
R151.4
A
1002-6630(2018)01-0178-07
陈燏, 刘洪吉, 尤倩倩, 等. 活性肽-N对D-半乳糖致衰老小鼠的作用效果[J]. 食品科学, 2018, 39(1): 178-184.
DOI:10.7506/spkx1002-6630-201801027. http://www.spkx.net.cn
CHEN Yu, LIU Hongji, YOU Qianqian, et al. Protective effect of active peptide-N on D-galactose-induced aging in mice[J]. Food Science, 2018, 39(1): 178-184. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801027.http://www.spkx.net.cn
2016-10-12
国家自然科学基金面上项目(31371762)
陈燏(1992—),女,硕士研究生,研究方向为食品营养与健康。E-mail:124166715@qq.com
*通信作者简介:李全阳(1964—),男,教授,博士,研究方向为食品营养与功能性食品。E-mail:liquanyang@gxu.edu.cn
