苦荞对高脂膳食诱导小鼠生理及肠道菌群的影响
2018-01-08周小理刘泰驿闫贝贝周一鸣
周小理,刘泰驿,闫贝贝,王 宏,肖 瀛,周一鸣*
(上海应用技术大学香料香精技术与工程学院,上海 201418)
苦荞对高脂膳食诱导小鼠生理及肠道菌群的影响
周小理,刘泰驿,闫贝贝,王 宏,肖 瀛,周一鸣*
(上海应用技术大学香料香精技术与工程学院,上海 201418)
以苦荞为研究对象,通过高脂膳食诱导建立血脂代谢紊乱小鼠模型,利用高效液相色谱和平板计数对血脂代谢指标及肠道菌群的变化规律及其相关性进行研究,初步探究了苦荞对血脂代谢紊乱小鼠生理及肠道菌群的影响。结果表明:高脂膳食可引发小鼠血脂代谢紊乱,苦荞淀粉和蛋白均能显著降低血脂指标(血清总胆固醇、甘油三酯、低密度胆固醇)的水平(P<0.05),并基本恢复至空白组的水平。通过平板计数对各组小鼠的肠道主要菌群(双歧杆菌、乳酸菌、大肠杆菌、肠球菌)检测,发现苦荞淀粉和苦荞蛋白干预组的小鼠肠道菌中有益菌(双歧杆菌、乳酸菌、肠球菌)数量均显著高于高脂组(P<0.05),有害菌(大肠杆菌)数量则显著低于高脂组(P<0.05)。此外,相关性分析结果表明,苦荞中蛋白和淀粉均可吸附胆汁酸与胆固醇并促进其排泄,从而不仅能调节血脂代谢又能调节肠道菌群平衡,同时,肠道菌群中益生菌比例的增多和有害菌比例的降低又对血脂代谢调节与抑制氧化应激有着一定促进作用。因此,苦荞对血脂代谢调节作用可能与其促进胆酸排泄、调节肠道菌群平衡、改善氧化应激等方面有着密切关系。
苦荞;血脂代谢;肠道菌群;淀粉;蛋白
荞麦(Fagopyrum esculentum)为荞麦属,营养丰富,被现代营养学家誉为21世纪有前途的最风行的绿色食品,国外将之视为“高级营养保健品”。随着人们的饮食结构逐渐向纯天然型和保健型发展,有着“药食兼用”美誉的荞麦及其系列食品越来越受到人们的青睐。因此,大力开发和研制荞麦保健食品有着广阔的市场前景、较高的经济价值和社会价值。荞麦的栽培品种分为甜荞和苦荞,其中苦荞具有较高的营养价值和药用价值[1],目前对于苦荞营养成分的研究主要集中在对其营养成分的提取、鉴定[2]以及其抗氧化[3-4]、降血糖[5]等功能的研究,而对于苦荞调节血脂代谢及肠道菌群和两者相关性方面的研究却鲜有报道。
人体肠道内(肠黏液、肠腔、粪便)存在着数以亿计的菌群,即肠道菌群,其数目已经大大超过了人体的细胞,同时肠道菌群的基因是人类所携带基因的100多倍,它们长期与人类宿主共存,相互依赖,形成了一个复杂的肠道微生态系统,成为了人体不可或缺的一部分。大量研究证明,肠道微生物菌群在各营养素的合成、吸收与利用中都起到了至关重要的作用,而且还能抵御外来菌群的入侵与增殖,对机体的免疫系统也起到了保护作用[5-7]。因此肠道微生物菌群对人和动物机体健康的影响受到越来越多的重视。同时,人类所不能利用的一些碳水化合物可以被肠道中的微生物分解吸收,如抗性淀粉、木聚糖、果胶、纤维素、半纤维素等[8]。肠道微生物通过分解酶来分解碳水化合物后产生乙酸、丙酸及丁酸等可吸收的短链脂肪酸,且一般情况下这3 种短链脂肪酸的比例为60∶25∶15[9]。这些短链脂肪酸可以被肠道黏膜快速吸收,并可以给予结肠肠壁细胞能源,对肠道健康起重要作用,其中丁酸是抗性淀粉发酵的最重要产物,它在保证肠道的健康水平中起到了至关重要的作用[10]。同时这些短链脂肪酸也可以通过降低肠道pH值,控制一些致病菌的生长[11]。
苦荞蛋白、淀粉的消化和吸收利用率较低,因而可到达肠道,作为肠道菌群的发酵底物[12]。本实验通过高脂膳食诱导建立动物(C57BL/6小鼠)模型,分析小鼠血浆的总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)等血脂指标以及肠道菌群的变化及其相关性,研究摄入苦荞后对小鼠血脂代谢及肠道菌群的影响。
1 材料与方法
1.1 材料、试剂与实验动物
苦荞籽粒(品种为‘黑丰一号’),产自山西省左云县。
氢氧化钠、盐酸、硫酸、无水乙醇(均为分析纯)国药集团(上海)化学试剂有限公司;黄酮标准品、胆固醇标准品 上海宝曼生物科技有限公司;TC测定试剂盒、TG测定试剂盒、HDL-C测定试剂盒、LDL-C测定试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、总胆汁酸试剂盒 南京建成生物工程研究所;MRS琼脂培养基、BBL琼脂培养基、伊红美蓝琼脂培养基、肠球菌培养基 青岛海博生物科技有限公司。
C57BL/6小鼠(雄性,4 周龄,SPF级,体质量14~16 g),购于上海斯莱克实验动物有限责任公司,合格证号为SCXK(沪)2007-0005。
1.2 仪器与设备
30A超高效液相色谱、TQ8040气相色谱、2800紫外-可见光分光光度计 日本Shimadzu公司;M200 PRO酶标仪 奥地利帝肯公司;SW-CJ-IBU超净工作台 苏净集团技术有限公司;YQX-Ⅱ厌氧培养箱 上海龙跃仪器设备有限公司;冷冻干燥机 北京博医康实验仪器有限公司;KDN-04C消化炉、ATN-300全自动凯氏定氮仪 上海洪纪仪器设备有限公司;K280R冷冻离心机英国森特恩公司;Delta320 pH计 梅特勒-托利多仪器(上海)有限公司;DY2009(X)手提式压力蒸汽灭菌锅 上海博迅实业有限公司;BPH-9082精密恒温培养箱 上海一恒科学仪器有限公司;QB-600高速振荡混合器 海门市其林贝尔仪器制造有限公司;KK26E28TI超低温电冰箱 德国西门子有限公司。
1.3 方法
1.3.1 苦荞样品的制备
按照参考文献[13-16]制备苦荞样品,流程如下。
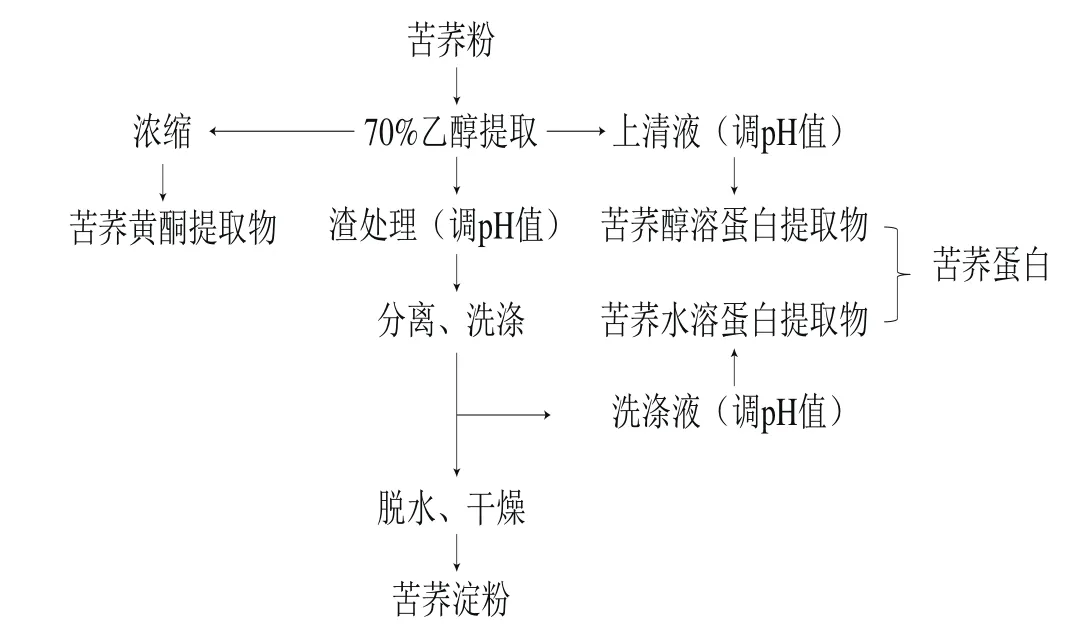
1.3.2 实验动物饲养及分组
将60 只C57BL/6小鼠以AIN-93G标准饲料预饲1 周,按体质量随机分为5 组,每组9 只:空白组(只喂食AIN-93G标准饲料);高脂组(喂食的饲料中含有10%(质量分数,下同)脂肪、1%胆固醇和0.5%胆酸钠);苦荞淀粉组(在高脂组饲料的基础上用40%苦荞淀粉替代40%α-玉米淀粉);苦荞蛋白粉组(在高脂组饲料的基础上用20%苦荞蛋白替代20%酪蛋白);苦荞黄酮组(在高脂组饲料的基础上添加0.5%苦荞黄酮提取物)。将小鼠同室且分笼饲养,进行自然光照,并自由饮食和饮水,将环境温度控制在(22±2)℃,相对湿度为60%。
1.3.3 小鼠血样和组织样处理
饲养6周后称质量,用乙醚将小鼠麻醉后眼球取血,血液立即放入预先用肝素钠处理的离心管内,4 ℃、4 000 r/min离心15 min后取上清血浆,并保存在-80 ℃的冰箱中待测。随后立即解剖,迅速取出小鼠的结肠和十二指肠并称质量,同时分别称取约200 mg,加入预冷的磷酸盐缓冲液(phosphate buffered saline,PBS),并在冰浴条件下制备成质量分数10%的组织匀浆液,于4 ℃、3 000 r/min离心10 min,取上清液,并保存在-80 ℃的冰箱中待测。
1.3.4 小鼠血脂生化指标的测定
采用试剂盒测定血浆TG、TC、HDL-C、LDL-C的含量,具体操作方法根据试剂盒的说明书进行。
1.3.5 小鼠粪便中蛋白质和脂肪的消化率测定
分别测定各实验组饲料和粪便中蛋白质和脂肪的含量,按下式计算蛋白质和脂肪的消化率。

1.3.6 小鼠血浆及组织氧化还原指标的测定
用试剂盒测定CAT活力、T-AOC、SOD活力和MDA的含量,具体操作方法根据试剂盒的说明书进行。
1.3.7 小鼠粪便中总胆汁酸含量的测定
用试剂盒测定总胆汁酸的含量,具体操作方法根据试剂盒的说明书进行。
1.3.8 小鼠粪便中胆固醇含量的测定
参照GB/T 22220—2008《食品中胆固醇的测定 高效液相色谱法》[17]测定小鼠粪便中胆固醇含量。
1.3.9 肠道菌群的培养
取1 g新鲜粪便于无菌离心管中,按照1∶9(m/V)比例加入无菌PBS稀释,涡旋混匀,获得10-1稀释液。再将10-1稀释液进行梯度稀释,直至获得10-4、10-5、10-6稀释液。分别取100 μL的10-4、10-5、10-63 种梯度稀释液涂布于伊红美蓝琼脂培养基(检测大肠杆菌,37 ℃培养24 h)、MRS琼脂培养基(检测乳酸菌,37 ℃培养48 h)、肠球菌琼脂培养基(检测肠球菌,37 ℃培养48 h)、BBL琼脂培养基(检测双歧杆菌,37 ℃厌氧培养48 h)上,并且每个稀释度做3 个平行,整个过程30 min中内完成。按照前述培养条件进行培养,之后进行菌落计数,结果表示为lg(CFU/g)。菌落计数前,首先挑取特征菌落,进行生态生化实验,鉴定该菌属。
1.4 数据统计分析
采用Excel软件对实验数据进行处理,并采用SPSS 11.5软件中的方差分析法对实验数据进行显著性差异分析,以P<0.05为差异显著,用双变量方法对数据进行相关性分析,结果表示为±s。
2 结果与分析
2.1 苦荞主要营养成分对小鼠血脂生化指标的影响
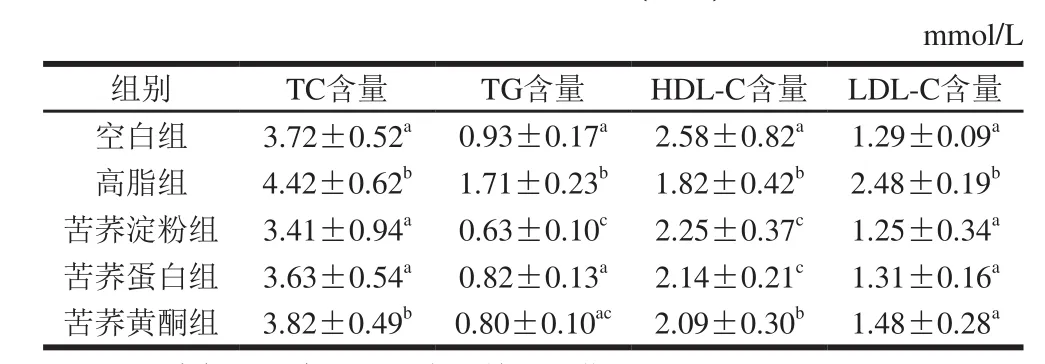
表1 苦荞对小鼠血脂水平的影响(n=9)Table 1 Effect of tartary buckwheat on serum TC, TG, LDL-C, and HDL-C levels in mice (n= 9)
由表1可知,高脂组血浆中的TC、TG含量最高,且均显著高于空白组(P<0.05),由此证明高脂建模成功。同时,苦荞淀粉组和苦荞蛋白组血浆中的TC、TG含量较高脂组均有显著降低(P<0.05);此外,较空白组,高脂膳食诱导后HDL-C含量显著降低(P<0.05),LDL-C含量显著升高(P<0.05),而与高脂组相比,喂食含有苦荞淀粉、苦荞蛋白、苦荞黄酮的饲料后HDL-C含量均有升高,而LDL-C含量显著降低(P<0.05),并且苦荞淀粉组和苦荞蛋白组均较好地恢复至空白组水平。
2.2 小鼠蛋白质与脂肪消化率的变化
营养物质消化率是机体从某种营养物质中吸收的营养素占摄入营养素的比值,反映了食物营养物被消化酶分解、吸收的水平[18]。由表2可知,高脂组的蛋白质和脂肪消化率均显著低于空白组(P<0.05),这是由于高脂饮食能使消化系统自由基生成增加,从而降低消化酶活性,使机体对营养物质的消化吸收下降。经过喂食不同成分的饲料后各组消化率均有不同程度的降低,其中苦荞淀粉组的蛋白质和脂肪消化率较高脂组分别降低了9.76%和4.06%,苦荞蛋白组分别降低了6.93%和2.05%,并均具有显著差异(P<0.05)。
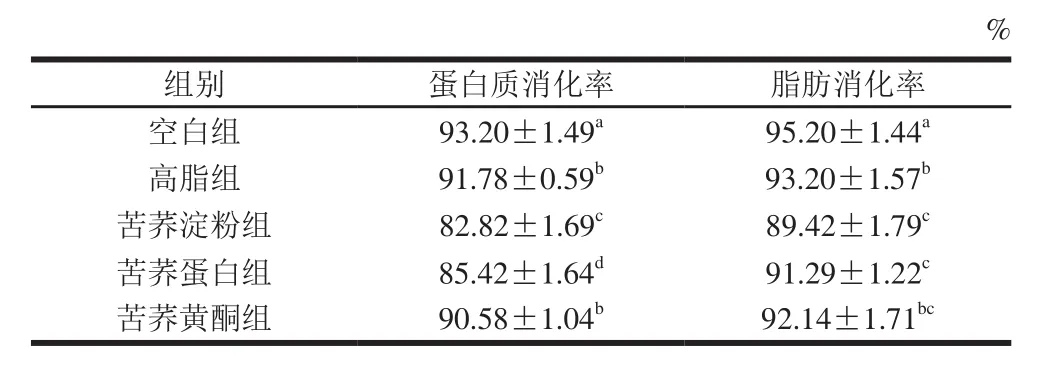
表2 小鼠蛋白质与脂肪的消化率(n=3)Table 2 Protein and fat digestibility in mice (n= 3)
2.3 小鼠粪便中总胆汁酸和胆固醇水平的变化
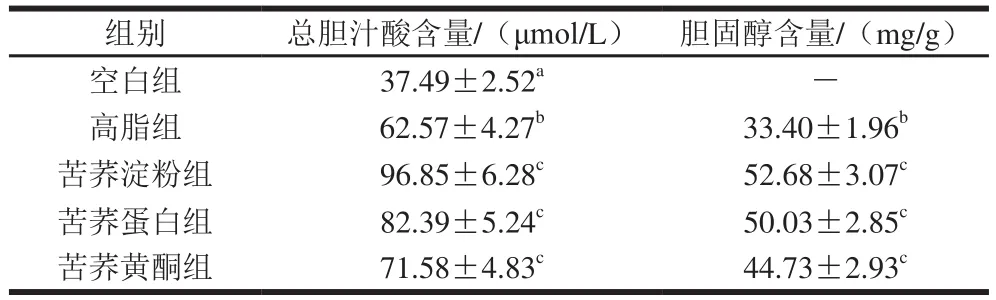
表3 小鼠粪便中总胆汁酸和胆固醇的水平(n=3)Table 3 Total bile acid and cholesterol contents in mice feces (n= 3)
肝脏通过胆固醇7-α羟化酶催化胆固醇氧化生成胆汁酸,胆固醇排出体外的主要形式即为胆汁酸。胆汁酸不仅可作为信号分子调节机体内的能量代谢,还有较强的抗菌作用,能调节机体的肠道微生物区系,抑制肠道有害细菌的增殖[19]。由表3可知,与高脂组相比,苦荞蛋白组、苦荞淀粉组、苦荞黄酮组均能显著增加总胆汁酸含量(P<0.05),说明这些成分抑制了胆汁酸的重吸收;高脂膳食诱导后,粪便中胆固醇含量均有显著升高(P<0.05,空白组中未检出,即为0,以此计算显著性)。随着苦荞淀粉、苦荞蛋白、苦荞黄酮的摄入,胆固醇含量有不同程度的增加,其中苦荞淀粉组小鼠粪便的胆固醇含量最高,其次是苦荞蛋白组,表明苦荞淀粉、苦荞蛋白能影响胆固醇的代谢,抑制胆固醇的吸收。
2.4 苦荞对小鼠肠道组织匀浆氧化还原指标的影响
由表4可知,高脂膳食可显著降低肠道组织匀浆液中SOD活力(P<0.05),饲喂不同成分的饲料后,结肠、十二指肠的SOD活力均有显著提高(P<0.05)。T-AOC可以全面反映机体整体的抗氧化水平。高脂膳食诱导可导致小鼠结肠、十二指肠的T-AOC显著下降,而各实验组的T-AOC均有所上升,其中苦荞淀粉组的T-AOC最高,苦荞蛋白组和苦荞黄酮组的T-AOC次之。MDA是机体内环境脂质过氧化反应的终极代谢产物,其含量高低可以代表机体的脂质过氧化水平,在一定条件下间接地揭示了细胞被破坏的程度[20-21]。高脂膳食诱导可引起小鼠结肠、十二指肠的MDA含量显著上升(P<0.05),而苦荞蛋白组、苦荞淀粉组和苦荞黄酮组均可显著抑制高脂饮食引起的小鼠结肠的脂质过氧化(P<0.05),苦荞黄酮组也能显著抑制十二指肠中的MDA含量上升。CAT活力反映整个机体的氧化应激水平[22],高脂膳食可显著降低CAT的活力(P<0.05),说明其抗氧化能力较弱,而喂养不同的饲料后CAT活力均显著升高(P<0.05),且苦荞淀粉组的效果最佳,苦荞蛋白组和苦荞黄酮组次之。由此说明苦荞蛋白、淀粉和黄酮均能保护机体抗氧化系统,改善高脂膳食引起的氧化应激,且苦荞蛋白组和苦荞淀粉组的脏器抗氧化活性总体上均能恢复至空白组的水平。

表4 苦荞对小鼠肠道组织抗氧化指标的影响(n=9)Table 4 Effect of tartary buckwheat on antioxidant indexes in intestinal tissues of mice (n= 9)
2.5 苦荞对小鼠肠道菌群数量的影响

图1 苦荞对小鼠肠道菌群的影响(n=3)Fig. 1 Effect of tartary buckwheat on intestinal fl ora in mice (n = 3)
由图1可知,小鼠经过高脂饮食诱导后肠道内的有益菌(双歧杆菌、乳酸菌、肠球菌)显著减少(P<0.05),有害菌(大肠杆菌)显著增多(P<0.05);在经过喂食含有苦荞淀粉、苦荞蛋白、苦荞黄酮的饲料后,有益菌显著增多(P<0.05),有害菌则显著减少(P<0.05)。说明苦荞淀粉、苦荞蛋白、苦荞黄酮均具有调节肠道菌群的功能,而且苦荞淀粉组的效果最好。
通过平板计数以及生态生化实验对各组小鼠的肠道主要菌群(双歧杆菌、乳酸菌、大肠杆菌、肠球菌)数量进行检测,二者结果的变化趋势基本一致,即苦荞蛋白组与苦荞淀粉组的有益菌(双歧杆菌、乳酸菌、肠球菌)数量均显著高于高脂组(P<0.05),有害菌(大肠杆菌)数量则显著低于高脂组(P<0.05)。表明苦荞淀粉、苦荞蛋白具有调节高脂膳食小鼠肠道菌群失衡的作用,从而一定程度抑制血脂的紊乱及组织的氧化应激。
2.6 生理生化指标与肠道菌群的相关性分析
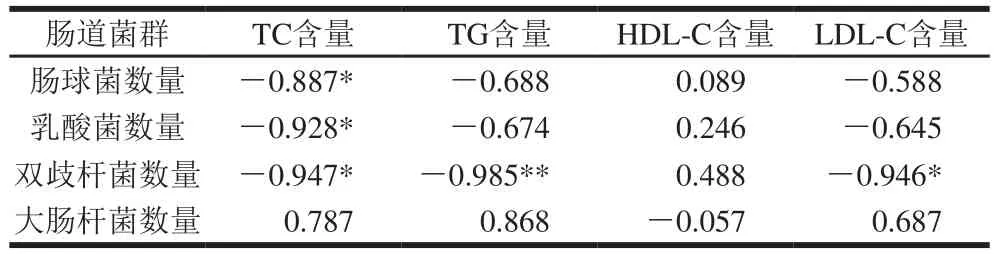
表5 血脂指标与肠道菌群数量的相关性分析(n=3)Table 5 Correlation analysis between blood lipid indexes and intestinal microbial populations (n= 3)
从表5中可以得出,大肠杆菌数量与HDL-C含量呈负相关,与其他血脂指标均呈正相关;双歧杆菌、乳酸菌、肠球菌数量与HDL-C含量呈正相关,与其余指标均呈负相关,表明HDL-C含量越高,有益菌数量越高,其中双歧杆菌数量与TG含量极显著负相关(P<0.01)、与TC、LDL-C含量显著负相关(P<0.05)。
2.7 肠道代谢产物与肠道菌群及消化率相关性分析
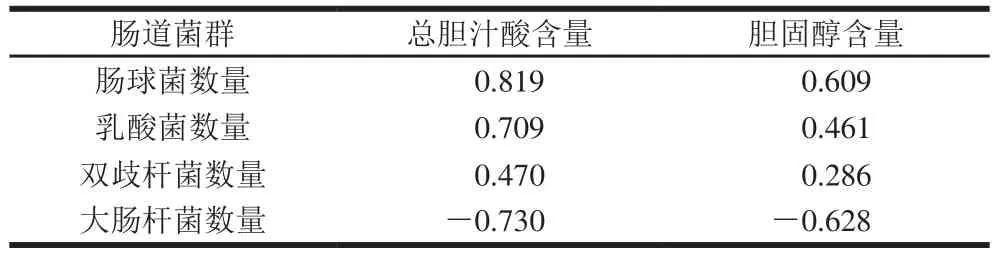
表6 肠道菌群数量与肠道代谢物的相关性分析(n=3)Table 6 Correlation analysis between intestinal microbial populations and intestinal metabolites (n= 3)
由表6可知,有益菌(双歧杆菌、乳酸菌、肠球菌)数量与肠道代谢物呈正相关,有害菌(大肠杆菌)数量则与之相反;其中大肠杆菌菌数量与肠道代谢物含量呈负相关。

=3)Table 7 Correlation analysis between digestibility and metabolites contents (n= 3)表7 消化率与代谢产物含量的相关性分析(n
由表7可知,蛋白质、粗脂肪的消化率与总胆汁酸、胆固醇的排泄量呈显著负相关(P<0.05),其中总胆汁酸含量与粗脂肪消化率呈极显著负相关(P<0.01),表明消化率越高,总胆汁酸和胆固醇的排泄量越低。由此可以说明苦荞蛋白质消化率低,且未消化的苦荞蛋白质可与胆汁酸及胆固醇吸附排除体外,可能从而干预了血脂代谢的紊乱。
2.8 肠道组织主要抗氧化指标与肠道菌群相关性分析

表8 肠道组织主要抗氧化指标与肠道菌群数量的相关性(n= 3)Table 8 Correlation analysis between gut antioxidant indexes and microbial populations (n= 3)
由表8可知,大肠杆菌数量与MDA含量呈正相关,与其他指标均呈负相关,说明肠道中脂质过氧化产物含量越高,大肠杆菌数量越高;肠球菌、双歧杆菌、乳酸菌数量与MDA含量呈负相关,与其他指标均呈正相关,其中双歧杆菌数量与T-AOC和CAT活力呈极显著或显著正相关(P<0.01,P<0.05)。
3 结 论
通过喂食小鼠含不同苦荞组分的饲料,研究苦荞对高脂膳食诱导小鼠肠道主要菌群数量及肠道组织器官抗氧化指标的影响,实验结果表明:苦荞不同组分(蛋白、淀粉和黄酮类化合物)均能够增加肠道益生菌(乳酸菌、双歧杆菌、肠球菌)的数量,降低有害菌(大肠杆菌)的数量。其中,苦荞蛋白组与苦荞淀粉组的小鼠肠道中有益菌(双歧杆菌、乳酸菌、肠球菌)数量均显著高于高脂组(P<0.05),有害菌(大肠杆菌)数量则显著低于高脂组(P<0.05)。同时,高脂膳食会导致小鼠体内产生大量自由基,从而引起氧化应激[23-25],进而显著提高LDL-C、MDA含量,而表现机体抗氧化能力的T-AOC,SOD、CAT活力明显降低(P<0.05)。喂食苦荞可以增加肠道内的乳酸菌、双歧杆菌水平,降低大肠杆菌水平,提高肠道组织中SOD活力、MDA含量、T-AOC等抗氧化指标,降低血液TG、TC、LDL-C的含量,达到降低体脂、消除氧化应激的目的。本研究发现苦荞可以有效抑制高脂膳食引起的血脂紊乱及组织的氧化应激,并且具有调节高脂膳食小鼠肠道菌群失衡的作用。同时,随着苦荞的摄入,小鼠粪便中总胆汁酸的分泌增加,即肠道对胆固醇的吸收减少。由此说明,苦荞可以通过增加肠道内胆汁酸的排泄,抑制肠道对胆汁酸的重吸收,进而影响肠道对胆固醇的吸收,此外,胆汁酸具有一定的抑菌作用,肠道内胆汁酸的增加也可以减少肠道中大肠杆菌的数量[25-27]。最后通过相关性分析可知,苦荞蛋白可吸附胆汁酸与胆固醇,促进其排泄,从而即调节血脂代谢又调节肠道菌群平衡,而肠道菌群中益生菌比例增多和有害菌比例的降低又对血脂代谢调节与抑制氧化应激有着一定促进作用。因此,苦荞蛋白对血脂代谢的调节作用可能与其促进胆酸排泄、调节肠道菌群平衡、改善氧化应激等有着密切关系。
[1] UNANDER D. Buckwheat. Fagopyrum esculentum Moench.Promoting the conservation and use of underutilized and neglected crops, Vol. 19[J]. Economic Botany, 2002, 56(1): 110.DOI:10.1663/0013-0001(2002)056.
[2] 陶健. 荞麦蛋白的制备及功能特性研究[D]. 杨凌: 西北农林科技大学, 2004: 19-24.
[3] 李飞, 任清, 季超, 等. 苦荞籽粒黄酮的提取纯化及抗氧化活性研究[J]. 食品科学技术学报, 2015, 33(6): 57-64; 82. DOI:10.3969/j.issn.2095-6002.2015.06.010.
[4] 喻辉辉. 苦荞提取物对大鼠血糖及血脂的影响[J]. 中医药导报,2010, 16(7): 122-123. DOI:10.3969/j.issn.1672-951X.2010.07.066.
[5] CAESAR R, FÅK F, BÄCKHED F F. Effects of gut microbiota on obesity and atherosclerosis via modulation of inf l ammation and lipid metabolism[J]. Journal of Internal Medicine, 2010, 268(4): 320-328.DOI:10.1111/j.1365-2796.2010.02270.x
[6] ZHANG Y, LIMAYE P B, RENAUD H J, et al. Effect of various antibiotics on modulation of intestinal microbiota and bile acid prof i le in mice[J]. Toxicology and Applied Pharmacology, 2014, 277(2):138-145. DOI:10.1016/j.taap.2014.03.009.
[7] ARUMUGAM M, RAES J, PELLETIER E, et al. Enterotypes of the human gut microbiome[J]. Nature, 2011, 473: 174-180. DOI:10.1038/nature09944.
[8] 陈昊杰. 胆汁酸对草鱼生长、脂质代谢及肠道微生物区系的影响[D].杨凌: 西北农林科技大学, 2016: 48-54.
[9] 骞宇. 抗消化淀粉对实验鼠肠道生理环境和胃肠功能性作用的影响[D]. 重庆: 西南大学, 2013: 102-142.
[10] YANG N, LI Y M, ZHANG K, et al. Hypocholesterolemic activity of buckwheat fl our is mediated by increasing sterol excretion and downregulation of intestinal NPC1L1 and ACAT2[J]. Journal of Functional Foods, 2014, 6(1): 311-318. DOI:10.1016/j.jff.2013.10.020.
[11] WALTERS W A, XU Z, KNIGHT R. Meta-analyses of human gut microbes associated with obesity and IBD[J]. FEBS Letters, 2014,588(22): 4223-4233. DOI:10.1016/j.febslet.2014.09.039.
[12] 唐传核, 彭志英. 荞麦抗消化蛋白的营养特性[J]. 粮油食品科技,2001, 9(2): 15-16. DOI:10.3969/j.issn.1007-7561.2001.02.009.
[13] SUN Y, GU S, GUO L, et al. Preparative separation of fi ve fl avones from fl owers of Polygonum cuspidatum by high-speed countercurrent chromatography[J]. Journal of Separation Science, 2014, 37(13):1703-1709. DOI:10.1002/jssc.201400153.
[14] 卢飞. 苦荞麦淀粉的制备及理化性质分析[D]. 绵阳: 西南科技大学,2012: 16-31.
[15] KAYASHITA J, NAGAI H, KATO N. Buckwheat protein extract suppression of the growth depression in rats induced by feeding amaranth (Food Red No. 2)[J]. Bioscience, Biotechnology, and Biochemistry, 1996, 60(9): 1530-1531. DOI:10.1271/bbb.60.1530.
[16] YONG J C, LEE S. Extraction of rutin from Tartary buckwheat milling fractions and evaluation of its thermal stability in an instant fried noodle system[J]. Food Chemistry, 2015, 176(3): 40-44. DOI:10.1016/j.foodchem.2014.12.020.
[17] 中国计量科学研究院. 食品中胆固醇的测定 高效液相色谱法:GB/T 22220—2008[S]. 北京: 中国标准出版社, 2008: 1-8.
[18] HU Y Y, ZHAO Y, REN D Y, et al. Hypoglycemic and hepatoprotective effects of d-chiro-inositol-enriched tartary buckwheat extract in high fructose-fed mice[J]. Food & Function, 2015, 6(12):3760-3769. DOI:10.1039/c5fo00612k.
[19] 王文婷. RS4型甘薯抗性淀粉对高脂饮食C57BL/6J小鼠血脂和肠道的影响[D]. 雅安: 四川农业大学, 2013: 31-37.
[20] 贾冬英, 姚开, 张海均. 苦荞麦的营养与功能成分研究进展[J]. 粮食与饲料工业, 2012, 12(5): 25-27. DOI:10.3969/j.issn.1003-6202.2012.05.008.
[21] 张丹萍, 丁丁. 黄酮类化合物药理作用的研究[J]. 北方药学,2015(8): 150-151. DOI:10.3969/j.issn.1009-4822.2011.02.012.
[22] ZHU F. Chemical composition and health effects of Tartary buckwheat[J]. Food Chemistry, 2016, 203: 231-245. DOI:10.1016/j.foodchem.2016.02.050.
[23] LEE D G, JANG I S, YANG K E, et al. Effect of rutin from tartary buckwheat sprout on serum glucose-lowering in animal model of type 2 diabetes[J]. Acta Pharmaceutica, 2016, 66(2): 297-302.DOI:10.1515/acph-2016-0021.
[24] FLEISSNER C K, HUEBEL N, ABD E M M, et al. Absence of intestinal microbiota does not protectmice from diet-induced obesity[J]. British Journal of Nutrition, 2010, 104(6): 919-929.DOI:10.1017/S0007114510001303.
[25] PARK S, SADANALA K C, KIM E K. A metabolomic approach to understanding the metabolic link between obesity and diabetes[J]. Moleculer Cells, 2015, 38(7): 587-596. DOI:10.14348/molcells.2015.0126.
[26] MARCHESI J R, ADAMS D H, FAVA F, et al. The gut microbiota and host health: a new clinical frontier[J]. Gut, 2015, 65(2): 330-339.DOI:10.1136/gutjnl-2015-309990.
[27] 赵兰涛, 任玮, 张英, 等. 黑米对小鼠肠道菌群的影响[J]. 食品与机械, 2012, 28(3): 24-27. DOI:10.3969/j.issn.1003-5788.2012.03.007.
Effect of Dietary Supplementation of Tartary Buckwheat on Physiological Metabolism and Intestinal Flora in Mice with High-Fat Diet Induced Dyslipidemia
ZHOU Xiaoli, LIU Taiyi, YAN Beibei, WANG Hong, XIAO Ying, ZHOU Yiming*
(School of Perfume and Aroma Technology, Shanghai Institute of Technology, Shanghai 201418, China)
The objective of this work was to ascertain the effect of dietary supplementation of tartary buckwheat on the physiological metabolism and intestinal fl ora of dyslipidemic mice. For this purpose, a mouse model of dyslipidemia was created by feeding mice a high-fat diet (HFD). Changes in serum lipid metabolism-related indicators and the intestinal fl ora were determined respectively by high performance liquid chromatography and the plate count method and were correlated with each other. The results showed that HFD induced lipid metabolic disturbance and that both protein and starch from tartary buckwheat signif i cantly reduced serum lipid levels in dyslipidemic mice to almost normal values (P < 0.05). The number of benef i cial intestinal bacteria (Bif i dobacterium, Lactobacillus, and Enterococcus) in the tartary buckwheat starch and protein intervention groups was significantly higher than in the HFD group (P < 0.05), and the number of harmful bacteria (Escherichia coli) was signif i cantly lower (P < 0.05). Furthermore, correlation analysis indicated that both tartary buckwheat starch and protein could adsorb bile acid and cholesterol and consequently promote their excretion, thereby regulating serum lipid metabolism and the intestinal microbial flora balance. Meanwhile, the increased proportion of intestinal priobiotic bacteria and the decreased proportion of harmful bacteria promoted lipid metabolism modulation and oxidative stress inhibition. Therefore, tartary buckwheat regulates blood lipid metabolism most likely by promoting bile acid salt excretion, regulating the intestinal fl ora balance, and improving oxidative stress.
tartary buckwheat; lipid metabolism; intestinal fl ora; starch; protein
10.7506/spkx1002-6630-201801026
TS218
A
1002-6630(2018)01-0172-06
周小理, 刘泰驿, 闫贝贝, 等. 苦荞对高脂膳食诱导小鼠生理及肠道菌群的影响[J]. 食品科学, 2018, 39(1): 172-177.
DOI:10.7506/spkx1002-6630-201801026. http://www.spkx.net.cn
2016-12-26
国家自然科学基金面上项目(31371761);国家自然科学基金青年科学基金项目(31501437);
上海市“化学工程与技术(香料香精技术与工程)”高原学科项目
周小理(1957—),女,教授,学士,研究方向为食品新资源深度开发与利用。E-mail:zhouxl@sit.edu.cn
*通信作者简介:周一鸣(1981—),男,副教授,博士,研究方向为功能食品开发、食品加工与工艺。E-mail:zhouymsit@163.com
ZHOU Xiaoli, LIU Taiyi, YAN Beibei, et al. Effect of dietary supplementation of tartary buckwheat on physiological metabolism and intestinal fl ora in mice with high-fat diet induced dyslipidemia[J]. Food Science, 2018, 39(1): 172-177. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801026. http://www.spkx.net.cn
