面包皮中水溶性晚期糖基化终产物对人肾小管上皮细胞的氧化损伤
2018-01-08贾本盼袁晓金范智义李巨秀
贾本盼,袁晓金,范智义,胡 静,李巨秀*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
面包皮中水溶性晚期糖基化终产物对人肾小管上皮细胞的氧化损伤
贾本盼,袁晓金,范智义,胡 静,李巨秀*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
晚期糖基化终产物(advanced glycation end products,AGEs)是食品在热加工和贮藏过程中形成的一类化合物,与心血管疾病、糖尿病、肾病等多种慢性病的发生有重要联系。本实验研究了含有AGEs的面包皮水提取物(bread crust extract,BCE)对人肾小管上皮细胞(human kidney tubular epithelial cells,HKCs)内氧化应激的影响及细胞损伤。采用不同质量浓度的BCE处理HKCs,并经噻唑蓝法确定后续BCE处理质量浓度;通过检测细胞内活性氧(reactive oxygen species,ROS)、总超氧化物歧化酶(superoxide dismutase,SOD)、脂质过氧化产物丙二醛(malondialdehyde,MDA)及培养上清液中乳酸脱氢酶(lactic dehydrogenase,LDH)水平,评价BCE对HKCs胞内氧化应激平衡及细胞损伤程度的影响。结果表明:不同质量浓度的BCE处理24 h后,HKCs胞内ROS水平随着BCE质量浓度的增大不断升高,且在8 mg/mL和12 mg/mL时胞内ROS水平达到最大值;与对照组相比,胞内MDA含量在BCE质量浓度为4 mg/mL和8 mg/mL时极显著增加(P<0.01),但BCE质量浓度达12 mg/mL时,MDA含量却显著降低(P<0.05)。相反,胞内总SOD活力却随着BCE质量浓度的增大而降低,在8 mg/mL和12 mg/mL时,胞内总SOD活力发生极显著降低(P<0.01)。胞外分泌型LDH水平随着BCE处理质量浓度的增大而升高,在BCE质量浓度为8 mg/mL和12 mg/mL时,LDH活力发生极显著增加(P<0.01)。因此,BCE可以通过提高HKCs胞内活性氧水平,引起胞内总SOD活力降低,进而促进细胞发生脂质过氧化反应,改变细胞膜通透性,使胞外LDH活力升高,导致细胞严重受损。
人肾小管上皮细胞;面包皮水提取物;氧化损伤;脂质过氧化
非酶糖基化反应是还原糖如葡萄糖、果糖等与蛋白质游离氨基之间发生的可逆反应[1],生成的Schiff碱经过分子重排形成结构相对稳定的Amadori产物。Amadori产物再经过一系列化学反应,包括多重脱水、裂解及活性二羰基中间产物的氧化修饰,形成多样、稳定的加合物,即晚期糖基化终产物(advanced glycation endproducts,AGEs)[2-3]。体内AGEs的来源主要有体内生成和膳食摄入两种途径,而长期摄入高AGEs含量的食物是引起体内AGEs水平增加的主要原因[4]。
AGEs在体内积累会引起机体产生一系列与氧化衰老或糖尿病相关的病理生理学疾病,如高血糖症记忆力、肩凝症、动脉粥样硬化、慢性肾功能不全和阿尔茨海默综合征等疾病[5-11]。AGEs与人体氧化应激密切相关[12],其主要通过与细胞表面特异性AGEs受体结合,引起细胞内氧化应激水平的改变,进而激活胞内信号通路,调节细胞应激反应。
肾脏是AGEs在体内循环与排泄的重要器官,肾功能损伤直接影响体内AGEs水平及相关并发症的产生。研究发现,慢性肾病的患病率逐年上升,全球发病率高达5%~7%[13],其中西方国家成年人发病率为8%~10%[14]。在慢性肾病病人中,患高血糖或高血压病人占3/4[15]。在许多肾脏疾病最终发展成为末期肾衰竭过程中,肾小管间质受损程度与病情的发展趋势有着密切联系[16]。肾小管上皮细胞长期暴露于高浓度AGEs下可能会引起肾小管上皮细胞抗氧化性能损伤,加速肾脏疾病的产生。
AGEs可以改善食品色泽和风味,广泛存在于面包等烘焙食品中。Ruhs等[3]通过对面包皮进行热水浸提得到面包皮水提取物(bread crust extract,BCE),并通过斑点杂交实验发现BCE中含有精氨酸-嘧啶、羧甲基赖氨酸、3-羟基-4-羟甲基-1-(5-氨基-5-羟基戊基)-吡啶和其他非特异性结构的AGEs;进一步研究发现BCE可引起心肌成纤维细胞胞内活性氧(reactive oxygen species,ROS)水平升高,核转录因子κB、p42/44和p38等信号通路激活及下游炎症因子的表达。目前,对膳食AGEs与人类慢性病的关系研究较少,尤其在膳食中可溶性AGEs对人肾小管上皮细胞(human kidney tubular epithelial cells,HKCs)的损伤及降低HKCs抗氧化能力的研究还缺乏系统研究报道。
本研究通过B C E作用于H K C s,利用噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-diphenytetrazoliumromide,MTT)法分析BCE处理质量浓度对HKCs活力的影响,通过检测HKCs胞内ROS水平、超氧化物歧化酶(superoxide dismutase,SOD)活力、脂质过氧化物丙二醛(malondialdehyde,MDA)含量及上清液中乳酸脱氢酶(lactic dehydrogenase,LDH)活力的改变,进一步探究BCE对HKCs的损伤机理,为研究膳食性AGEs与人体健康之间的联系提供理论依据。
1 材料与方法
1.1 材料与试剂
HKCs购自国家实验细胞资源共享平台;面包购自杨凌当地面包房。
DMEM/F12培养基 美国Hyclone公司;MTT、二甲基亚砜(dimethyl sulfoxide,DMSO)、2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA) 美国Sigma公司;RIPA细胞裂解液、BCA蛋白定量试剂盒 西安赫特生物科技有限公司;胎牛血清 杭州四季青生物工程材料有限公司;MDA试剂盒、总SOD试剂盒、LDH试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
3111型CO2细胞培养箱 美国Thermo公司;YT-CJ-2N型超净工作台 北京亚泰科隆实验科技开发中心;XDS-1B倒置生物显微镜 重庆光电仪器有限公司;Victor X3型多功能酶标仪 美国PE公司;PharmaSpec UV-1700紫外-可见分光光度计 日本岛津公司;F-4500荧光分光光度计 日本日立公司;CS110-4冷冻干燥机 丹麦LaboGene公司;RE201D旋转蒸发器 巩义市予华仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 面包皮的提取
将面包皮经室温通风干燥后,粉碎机粉碎。BCE的提取方法参照文献[17]并略作修改。准确称取250 g面包皮粉末,加入300 mL氯仿,置于摇床中,室温振荡1 h,漏斗过滤弃滤液,重复操作3 次。剩余固体室温通风干燥后,加400 mL蒸馏水,50 ℃水浴提取3 h,重复提取2 次。合并提取液,8 000 r/min、4 ℃离心20 min,0.45 μm滤膜过滤,40 ℃旋转蒸发浓缩后冷冻干燥得到固态BCE,密封存于-80 ℃待用。
1.3.2 面包皮及BCE中荧光性AGEs的测定
面包皮和BCE中荧光性AGEs的检测参照Morales等[18]的方法,略加修改。称取100 mg面包皮粉末于10 mL离心管中,加入1.2 mg/mL的链霉素蛋白酶E溶液3 mL(链霉素蛋白酶E溶于含5 mg/mL十二烷基硫酸钠和1.47 mg/mL CaCl2的Tris-HCl中,pH 7.5)。漩涡振荡后,于40 ℃摇床中振荡消化36 h,冷却后于4 ℃、4 500×g离心10 min。取上清液,0.45 μm滤膜过滤后,磷酸盐缓冲液(phosphate buffered saline,PBS)适当稀释后用荧光分光光度计在激发波长347 nm、发射波长415 nm处测定荧光强度,以AU/mg表示。
1.3.3 MTT法检测BCE对HKCs活力的影响
37 ℃、5% CO2培养箱中培养HKCs,培养基为含10%胎牛血清的DMEM/F12。待细胞融合至80%左右,用0.25%胰蛋白酶-EDTA消化传代,参照Mosmann[19]的方法进行MTT实验。取对数生长期细胞,制成单细胞悬液(约105个/mL),接种于96 孔板中,每孔200 μL,5% CO2培养箱中培养24 h,弃原培养液,加无血清培养基饥饿培养24 h后,实验组分别加入无血清培养基配制的4、8、12、16、20、25 mg/mL的BCE 200 μL,对照组以200 μL无血清培养基替代。每组设6 个复孔,培养24 h。弃培养液,PBS洗涤2 次,每孔再加入150 μL MTT工作液,37 ℃ 5% CO2培养箱中孵育4 h。弃孵育液,加150 μL DMSO,缓慢振荡10 min,酶标仪于570 nm波长处测定OD值。以150 μL DMSO为空白组调零。细胞活力根据以下公式计算。

1.3.4 BCE对HKCs内ROS水平的影响
根据Konrad等[20]的方法,对细胞内ROS水平进行检测。其中,细胞内ROS水平与胞内荧光强度成正比例关系。HKCs接种于12 孔板中,待细胞融合至90%左右,无血清培养基饥饿培养24 h后,用无血清培养基配制的不同质量浓度的BCE(0、4、8、12 mg/mL)处理细胞24 h,弃培养液,PBS洗涤,加无血清培养基配制的10 μmol/L DCFH-DA荧光探针1 mL,37 ℃避光孵育20 min。弃探针培养液,无血清培养基洗涤,用荧光酶标仪于激发波长488 nm、发射波长535 nm处检测细胞内荧光强度,表示胞内ROS水平。
1.3.5 BCE对HKCs内MDA含量及总SOD活力的影响
通过检测MDA含量来评估细胞内脂质过氧化水平和细胞膜受损程度,检测总SOD活力来评估胞内抗氧化酶系活力。细胞接种于6孔板中,按照1.3.3节方法处理细胞,待水提物处理24 h后,弃培养液,预冷的PBS洗2 次,每孔加300 μL含有苯甲基磺酰氟(1 mmol/L)的RIPA裂解液,充分裂解。4 ℃、12 000 r/min离心10 min,取裂解上清液(细胞蛋白提取过程均在冰上进行),采用试剂盒测定胞内总蛋白含量、MDA含量和总SOD活力。
1.3.6 BCE对HKCs培养上清液中LDH活力的影响
细胞培养和BCE处理均按照1.3.4节方法进行。待不同质量浓度BCE处理24 h后,收集细胞培养上清液并用试剂盒测定LDH活力。
1.4 数据统计分析
所有实验均进行3 次重复,数据以 ±s表示。利用DPS 7.05数据处理软件进行分析,并通过Duncan’s新复极差法检验数据间差异的显著性(P<0.05)。
2 结果与分析
2.1 面包皮和BCE中AGEs荧光强度
BCE组中AGEs荧光强度(2 072 AU/mg)与面包皮中AGEs总荧光强度(2 907 AU/mg)相比极显著下降(P<0.01)。但BCE组的荧光强度依然达到2 000 AU/mg以上,说明BCE中还含有较多荧光性物质。
AGEs是多种分子结构不同物质的总称,具有交联及产生荧光的特性[21]。但羧甲基赖氨酸、羧乙基赖氨酸和吡咯素等AGEs无荧光性[22],因此荧光性只能反映部分AGEs的含量[23]。Delgadoandrade等[24]对西方谷物早餐食品中荧光性美拉德反应产物进行检测,发现总荧光性美拉德反应产物含量是游离荧光性美拉德反应产物的10 倍左右。本实验中,面包皮中总荧光性AGEs含量只达到BCE中的1.4 倍左右,经水提取后主要为水溶性游离态AGEs。所以,高含量的AGEs可能是BCE引起细胞损伤的主要原因。
2.2 BCE对HKCs活力的影响
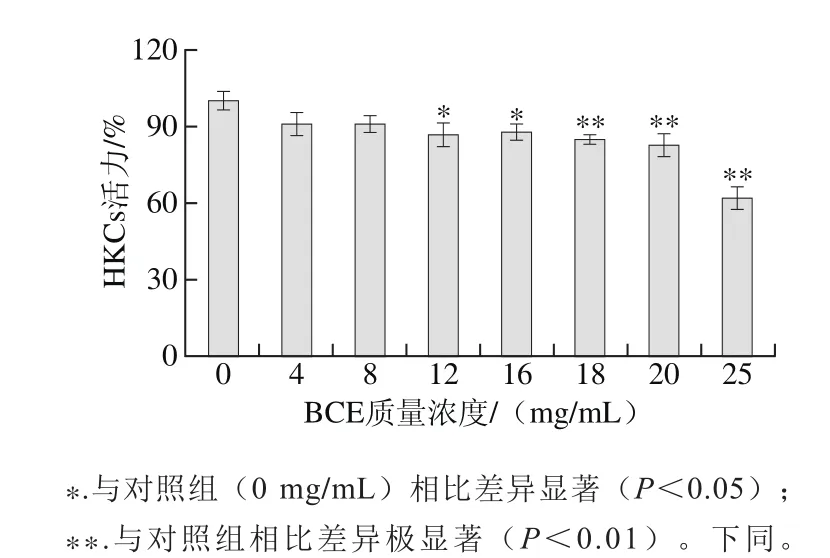
图1 BCE对HKCs活力的影响Fig. 1 Effect of BCE on the viability of HKCs
如图1所示,与对照组相比,BCE对HKCs活力的抑制在所选质量浓度范围内呈剂量依赖性。在BCE质量浓度为0~8 mg/mL时,HKCs活力虽有所抑制但均无显著性差异(P>0.05)。12 mg/mL BCE处理组对细胞活力的抑制与对照组相比有显著差异(P<0.05)。因此在不显著影响细胞活力的前提下,选取4、8、12 mg/mL 3 个质量浓度进行后续实验。
Ruhs等[3]研究发现用BCE处理鼠心肌成纤维细胞时,30 mg/mL BCE并没有对心肌成纤维细胞活力产生显著性抑制,甚至在低质量浓度下还提高了细胞活力。而本实验中,BCE对HKCs活力产生了显著的抑制作用,并随着BCE质量浓度的增大而增强。
2.3 BCE对HKCs胞内ROS水平的影响
研究发现ROS在细胞吞噬作用过程中对抵御抗原具有重要作用,但过量ROS能引起机体产生氧化应激状态,导致蛋白质、脂类物质及核酸的氧化,进而导致细胞死亡[25]。
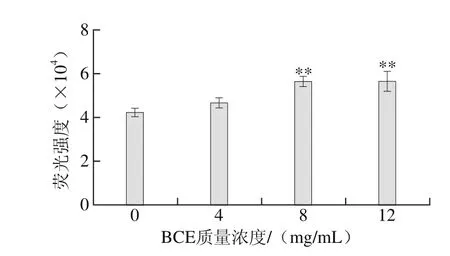
图2 BCE对上清液HKCs胞内ROS水平的影响Fig. 2 Effect of BCE on ROS levels in HKCs
由图2可知,与对照组相比,BCE处理后HKCs内ROS水平随着BCE质量浓度的增加而升高。4 mg/mL BCE处理组时,胞内荧光强度与对照组相比无显著差异(P>0.05)。而8、12 mg/mL BCE处理组细胞内荧光强度与对照组相比差异极显著(P<0.01),但两处理组之间无显著差异(P>0.05)。
Tsukagoshi等[26]发现,高水平的ROS会损伤细胞,进而会导致细胞正常生理功能紊乱。本实验中8 mg/mL BCE可能引起细胞内抗氧化酶系活性受损,降低了对胞内ROS的清除能力,导致胞内ROS水平达到饱和状态。因此,当BCE质量浓度达12 mg/mL时,胞内ROS水平不再发生显著性增加(P>0.05)。Mohd等[27]认为ROS作为糖化产物处理细胞后的中间产物,参与了细胞毒性作用,且这种毒性可能是由蛋白质与细胞膜相互聚合或通过其他机制产生。
2.4 BCE对HKCs内脂质过氧化反应的影响
MDA是膜脂过氧化最重要的产物之一,被认为是脂质过氧化反应的标志物[7]。氧化应激可诱导细胞膜脂质体发生严重的过氧化反应,产生大量自由基,进而损伤细胞膜[28]。因此,可通过测定胞内MDA含量变化来评价细胞内脂质过氧化程度[29],进而间接地反映膜系统受损程度[30]。
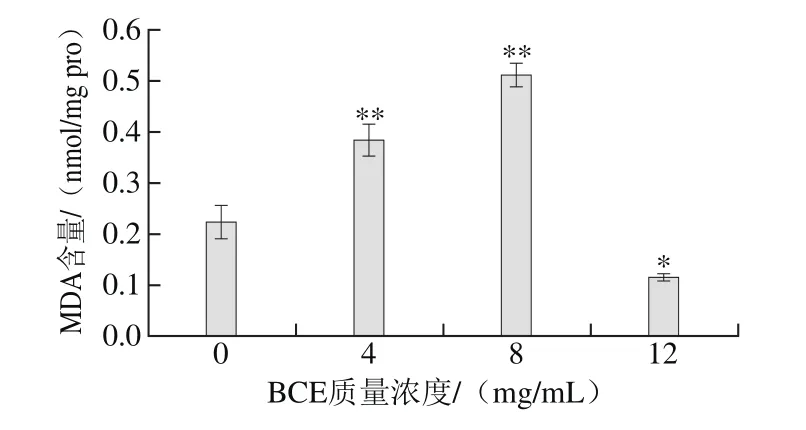
图3 BEC对HKCs胞内MDA含量的影响Fig. 3 Effect of BCE on MDA content in HKCs
如图3所示,BCE处理质量浓度在0~8 mg/mL时,随着BCE质量浓度的增大,胞内MDA含量极显著升高(P<0.01)。8 mg/mL BCE处理组胞内MDA含量约是对照组的2 倍,达到最大值。但12 mg/mL BCE处理组胞内MDA含量与对照组相比却显著降低(P<0.05),只达到对照组MDA含量的一半。
BCE处理HKCs后引起ROS水平升高,同时可能引起胞内自由基含量也随之增高,这些自由基可能通过诱导细胞膜脂质过氧化,导致细胞损伤及脂质过氧化物的产生[31]。由此,BCE质量浓度在0~8 mg/mL时,可能引起胞内自由基含量增加,从而诱导细胞膜脂质发生过氧化反应,使细胞膜受损。因此,胞内MDA含量不断升高意味着细胞膜的受损程度在不断加剧。BCE质量浓度达12 mg/mL时,胞内MDA含量与对照组相比却显著降低(P<0.05),表明12 mg/mL BCE可能严重损伤了细胞膜的正常功能,造成细胞膜通透性增加,导致胞内MDA含量降低。
2.5 BCE对HKCs胞内总SOD活力的影响
SOD作为重要的抗氧化酶系,在自由基引起的氧化损伤过程中,通过清除细胞内产生的自由基,阻断自由基连锁反应[32],提高细胞抗氧化能力,保护细胞免受氧化损伤。机体内SOD活力的下降表明机体抗自由基毒性能力下降,即机体氧化受损程度增加[33]。因此研究HKCs胞内SOD活力可以评估BCE对胞内抗氧化酶系的损伤程度,进一步确定BCE处理后细胞的受损程度。
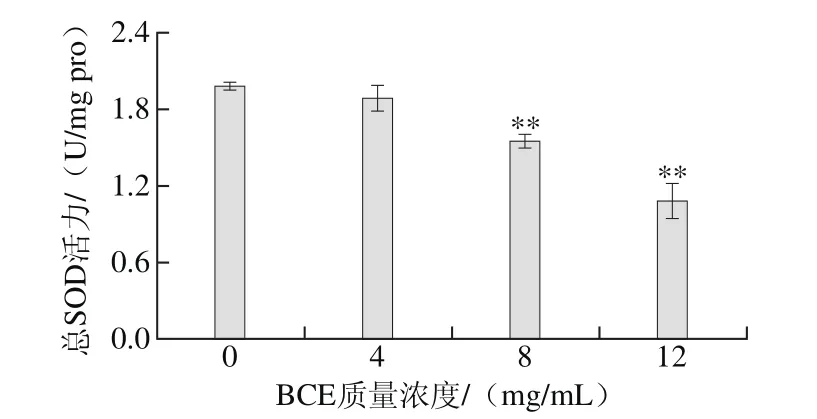
图4 BCE对HKCs胞内总SOD活力的影响Fig. 4 Effect of BCE on total SOD activity in HKCs
如图4所示,4 mg/mL BCE处理组细胞内总SOD活力与对照组相比虽降低,但无显著差异(P>0.05),然而当BCE质量浓度增加到8、12 mg/mL时,胞内总SOD活力与对照组相比极显著降低(P<0.01),即随着BCE质量浓度的增加,HKCs胞内总SOD活力不断降低。尤其当BCE质量浓度为12 mg/mL时,胞内总SOD活力与对照组相比降低了约45%。
SOD可防止超氧化物在细胞内积累进而保护一些蛋白质。细胞在新陈代谢过程中,胞内SOD的缺乏会导致ROS在细胞内大量积累,进而会损伤细胞内一些大分子物质(如蛋白质、脂质和DNA)及细胞膜[34-35]。因此,随着BCE质量浓度的增加,引起HKCs胞内ROS水平持续升高,胞内高水平的ROS可能对胞内蛋白质和细胞膜造成损伤,进而导致胞内SOD活力持续降低,最终造成细胞损伤。
2.6 BCE对上清液中LDH活力的影响
LDH是一种胞内酶,在糖酵解过程中可将丙酮酸转化为乳酸产生ATP,为细胞代谢提供能量。培养上清液中LDH活力增高意味着细胞膜受损或功能紊乱。因此,LDH可作为一个生物化学标记反应疾病的严重程度的指标[36]。本实验通过不同质量浓度的BCE处理,检测HKCs培养上清液中的LDH活力,即分泌型LDH活力,进而对BCE引起的HKCs细胞膜的损伤进行评估,作为判断细胞受损程度的指标。
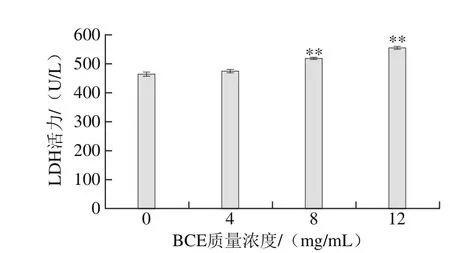
图5 BCE对上清液中LDH水平的影响Fig. 5 Effect of BCE on LDH levels in culture supernatants of HKCs
由图5可知,随着BCE质量浓度的增加,上清液中LDH活力也随之增加。4 mg/mL BCE处理组上清液中LDH活力与对照组相比无显著差异(P>0.05)。但当BCE质量浓度为8、12 mg/mL时,上清液中LDH活力与对照组相比均极显著升高(P<0.01),且12 mg/mL BCE处理组上清液中LDH活力达到最大值。
细胞膜解体后将LDH释放到细胞外,因此LDH可以作为组织损伤的非特异性标志物[37]。本实验中,随着BCE质量浓度的增加,LDH活力不断上升,意味着细胞受损程度加剧。在BCE质量浓度达8、12 mg/mL时,HKCs细胞膜可能受损,导致细胞膜通透性增加,从而使上清液中LDH活力显著增加。因此,BCE可能通过损伤细胞膜,增加细胞膜通透性,从而改变细胞正常生理功能,引起细胞受损。
3 结 论
本研究通过不同质量浓度的BCE处理HKCs发现,BCE对HKCs活力具有显著抑制作用。随着BCE处理质量浓度的增大,HKCs胞内ROS水平不断升高,进而引起细胞正常生理功能紊乱,导致胞内总SOD活力不断降低。BCE可诱发HKCs胞内脂质发生过氧化反应,使胞内MDA含量升高,造成细胞膜受损、通透性增加,导致培养上清液中LDH水平持续升高,使细胞受损。因此,对AGEs引发抗氧化损伤的具体机制将进一步深入探究。
[1] POULSEN M W, HEDEGAARD R V, ANDERSEN J M, et al.Advanced glycation endproducts in food and their effects on health[J].Food and Chemical Toxicology, 2013, 60(10): 10-37. DOI:10.1016/j.fct.2013.06.052.
[2] SHEMIRANI F, YAZDANPARAST R. The interplay between hyperglycemia-induced oxidative stress markers and the level of soluble receptor for advanced glycation end products (sRAGE) in K562 cells[J]. Molecular and Cellular Endocrinology, 2014, 393(1/2):179-186. DOI:10.1016/j.mce.2014.05.019.
[3] RUHS S, NASS N, SOMOZA V, et al. Maillard reaction products enriched food extract reduce the expression of myofibroblast phenotype markers[J]. Molecular Nutrition and Food Research, 2007,51(4): 488-495. DOI:10.1002/mnfr.200600155.
[4] RECKAUSKIENEA I, PUKALSKASA A, VENSKUTONISA P R, et al. Effects of beetroot (Beta vulgaris) preparations on the Maillard reaction products in milk and meat-protein model systems[J].Food Research International, 2015, 70: 31-39. DOI:10.1016/j.foodres.2015.01.026.
[5] NISHIKAWA T, ARAKI E. Involvement of advanced glycation end products in “hyperglycemic memory”[J]. Journal of Diabetes Investigation, 2016, 7(3): 297-299. DOI:10.1111/jdi.12405.
[6] HWANG K R, MURRELL G A, MILLAR N L, et al. Advanced glycation end products in idiopathic frozen shoulders[J]. Journal of Shoulder and Elbow Surgeons, 2016, 25(6): 981-988. DOI:10.1016/j.jse.2015.10.015.
[7] ZHOU F B, SUN W Z, ZHAO M M. Controlled formation of emulsion gels stabilized by salted myof i brillar protein under malondialdehyde(MDA)-induced oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2015, 63(14): 3766-3777. DOI:10.1021/jf505916f.
[8] PURDOM-DICKINSON S E, SHEVELEVA E V, SUN H P, et al.Translational control of Nrf2 protein in activation of antioxidant response by oxidants[J]. Molecular Pharmacology, 2007, 72(4): 1074-1081. DOI:10.1124/mol.107.035360.
[9] KOBAYASHI M, YAMAMOTO M. Molecular mechanisms activating the Nrf2-Keap1 pathway of antioxidant gene regulation[J].Antioxidants and Redox Signalling. 2005, 7(3/4): 385-394.DOI:10.1089/ars.2005.7.385.
[10] LI W, KONG A N. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Molecular Carcinogenesis, 2009, 48(2):91-104. DOI:10.1002/mc.20465.
[11] WEI Y, CHEN L, CHEN J, et al. Rapid glycation with D-ribose induces globular amyloid-like aggregations of BSA with high cytotoxicity to SH-SY5Y cells[J]. BMC Cell Biology, 2009, 10(1):1-15. DOI:10.1186/1471-2121-10-10.
[12] BROWNLEE M. Advanced protein glycosylation in diabetes and aging[J]. Annual Review of Medicine, 1995, 46(1): 223-234.DOI:10.1146/annurev.med.46.1.223.
[13] FISHBANE S, HAZZAN A D, HALINSKI C, et al. Challenges and opportunities in late-stage chronic kidney disease[J]. Clinical Kidney Journal, 2015, 8(1): 54-60. DOI:10.1093/ckj/sfu128.
[14] ECKARDT K U, CORESH J, DEVUYST O, et al. Evolving importance of kidney disease: from subspecialty to global health burden[J]. The Lancet, 2013, 382: 158-169. DOI:10.1016/ S0140-6736(13)60439-0.
[15] BREIT M, WEINBERGER K M. Metabolic biomarkers for chronic kidney disease[J]. Archives of Biochemistry and Biophysics, 2016,589: 62-80. DOI:10.1016/j.abb.2015.07.018.
[16] LÓPEZ-HEMNANDEZ F J, LÓPEZ-NOVOA J M. Role of TGF-β in chronic kidney disease: an integration of tubular, glomerular and vascular effects[J]. Cell and Tissue Research, 2012, 347(1): 141-154.DOI:10.1007/s00441-011-1275-6.
[17] LINDENMEIER M, FAEST V, HOFMANN T. Structural and functional characterization of pronyl-lysine, a novel protein modif i cation in bread crust melanoidins showing in vitro antioxidative and phase Ⅰ/Ⅱ enzyme modulating activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(24): 6997-7006. DOI:10.1021/jf020618n.
[18] MORALES F J, VAN BOEKEL M A J S. A study on advanced Maillard reaction in heated casein/sugar solutions: colour formation[J].International Dairy Journal, 1998, 8(10/11): 907-915. DOI:10.1016/S0958-6946(99)00014-X.
[19] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1/2): 55-63. DOI:10.1016/0022-1759(83)90303-4.
[20] KONRAD A S, KAMILA R T, MARCIN L L, et al.Tetrabromobisphenol A (TBBPA)-stimulated reactive oxygen species(ROS) production in cell-free model using the 2′,7′-dichlorodihydr ofluorescein diacetate (H2DCFDA) assay-limitations of method[J].Environmental Science & Pollution Research, 2016, 23(12): 12246-12252. DOI:10.1007/s11356-016-6450-6.
[21] SINGH R, BARDEN A, MORI T, et al. Advanced glycation end-products: a review[J]. Diabetologia, 2001, 44(2): 129-146.DOI:10.1007/s001250051591.
[22] BASTOS D M, MONARO E, SIGUEMOTO E, et al. Maillard reaction products in processed food: pros and cons[M]// VALDEZ B.Food industrial processes-methods and equipment. Vienna: In Tech,2012, 18(5): 281-300. DOI:10.5772/31925.
[23] TAKEUCHI M, MAKITA Z. Alternative routes for the formation of immunochemically distinct advanced glycation end-products in vivo[J]. Current Molecular Medicine, 2001, 1(3): 305-315.DOI:10.2174/1566524013363735.
[24] DELGADOANDRADE C, RUFIÁNHENARES J A, MORALES F J.Study on fluorescence of Maillard reaction compounds in breakfast cereals[J]. Molecular Nutrition & Food Research, 2006, 50(9): 799-804. DOI:10.1002/mnfr.200500249.
[25] OTTA C, JACOBSB K, HAUCKEC E, et al. Role of advanced glycation end products in cellular signaling[J]. Redox Biology, 2014, 2:411-429. DOI:10.1016/j.redox.2013.12.016.
[26] TSUKAGOSHI H, BUSCH W, BENFEY P N. Transcriptional regulation of ROS controls transition from proliferation to differentiation in the root[J]. Cell, 2010, 143(4): 606-616.DOI:10.1016/j.cell.2010.10.020.
[27] MOHD S K, SHAMS T, MAYYAR R, et al. Oxidative stress mediated cytotoxicity of glycated albumin: comparative analysis of glycation by glucose metabolites[J]. Journal of Fluorescence, 2015, 25(6): 1721-1726. DOI:10.1007/s10895-015-1658-2.
[28] ESCOBAR C, BYER K J, KHASKHELI H, et al. Apatite induced renal epithelial injury: insight into the pathogenesis of kidney stones[J]. Journal of Urology, 2008, 180(1): 379-387. DOI:10.1016/j.juro.2008.02.041.
[29] XU W, MARTINEZ M A, DAI M H, et al. Permethrin-induced oxidative stress and toxicity and metabolism. a review[J].Environmental Research, 2016, 149: 86-104. DOI:10.1016/j.envres.2016.05.003.
[30] VEENA C K, JOSEPHINE A, PREETHA S P, et al. Renal peroxidative changes mediated by oxalate: the protective role of fucoidan[J]. Life Sciences, 2006, 79(19): 1789-1795. DOI:10.1016/j.lfs.2006.06.014.
[31] KUMAR V, FARELL G, DEGANELLO S, et al. Annexin Ⅱ is present on renal epithelial cells and binds calcium oxalate monohydrate crystals[J]. Journal of the American Society of Nephrology, 2003,14(2): 289-297. DOI:10.1097/01.ASN.0000046030.24938.0A.
[32] BIGELOW M W, WIESSNER J H, KLEINMAN J G, et al. Calcium oxalate crystal attachment to cultured kidney epithelial cell lines[J].The Journal of Urology, 1998, 160(4): 1528-1532. DOI:10.1016/S0022-5347(01)62607-7.
[33] RABINOVICH Y I, ESAYANUR M, DAOSUKHO S, et al. Adhesion force between calcium oxalate monohydrate crystal and kidney epithelial cells and possible relevance for kidney stone formation[J].Journal of Colloid and Interface Science, 2006, 300(1): 131-140.DOI:10.1016/j.jcis.2006.03.070.
[34] BICKERS D R. Studies on the role of reactive oxygen species in mediating lipid peroxide formation in epidermal microsomes of rat skin[J]. Journal of Investigative Dermatology, 1983, 81(4): 369-375.DOI:10.1111/1523-1747.ep12519980.
[35] RILEY P A. Oxygen free radicals in tissue damage[J]. Journal of Chemical Neuroanatomy, 1995, 8(2): 148-149. DOI:10.1016/0891-0618(95)90019-5.
[36] O’BRIED J, SHILAD A, DOUGLAS M, et al. Evaluating the definition of HELLP syndrome: assessing LDH isoform activity[J].American Journal of Obstetrics and Gynecology, 2005, 193(suppl 6):76. DOI:10.1016/j.ajog.2005.10.274.
[37] PHILIPP A B, NAGEL D, STIEBER P, et al. Circulating cell-free methylated DNA and lactate dehydrogenase release in colorectal cancer[J].BMC Cancer, 2014, 14(1): 1-9. DOI:10.1186/1471-2407-14-245.
Water-Soluble Advanced Glycation End Products from Bread Crust Cause Oxidative Damage to Human Kidney Tubular Epithelial Cells
JIA Benpan, YUAN Xiaojin, FAN Zhiyi, HU Jing, LI Juxiu*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Advanced glycation end products (AGEs) are a class of compounds that are formed during thermal processing and storage of foods, which are signif i cantly associated with various chronic diseases, such as cardiovascular diseases, diabetes,and kidney diseases. In the present study, bread crust extract (BCE), rich in AGEs, was obtained from bread crust through water extraction, and we investigated if BCE could cause intracellular oxidative stress and cell damage in human kidney tubular epithelial cells (HKCs). HKCs were treated with different BCE concentrations for determining the appropriate concentration of BCE by 3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide assay for use in subsequent experiments. The effect of BCE on intracellular oxidative stress balance and the degree of cell damage was evaluated by detecting the levels of intracellular reactive oxygen species (ROS), total superoxide dismutase (SOD) and malondialdehyde(MDA) and lactic dehydrogenase (LDH) in supernatants. The results indicated that the level of ROS in HKCs was increased along with increasing BCE concentration after being cultured with different concentrations of BCE for 24 h, and reached a maximum value at 8 and 12 mg/mL. Intracellular MDA contents increased signif i cantly at 4 and 8 mg/mL of BCE (P < 0.01),but markedly declined at 12 mg/mL (P < 0.05). On the contrary, intracellular SOD activity was reduced with increasing concentration of BCE, and signif i cantly decreased at BCE concentrations of 8 and 12 mg/mL. The level of secreted LDH was increased with increasing BCE concentrations, and the increase was highly signif i cant at 8 and 12 mg/mL (P < 0.01).Therefore, BCE can cause serious damage to HKCs via elevating intracellular ROS levels, inhibiting total SOD activity and thereby promoting lipid peroxidation reaction, altering the cell membrane permeability, and consequently improving extracellular LDH activity.
human kidney tubular epithelial cells; bread crust extract; oxidative damage; lipid peroxidation
10.7506/spkx1002-6630-201801021
R151.3
A
1002-6630(2018)01-0136-06
贾本盼, 袁晓金, 范智义, 等. 面包皮中水溶性晚期糖基化终产物对人肾小管上皮细胞的氧化损伤[J]. 食品科学, 2018,39(1): 136-141.
10.7506/spkx1002-6630-201801021. http://www.spkx.net.cn
JIA Benpan, YUAN Xiaojin, FAN Zhiyi, et al. Water-soluble advanced glycation end products from bread crust cause oxidative damage to human kidney tubular epithelial cells[J]. Food Science, 2018, 39(1): 136-141. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801021. http://www.spkx.net.cn
2016-09-27
国家自然科学基金面上项目(31471579)
贾本盼(1990—),男,硕士研究生,研究方向为食品化学与营养。E-mail:panjiaben@sina.com
*通信作者简介:李巨秀(1972—),女,副教授,博士,研究方向为食品化学与营养。E-mail:juxiuli@msn.com
