甜菜果胶乳化活性及稳定性
2018-01-08张凯华刘世永岳晓强吉爱国殷丽君
陈 浩,张凯华,刘世永,岳晓强,甘 晶,邱 爽,吉爱国,殷丽君,5,*
(1.山东大学(威海)海洋学院,山东 威海 264209;2.中国农业大学 北京食品营养与人类健康高精尖创新中心,北京 100083;3.威海海洋职业学院食品工程系,山东 威海 264300;4.嘉吉亚太食品系统(北京)有限公司,北京 102200;5.河南工业大学粮油食品学院,河南 郑州 450001)
甜菜果胶乳化活性及稳定性
陈 浩1,2,张凯华2,刘世永3,岳晓强4,甘 晶2,邱 爽2,吉爱国1,殷丽君2,5,*
(1.山东大学(威海)海洋学院,山东 威海 264209;2.中国农业大学 北京食品营养与人类健康高精尖创新中心,北京 100083;3.威海海洋职业学院食品工程系,山东 威海 264300;4.嘉吉亚太食品系统(北京)有限公司,北京 102200;5.河南工业大学粮油食品学院,河南 郑州 450001)
甜菜果胶是一种从甜菜粕中提取的酸性阴离子多糖,主链由鼠李糖和半乳糖醛酸组成,侧链数量丰富,主要由鼠李糖、阿拉伯糖、半乳糖、果糖等一些中性糖组成。其中中性糖末端与蛋白质共价连接,赋予了甜菜果胶良好的乳化性质。本研究主要探究了甜菜果胶的乳化特性并与柑橘果胶进行对比。考察了甜菜粕产地、果胶质量浓度、pH值、温度、贮藏时间等对乳液特性(粒径分布、平均粒径、Zeta-电位和浊度变化)的影响。研究结果表明,产地不同对甜菜果胶结构组成影响较大,以甜菜果胶制备的乳液粒径显著小于柑橘果胶乳液,且乳化活性更高。当甜菜果胶质量浓度为10~25 mg/mL时,乳液在4 周的贮存期内保持良好的稳定性,而柑橘果胶乳液粒径显著增加。pH 2~6的范围内,果胶粒径基本保持不变。25~85℃升温过程中,柑橘果胶乳液粒径大幅增加。说明甜菜果胶具有良好的乳化活性和稳定性。本研究为甜菜果胶的实际应用提供了理论指导。
甜菜果胶;产地;柑橘果胶;乳化活性;乳化稳定性
乳化技术是食品生产的一项关键技术,该技术借助乳化剂降低界面张力来实现两种不相溶液体(通常是油和水)的均一混合,形成水包油型(oil in water,O/W)或油包水型(water in oil,W/O)乳液,软饮料、蛋黄酱、冰淇淋和人造奶油等均是典型的乳化体系。食品工业中,乳化剂通常分为2 类:一类是小分子表面活化剂,主要包括聚山梨醇酯、甘油酯、蔗糖酯等;另外一类是大分子物质,常见的有各种蛋白质、多糖等[1]。
乳化剂种类不同,其乳化能力和制备的乳液的性质也存在较大差异。蛋白质和卵磷脂具有较好的乳化能力,所制备的乳液虽然粒径较小,但对酸碱变化、盐的添加、加热和冷冻处理等非常敏感[2]。果胶作为一酸性阴离子多糖,拥有良好的乳化能力。Siew等[3]发现甜菜果胶中的蛋白质赋予了其良好的乳化能力,柑橘果胶和苹果果胶分子质量低于80 kDa时,能形成稳定的乳液[4-5]。虽然大多数植物组织中都含有果胶成分,但目前商业果胶大部分仍从柑橘和苹果果皮中获得[6]。作为世界上种植规模和产量最大的2 种水果,苹果和柑橘果胶具有原料充足、果胶含量较高且果胶质量相对较好等特点。而在前期实验中又发现,柑橘果胶的乳化性质要优于苹果果胶[6];因此本研究中选择了柑橘果胶与甜菜果胶进行各方面理化性质的比较。
甜菜粕是甜菜榨糖的主要副产物,与甜菜糖的产出比约为9∶1。仅2010—2011年的榨季,我国的甜菜湿粕产量就高达650万 t[6]。甜菜粕中富含纤维素(约30%)、果胶(约20%)、蛋白质(约10%)、糖(约4%)以及甜菜碱等物质[7-9]。目前甜菜粕主要被用作动物饲料,开发利用率极低,且在加工利用过程中,存在着产业链短、利用率低、资源浪费、环境污染等问题[10-12]。因此,拓宽甜菜粕的应用范围,提高其附加值,实现甜菜粕的综合利用和多层次开发,不仅能提高其商业价值,更是减少环境污染的有效途径。
甜菜果胶在甜菜粕中含量丰富,具有良好的乳化特性和凝胶特性,是食品中常见的增稠稳定剂,并且市面上已经出现了许多相关专业产品,如可食用生物降解膜、药物及营养物质的包埋和运输载体等[10-11]。目前为止,发现的果胶的结构有以下4 种:同聚半乳糖醛酸(homogalacturonan,HG)、鼠李糖半乳糖醛酸Ⅰ(rhamnogalacturonan Ⅰ,RG-Ⅰ)、鼠李半乳糖醛酸Ⅱ(rhamnogalacturonan Ⅱ,RG-Ⅱ)以及木聚糖-半乳糖醛酸(xylogalacturonan,XGA)[13-14]。甜菜果胶中存在大量的RG-Ⅰ型结构,侧链数量丰富,主要由半乳糖醛酸和一些中性糖组成。中性糖末端与蛋白质共价连接,赋予了甜菜果胶良好的乳化性质。而侧链中部分阿拉伯呋喃糖的C-2和吡喃半乳糖的C-6位酯化后共价连接的阿魏酸基团,则是对甜菜果胶进行改性处理的重要位点[15]。甜菜果胶分子质量较小,乙酰基含量较高,很难形成凝胶,但蛋白质、阿魏酸的存在使其具有一定的疏水特性,从而呈现出良好的乳化性质。
中国是世界上主要的甜菜产区之一,内蒙古、新疆、东北是主要的种植地区,约占全国甜菜总产量的90%。本实验主要从这3 个甜菜主产区中选择了5 个县市的甜菜粕,进行果胶提取研究。分析了不同产地甜菜果胶的结构组成及理化性质差异。优选蛋白质含量较高产地的甜菜粕,进行提取方法研究。本研究对甜菜果胶制备的O/W乳液的乳化特性进行了分析,并以柑橘果胶作为对照,考察了果胶质量浓度、pH值、温度、盐对乳液特性(粒径分布、平均粒径、Zeta-电位和浊度变化)的影响,为其应用开发提供理论依据。
1 材料与方法
1.1 原料与试剂
甜菜粕颗粒由博天糖业有限公司提供,分别取自绿源、赤峰、博城、九三、前旗5 个地区。5 个工厂获得甜菜干粕的方法均为热风120 ℃条件下烘干40 min。为去除甜菜粕颗粒表面灰尘及夹带的杂质、可溶性糖等,将甜菜粕颗粒放入清水中浸泡2 h使其充分溶胀,捞出后尽量挤干水分,再以流动的清水冲洗数遍至水颜色较为澄清。将沥干水分的甜菜粕放入55 ℃烘箱中烘至水分含量7%(干基)左右。用粉碎机粉碎,放入干燥器中备用。
P9135柑橘果胶、叠氮钠(分析纯) 美国Sigma-Aldrich公司;大豆油(食品级) 益海嘉里食品营销有限公司;其他试剂均为分析纯 北京化学试剂公司。
1.2 仪器与设备
T9型紫外-可见分光光度计 北京普析通用仪器有限责任公司;T25basic型高速均质机 德国IKA公司;NS1001L型高压均质机 意大利GEA NiroSoavi公司;LS230型激光衍射粒径仪 美国贝克曼库尔特公司。
1.3 方法
1.3.1 甜菜果胶的提取
取10 g甜菜粕粉末,按料液比为1∶30(m/V)加入去离子水,用1 mol/L盐酸溶液调节pH值至1.2。在恒温水浴锅(90 ℃)中浸提3 h后,冷却至室温。用250 目尼龙布过滤,滤液用6 mol/L NaOH溶液调pH值至3.5,6 000 r/min离心5 min得到上清液[7],将上清液转移至烧杯中,加入2 倍体积无水乙醇,静置5 h使果胶充分析出,用250 目尼龙布过滤得湿果胶[16],用30 mL乙醇清洗2 次以除去色素和游离的中性糖[17]。最后冷冻干燥,获得甜菜果胶。
1.3.2 甜菜果胶O/W乳液的制备
称取不同质量的甜菜果胶和柑橘果胶,加入含0.2 mg/mL叠氮钠(防止微生物生长引起乳液腐败)的去离子水,溶解配制成为5、10、15、20、25 mg/mL的果胶溶液。将配制好的果胶溶液和大豆油以9∶1(m/m)的比例混合,通过高剪切乳化机在转速16 000 r/min下均质3 min制备初乳液,随后将初乳液通过50 MPa压力的高压均质机进行高压均质,获得质量分数为10%的O/W乳液[6]。
1.3.3 果胶的基本成分分析
1.3.3.1 果胶中蛋白质含量测定
果胶中蛋白质含量的测定采用考马斯亮蓝法[18],应用蛋白质与考马斯亮蓝G-250通过范德华力结合后,变成蓝色,在595 nm波长处有最大吸光度。以牛血清白蛋白(bovine serum album,BSA)含量计。
1.3.3.2 果胶中阿魏酸含量的测定
果胶中阿魏酸含量的测定采用郦金龙等[19]的方法,略有改动。将果胶溶于蒸馏水中,配成0.5 mg/mL果胶溶液,测定其在325 nm波长处的紫外吸光度。配制一系列质量浓度的阿魏酸溶液,测定其在325 nm波长处的吸光度,绘制标准曲线,并计算得到果胶中阿魏酸的含量。
1.3.3.3 果胶中半乳糖醛酸质量分数的测定
商品果胶要求半乳糖醛酸的质量分数必须达到65%以上,因此果胶中半乳糖醛酸含量是判断果胶品质的重要标准。本研究采用咔唑硫酸法测定果胶中半乳糖醛酸质量分数[20]。称取0.15 g咔唑溶于100 mL精制乙醇中,得到1.5 mg/mL咔唑-乙醇溶液。取25 mL玻璃试管,放入冰水浴中预冷30 min后,缓慢加入6 mL浓硫酸(防止挂壁),随后加入1 mL果胶溶液(0.5 mg/mL),充分混匀冷却后,放入沸水浴中加热10 min。取出后用流动的水冲洗使其快速降至室温,随后加入0.5 mL咔唑-乙醇溶液,充分混匀后,室温放置30 min后,测定其在530 nm波长处的吸光度。以半乳糖醛酸为标准品,绘制标准曲线,并计算得到各果胶中半乳糖醛酸质量分数。
1.3.4 甜菜果胶理化性质测定
1.3.4.1 果胶酯化度的测定
果胶酯化度采用滴定法测定[7,21-22]。用蒸馏水配制20 mL 1 mg/mL果胶溶液,磁力搅拌至充分溶解,向果胶溶液中加入2~3 滴酚酞指示剂,并用0.05 mol/L NaOH溶液滴定至变色,所用NaOH溶液体积记为V1。随后,向该溶液中缓慢加入20 mL 0.1 mol/L NaOH溶液,于磁力搅拌器上搅拌30 min,得到去甲酯化果胶。最后,向该溶液加入20 mL 0.1 mol/L盐酸溶液,过量盐酸用0.1 mol/L NaOH溶液滴定至酚酞指示剂变色,所消耗NaOH溶液体积记为V2。按公式(1)计算酯化度。

1.3.4.2 果胶亲水亲油平衡值的测定
采用乳化法测定甜菜果胶的亲水亲油平衡(hydrophile-lipophile balance,HLB)值。配制10 mg/mL果胶溶液作为乳化剂。用松节油(HLB值为16)和棉籽油(HLB值为6)配制一系列所需不同HLB值的油相,HLB值按式(2)计算。每15 份油相中加入5 份果胶溶液,然后加入80 份水,在均质机中以3 000 r/min剪切均质30 min,比较一系列样品的稳定性,其中稳定性最好的乳液中油相所需HLB值就是表面活性剂的HLB值[22]。

式中:m1、m2分别为松节油、棉籽油质量/g;HLB1、HLB2分别为松节油、棉籽油所需HLB值。
1.3.4.3 果胶溶液Zeta-电位的测定
称取0.01 g果胶样品,加入到10 mL蒸馏水中配制成1 mg/mL果胶溶液。测定前用蒸馏水稀释500 倍,避免浓度过大产生光散射影响测定结果。将稀释液加入到Zeta-电位测定仪样品池中进行测定[23]。
1.3.5 环境条件对果胶O/W乳液乳化性质的影响
1.3.5.1 pH值对果胶O/W乳液乳化性质的影响
取5 mL 10 mg/mL果胶乳液,用0.1 mol/L盐酸溶液和0.1 mol/L NaOH溶液调节pH值分别至3、4、5、6。室温放置不同时间后,测定乳液乳化特性[24]。
1.3.5.2 温度对果胶O/W乳液乳化性质的影响
取5 mL果胶质量浓度为10 mg/mL的乳液,分别置于25、45、65、85 ℃恒温水浴锅中加热20 min。然后将其冷却至室温,放置不同时间后,测定其乳化特性[25]。
1.3.6 果胶O/W乳液乳化性质的测定
1.3.6.1 粒径分布及平均粒径的测定
乳液粒径采用激光粒径分析仪进行测定。选择蒸馏水作为测量背景,Small Volume Module模式,将样品加入样品池直到显示体积分数为8%~12%之间,即可开始进行测量。实验结果通过LS 3.29软件进行记录和数据分析。果胶乳液的平均粒径用体积平均粒径(d4,3)表示,按式(3)计算[5]。

1.3.6.2 乳化活性和乳化稳定性的测定
乳化活性用浊度来表示。乳化稳定性由浊度变化前后的比值来反映。将乳液用1 mg/mL十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)溶液稀释400 倍,以SDS溶液为空白对照,用紫外-可见分光光度测定其在500 nm波长处的吸光度,浊度按式(4)计算。

式中:T为果胶O/W乳液的浊度/m-1;A为稀释乳液所测的吸光度,N为稀释倍数(400),I为光程差,即比色皿厚度(0.01 m)。
1.3.6.3 Zeta-电位的测定
测定5 mg/mL果胶溶液制得乳液Zeta-电位,具体方法同1.3.4.3节。
1.4 数据处理
所有图都用Origin 8.6软件绘制,通过Excel 2010软件进行数据处理。除特殊说明外,所有样品至少做2 组平行,测定2 次以上。所有指标均为3 组以上数据平均值,并采用SPSS 19.0软件中Duncan法分析组间差异显著性。
2 结果与分析
2.1 不同产地甜菜果胶的理化性质
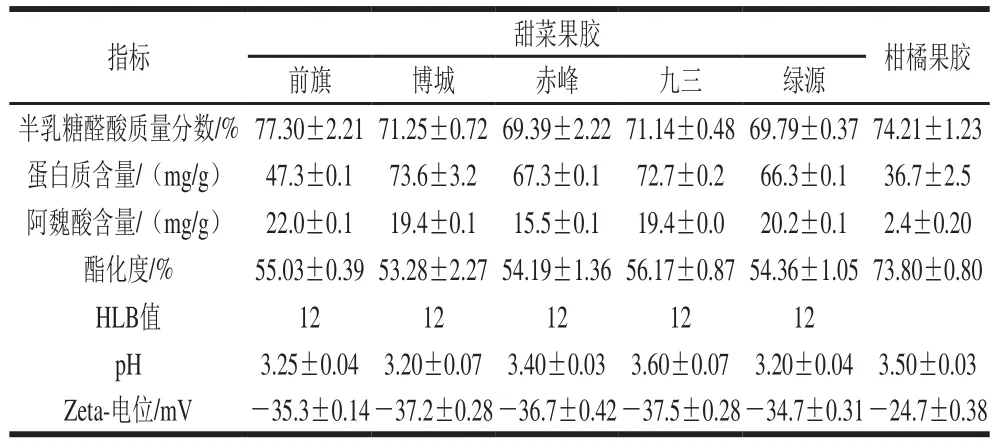
表1 不同产地甜菜果胶的理化性质Table 1 Physicochemical properties of sugar beet pectin from different geographical origins
对5 个产地甜菜粕提取的甜菜果胶做进一步的成分分析,如表1所示。所得到的甜菜果胶的半乳糖醛酸的质量分数均在65%以上,达到商品果胶的要求。甜菜果胶中蛋白质含量丰富,除前旗地区外,其余均大于65 mg/g,远高于柑橘果胶中蛋白质含量(36.7 mg/g)。根据文献报道,甜菜果胶中的蛋白质大多共价连接于鼠李糖的末端,是甜菜果胶具有良好乳化性质的重要原因[3,15];而阿魏酸主要连接于侧链上的阿拉伯糖和半乳糖的末端,是对甜菜果胶进行改性处理的重要位点。甜菜果胶中的阿魏酸含量约在15.5~22.0 mg/g范围内,高于柑橘果胶。
酯化度指果胶分子中半乳糖醛酸羧基被酯化的程度,甲氧基、乙酰基和酰胺基均可与半乳糖醛酸发生酯化反应,分别称甲酯化、乙酰化和酰胺化,理论上酯化度是这三者的和,由于甲酯化占比最大,故一般以果胶甲酯化程度来表示酯化度,不同酯化度的果胶,应用特性也有所不同,尤其是凝胶形成条件的差异。因此,分析果胶的酯化度信息,对于其应用的开展十分必要。甜菜果胶的酯化度均大于50%,属高甲酯果胶,且酯化度均在53%~57%范围内,属于甲酯化程度相对较低的高甲酯果胶。甜菜果胶的Zeta-电位在-35 mV左右,pH值在3左右,是一种酸性阴离子多糖。甜菜果胶的HLB值为12,属于亲水性乳化剂。甜菜果胶质量浓度为5 mg/mL时,磁力搅拌2 h即可溶于水中;当质量浓度升高到25 mg/mL时,需搅拌过夜;当质量浓度为30 mg/mL时,甜菜果胶溶液流动性较差,呈现半固体状。因此,甜菜果胶在30 mg/mL以下使用较好。由于博城甜菜粕提取果胶蛋白质含量最高(73.6 mg/g),因此后续实验选取该果胶做更全面的乳化性质评价。
2.2 果胶质量浓度对乳液特性的影响
2.2.1 果胶质量浓度对乳液粒径分布的影响
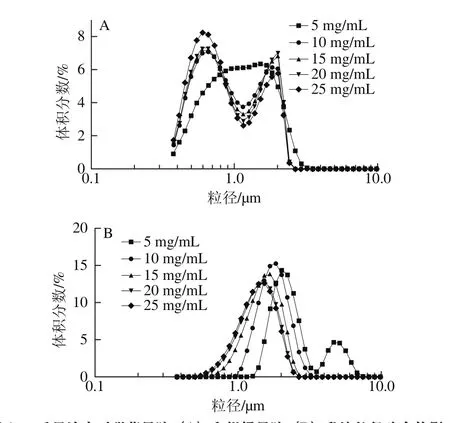
图1 质量浓度对甜菜果胶(A)和柑橘果胶(B)乳液粒径分布的影响Fig. 1 Droplet size distribution of O/W emulsions with different concentrations of SBP (A) and CP (B)
果胶质量浓度不仅影响乳化界面上果胶的吸附量,也能影响乳液黏度,从而影响乳液稳定性。因此,寻找适宜的果胶质量浓度对于展现其优良乳化特性至关重要。由图1A可知,5 mg/mL甜菜果胶溶液制备的乳液呈现钟罩型曲线,随着质量浓度增加,粒径分布向更小粒径范围移动,但出现了双峰,这可能是由于提取过程存在一些杂质(如一些小分子寡糖和蛋白质等),在稳定水-油界面时呈现出不同的界面张力,最终表现为乳液粒径的分布不均。而商品柑橘果胶经过系列的纯化过程,杂质较小且分子质量更为均一,因此乳液粒径分布相对更为均匀。此外,当甜菜果胶质量浓度达到10 mg/mL时,乳液粒径分布几乎不发生变化。这说明甜菜果胶质量浓度为10 mg/mL时,即可达到良好的乳化性能。从图1B中可以看出,随着柑橘果胶质量浓度的增加,其乳液粒径持续减小且显著大于甜菜果胶乳液粒径。
2.2.2 果胶质量浓度对乳液粒径变化的影响
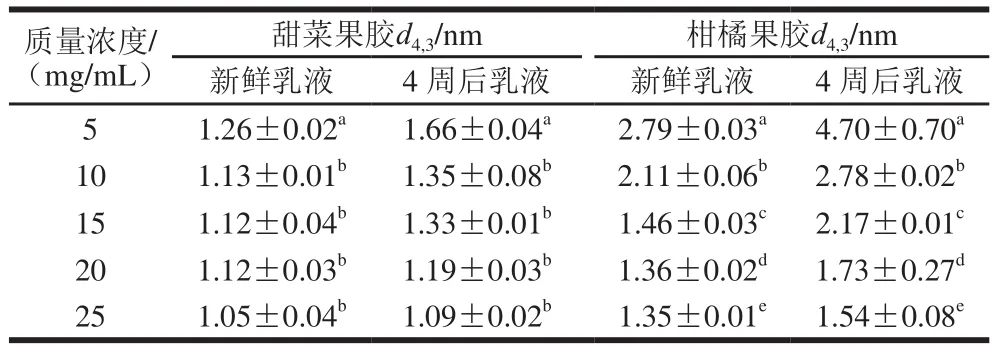
表2 不同质量浓度果胶乳液粒径变化Table 2 Droplet size changes of O/W emulsions with different concentrations of SBP and CP after storage
乳液粒径用d4,3表示,它与乳液的稳定性呈现出良好的相关性。不同质量浓度果胶溶液制得乳液,贮藏过程中的粒径变化如表2所示。可以看出,随质量浓度的增加,甜菜果胶制备的新鲜乳液平均粒径逐渐降低,与Nakauma[26]的研究结论相一致,且10、15 mg/mL和20 mg/mL甜菜果胶乳液的粒径之间不存在显著性差异(P>0.05)。柑橘果胶制备的新鲜乳液的粒径也随果胶质量浓度升高逐渐减小,且不同质量浓度间均存在显著差异(P<0.05)。甜菜果胶乳液的粒径小于柑橘果胶乳液,25 mg/mL柑橘果胶溶液制备的新鲜乳液粒径为(1.35±0.01)μm,而5 mg/mL甜菜果胶溶液制备的新鲜乳液粒径仅为(1.26±0.02)μm。可见,甜菜果胶的乳化能力优于柑橘果胶。室温放置4 周后,各乳液的粒径均有所增加,尤其是5 mg/mL的柑橘果胶乳液,由(2.79±0.03)μm增加到(4.70±0.70)μm。甜菜果胶粒径增加程度小于柑橘果胶。与阿拉伯胶相比,仅需5~10 mg/mL的甜菜果胶溶液即可制备出相应粒径大小的乳液,而其所需阿拉伯胶为100~150 mg/mL[26],因此甜菜果胶的应用将会很大程度降低企业的生产成本。
2.2.3 果胶质量浓度对乳液Zeta-电位的影响
Zeta-电位是指乳液中连续相内部与分散液滴表面的电位差,通常用于表征乳液体系的稳定性[27-28]。不同质量浓度乳液的Zeta-电位如图2所示,乳液Zeta-电位均为负值,不同质量浓度甜菜果胶溶液制备的乳液,其Zeta-电位均在-40 mV左右。而5 mg/mL柑橘果胶溶液Zeta-电位仅为-24.6 mV,其他质量浓度果胶的Zeta-电位均低于-30 mV。乳液Zeta-电位绝对值高于30 mV时,电荷间的静电排斥力才能维持乳液的稳定。因此,5 mg/mL柑橘果胶乳液4 周后粒径增加最为显著,乳化稳定性最差。
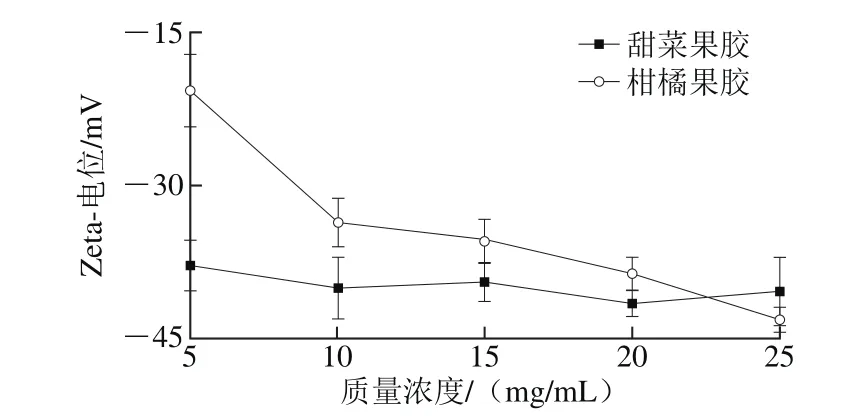
图2 果胶质量浓度对乳液Zeta-电位的影响Fig. 2 Effect of concentrations of SBP and CP on emulsion zeta-potential
2.2.4 果胶质量浓度对乳液乳化活性和乳化稳定性的影响
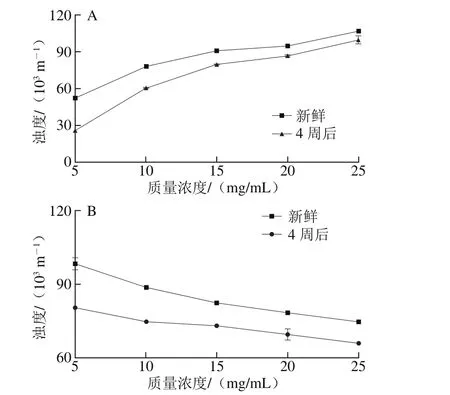
图3 质量浓度对甜菜果胶(A)、柑橘果胶(B)乳化活性和乳化稳定性的影响Fig. 3 Effect of SBP (A) and CP (B) concentrations on emulsion activity and emulsion stability
浊度的变化是因样品的吸收或颗粒的散射而造成的透射光的衰减,对于乳液颗粒尺寸的变化更为敏感,乳液浊度的变化可以反映乳液颗粒在贮藏中的稳定性[29]。质量浓度对果胶乳液浊度的影响如图3所示。随质量浓度增加,甜菜果胶乳液浊度逐渐增大,在质量浓度为25 mg/mL时达到最大值,4 周后,浊度均有所下降,高质量浓度果胶溶液由于其较高黏度和更厚的界面膜更具乳化稳定性。柑橘果胶乳液的浊度变化较为不明显,与Zeta-电位的变化趋势相近。
2.3 pH值对乳液特性的影响
2.3.1 pH值对乳液粒径的影响
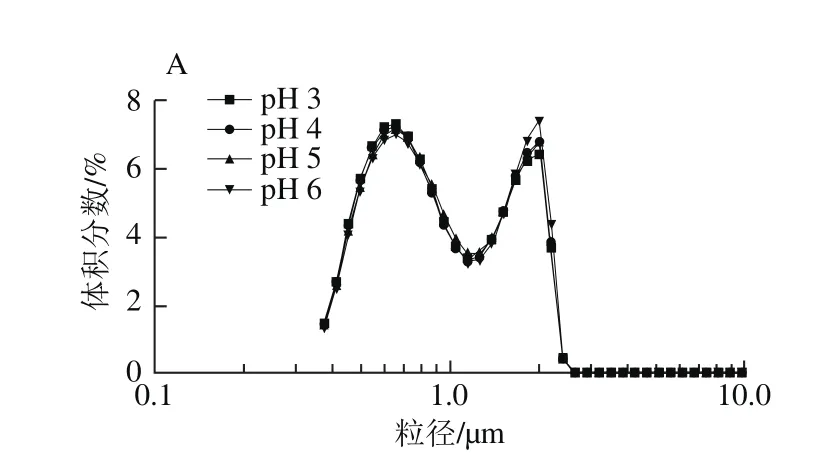

图4 pH值对甜菜果胶(A)、柑橘果胶(B)乳液粒径分布的影响Fig. 4 Effect of pH on droplet size distribution of SBP (A) and CP (B)O/W emulsions
从图4可以看出,pH值的变化对乳液的粒径分布影响较小。在pH 3~6的变化范围内,乳液粒径分布几乎不发生变化。

图5 pH值对果胶乳液粒径的影响Fig. 5 Effect of pH on droplet size changes of SBP and CP O/W emulsions
pH值对果胶乳液粒径的影响如图5所示,pH值从3到6的变化对两种果胶乳液的粒径没有出现显著变化(P>0.05),同粒径分布结果相一致,甜菜果胶平均粒径均在1.1 μm左右,柑橘果胶粒径约为2.2 μm。果胶属于阴离子多糖,其pKa在4左右,pH值的变化并没有引起乳液粒径的明显变化,可能是由于果胶中半乳糖醛酸存在着甲酯化,C2和C3位置发生乙酰化,因此,酸根离子存在量较少,空间位阻和黏度特性在维持乳液稳定方面更占优势,静电斥力的改变对乳化颗粒变化影响较小。阿拉伯胶也有类似性质,pH值在3~6范围内变化时,其乳液粒径变化不明显[25]。
2.3.2 pH值对乳液浊度的影响
不同pH值下,贮藏4 周后两种果胶乳液浊度的变化如表3所示。新鲜乳液的浊度可以表征该乳液乳化活性的优劣,浊度越高说明其乳化活性越好,贮藏4 周后乳液浊度与原浊度的比值越大,乳液稳定性越好。
从表3中可以看出,pH 3~6范围内,浊度大小总体保持稳定,与粒径变化趋势相近,说明pH值对果胶的乳化性质影响相对较小。随着pH值增加,甜菜果胶新鲜乳液浊度先升高后降低,pH 4时浊度最高,故pH 4时甜菜果胶乳化活性最好;而柑橘乳液在pH 3时浊度最大,随pH值升高,浊度逐渐降低,可能与两种果胶不同的解离常数pKa有关。从表3也可以看出,贮藏4 周后,各乳液浊度均有一定程度的降低,pH值变化对乳液的稳定性也有一定影响,从浊度比可以看到,两种果胶乳液浊度比均在80%左右,具有良好的稳定性。甜菜果胶乳液在pH 4时,浊度比最大,浊度下降幅度最小,稳定性最高,pH 6时,稳定性最差,但均在80%以上,Nakauma等[26]在研究pH值对甜菜果胶乳液Zeta-电位时发现,pH值在2~6范围内时,Zeta-电位均小于-30 mV;而柑橘果胶乳液在pH值为3时稳定性最好。对于甜菜果胶和柑橘果胶,随pH值升高,浊度比减小,其乳化稳定性逐渐变差。
pH值对果胶乳液特性的影响,很大程度上受果胶酯化度和黏度的影响,果胶由于存在部分未酯化的半乳糖醛酸,使得其在水溶液中带一定量的负电荷。当水相pH值较低时,半乳糖醛酸电离受到影响,静电斥力弱,易相互聚集,造成粒径增大、乳化稳定性变差;随水相pH值升高,半乳糖醛酸电离增强,乳液静电斥力增加,乳滴不易聚集。柑橘果胶酯化度高于70%,甜菜果胶富含乙酰基,酯化度也超过50%,当pH 3~6范围内时,它们制备的乳液在对半乳糖醛酸的电离影响不大,静电斥力也未发生明显变化。总之,甜菜果胶与柑橘果胶在制备乳液后,均具有较强的pH值抵抗性,pH 3~5条件下乳化稳定性好,可以在酸性饮品中开展应用。
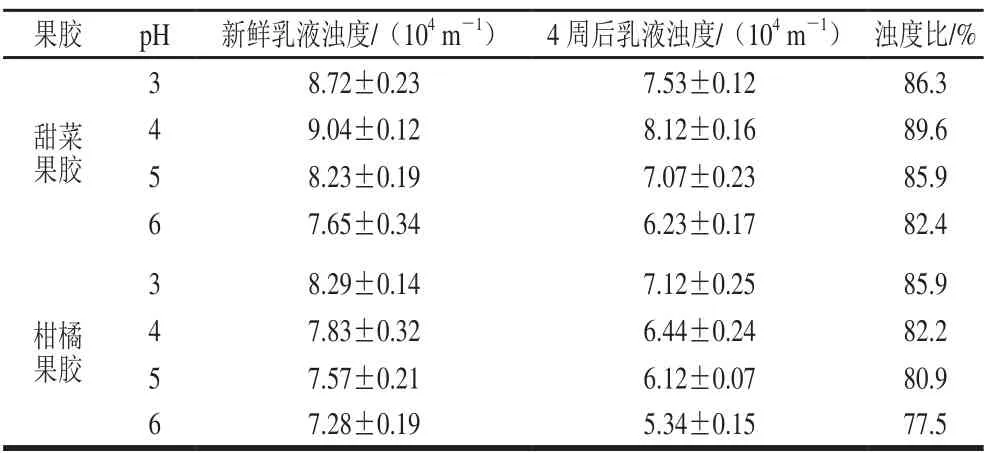
表3 pH值对果胶乳液浊度变化的影响Table 3 Effect of pH on turbidity changes of SBP and CP O/W emulsions
2.4 温度对果胶乳液特性的影响
2.4.1 温度对果胶乳液粒径分布的影响
高温加热处理是食品加工中必不可少的环节,但应避免其给食品的色泽、外观和质构等带来的不利影响。亲水胶体种类不同,结构各异,热稳定性也各有不同。因此明确果胶在制备成乳液后的热稳定性对于开展其应用十分必要[30]。
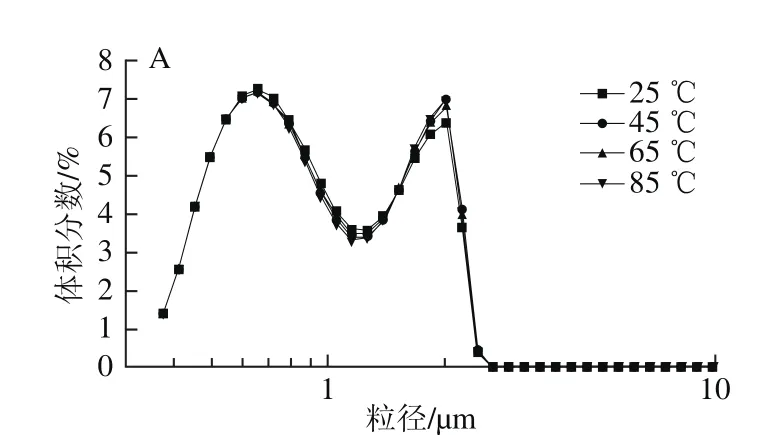

图6 加热温度对甜菜果胶(A)和柑橘果胶(B)乳液粒径分布的影响Fig. 6 Effect of temperature on droplet size distribution of SBP (A)and CP (B) O/W emulsions
从图6可以看出,两种果胶制备的乳状液表现出不同的热稳定性:甜菜果胶乳液有着较佳的热稳定性,65 ℃和85 ℃加热20 min,其粒径分布仍未发生明显变化,这一点与阿拉伯胶在不同温度处理下粒径分布不变的性质较为相似[31];而柑橘果胶乳液经不同温度加热处理后,粒径分布均有一定程度的变化,尤其是85 ℃处理过的乳液,其主要粒径分布峰迁移到10 μm左右。
2.4.2 温度对乳液浊度的影响

图7 不同处理温度对果胶乳液浊度的影响Fig. 7 Effect of temperature on turbidity of SBP and CP O/W emulsions
从图7可以看出,随温度升高,两种乳液的浊度均呈降低趋势,柑橘果胶乳液下降尤为明显,浊度从25 ℃时的78.70×103m-1下降到85 ℃时的35.62×103m-1,与粒径分布结果基本一致。可见甜菜果胶乳液相比于柑橘果胶乳液,其对热处理的抵抗能力更强。
2.4.3 温度对乳液粒径的影响
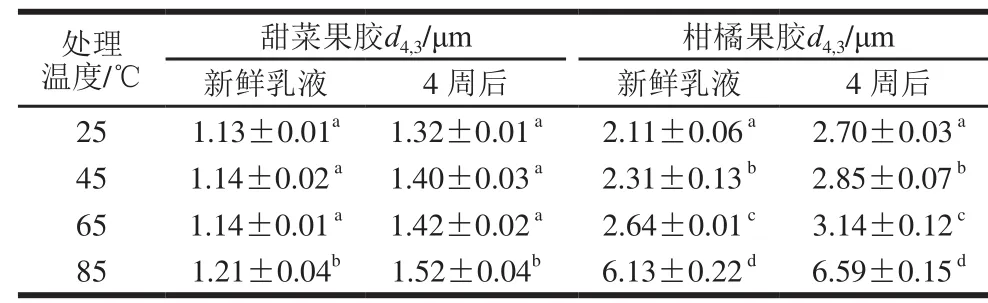
表4 不同温度处理后乳液粒径变化Table 4 Effect of temperature on droplet size changes of SBP and CP O/W emulsions
由表4可知,加热温度由25 ℃升至65 ℃,甜菜果胶新鲜乳液粒径变化不显著(P>0.05),85 ℃加热时,粒径显著增大(P<0.05)。柑橘果胶新鲜乳液的粒径随加热温度升高不断增大(P<0.05),从(2.11±0.06)μm大幅度升至(6.13±0.22)μm。乳液放置4 周后,乳液粒径均有一定程度的增加。当果胶分子吸附到水-油界面后,首先经历一段时间的分子结构变化,以尽可能增大有利交联,减少不利缠结。随着贮藏时间的进一步延长,由于重力沉降和油脂氧化的作用,果胶分子逐渐从水-油界面脱离,从而可能引起果胶分子的聚集,以及乳滴间的桥接絮凝,最终导致乳液的粒径增加[32]。
高温导致乳液粒径增大的原因可能是温度升高,柑橘果胶黏度的骤降使其失去了稳定乳液的能力,同时高温促进了油滴的快速移动,加速了油滴间的聚合,最终导致乳液粒径的显著变化。此外,高温条件下果胶分子发生解聚,且不同乳滴粒子上果胶分子之间相互缠结,同样可能导致乳化稳定性的下降,使得乳液粒径增加[23-24]。
粒径分布、平均粒径大小和浊度的实验结果,说明甜菜果胶乳液较柑橘果胶具有更好的耐热稳定性,在高温处理中可以很好地保证产品品质,且其为酸性阴离子多糖;因此较柑橘果胶能更好地用于酸性乳饮料的生产中。
3 结 论
本研究首先对5 个地区的甜菜粕进行果胶提取,发现产地的不同对甜菜果胶的物化性质影响很大,尤其是对蛋白质和阿魏酸含量影响较大。将博城地区提取的甜菜果胶与柑橘果胶制备的乳液进行乳化特性的比较,通过考察果胶溶液质量浓度、温度和pH值等条件对乳液平均粒径、乳化活性和乳化稳定性、Zeta-电位等指标的影响,明确了两种果胶在乳化剂应用方面的前景。结论如下:对比柑橘果胶,质量浓度为5 mg/mL的甜菜果胶即可实现良好稳定的乳化效果,且乳液粒径小于25 mg/mL的柑橘果胶制得乳液具有良好的流动性;两种果胶对pH值这一环境条件均不敏感,具有较强的pH值抵抗性;甜菜果胶乳液对温度也极不敏感,而柑橘果胶乳液高温加热后不稳定,乳液迅速发分层。综合来看,与柑橘果胶相比,甜菜果胶整体具有较好的乳化活性和稳定性。
[1] 梅新. 甘薯膳食纤维、果胶制备及物化特性研究[D]. 北京: 中国农业科学院, 2010: 9-17.
[2] 崔健. 基于多层静电自组装技术构建乳化界面及乳液特性研究[D].北京: 中国农业大学, 2010: 1-10.
[3] SIEW C K, WILLIAMS P A. Role of protein and ferulic acid in the emulsification properties of sugar beet pectin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(11): 4164-4171.DOI:10.1021/jf073358o.
[4] MAZOYER J, LEROUX J, BRUNEAU G. Use of depolymerized citrus fruit and apple pectins as emulsif i ers and emulsion stabilizers:US59000268[P]. 1997-04-30.
[5] AKHTAR M, DICKINSON E, MAZOYER J, et al. Emulsion stabilizing properties of depolymerized pectin[J]. Food Hydrocolloids,2002, 16(3): 249-256. DOI:10.1016/S0268-005X (01)00095-9.
[6] 陈浩. 基于共价交联方式改善甜菜果胶乳化和凝胶性质的研究[D].北京: 中国农业大学, 2010: 1-3.
[7] 马森. 甜菜粕膳食纤维的提取、改性及其机理研究[D]. 广州: 华南理工大学, 2012: 19-21.
[8] SUN R C, HUGHES S. Fractional isolation and physico-chemical characterization of alkali-soluble polysaccharides from sugar beet pulp[J]. Carbohydrate Polymers, 1999, 38(3): 273-281. DOI:10.1016/s0144-8617(98)00102-7.
[9] 阎蔚. 甜菜废粕利用的现状与前景[J]. 中国甜菜糖业, 1994(2): 19-20.
[10] DRUSCH S. Sugar beet pectin: a novel emulsifying wall component for microencapsulation of lipophilic food ingredients by spraydrying[J]. Food Hydrocolloids, 2007, 21(7): 1223-1228. DOI:10.1016/j.foodhyd.2006.08.007.
[11] YAPO B M, ROBERT C, ETIENNE I, et al. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pulp pectin extracts[J]. Food Chemistry, 2007, 100(4): 1356-1364.DOI:10.1016/j.foodchem.2005.12.012.
[12] 张翼飞, 张晓旭, 刘洋, 等. 中国甜菜产业发展趋势[J]. 黑龙江农业科学, 2013(8): 156-160. DOI:10.3969/j.issn.1002-2767.2013.08.043.
[13] MOHNEN D. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277. DOI:10.1016/j.pbi.2008.03.006.
[14] RIDLEY B L, O’NEILL M A, MOHNEN D. Pectins: structure,biosynthesis, andoligogalacturonide-related signaling[J].Phytochemistry, 2001, 57(6): 929-967. DOI:10.1016/S0031-9422(01)00113-3.
[15] FUNAMI T, NAKAUMA M, ISHIHARA S, et al. Structural modifications of sugar beet pectin and the relationship of structure to functionality[J]. Food Hydrocolloids, 2011, 25(2): 221-229.DOI:10.1016/j.foodhyd.2009.11.017.
[16] 吕程. 甜菜果胶的提取优化及乳化、流变特性研究[D]. 北京: 中国农业大学, 2013: 27-31.
[17] MASMOUDI M, BESBES S, CHAABOUNI M, et al. Optimization of pectin extraction from lemon by-product with acidif i ed date juice using response surface methodology[J]. Carbohydrate Polymers, 2008,74(2): 185-192. DOI:10.1016/j.carbpol.2008.02.003.
[18] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.DOI:10.1016/0003-2697(76)90527-3.
[19] 郦金龙, 刘欢, 赵文婷, 等. 甜菜果胶酶促交联对蛋白质乳化液稳定性的影响[J]. 农业机械学报, 2011, 42(2): 138-143. DOI:10.3969/j.issn.1000-1298.2011.02.029.
[20] 郭兴峰. 柚皮果胶超高压和闪式提取及降解机制研究[D]. 北京: 中国农业大学, 2013: 45-47.
[21] 韩冬梅. 不同提取方法对橙皮果胶影响研究[D]. 北京: 中国农业大学, 2010: 49.
[22] 王军. 乳化与微乳化技术[M]. 北京: 化学工业出版社, 2012: 67-69.
[23] LIU Y, QIU S, LI J L, et al. Peroxidase-mediated conjugation of corn fiber gum and bovine serum albumin to improve emulsifying properties[J]. Carbohydrate Polymers, 2015, 118: 70-78. DOI:10.1016/j.carbpol.2014.10.059.
[24] CHEN H, QIU S, GAN J, et al. New insights into the functionality of protein to the emulsifying properties of sugar beet pectin[J].Food Hydrocolloids, 2016, 57: 262-270. DOI:10.1016/j.foodhyd.2016.02.005.
[25] FUNAMI T, ZHANG G Y, HIROE M, et al. Effects of the proteinaceous moiety on the emulsifying properties of sugar beet pectin[J]. Food Hydrocolloids, 2007, 21(8): 1319-1329. DOI:10.1016/j.foodhyd.2006.10.009.
[26] NAKAUMA M, FUNAMI T, NODA S, et al. Comparison of sugar beet pectin, soybean soluble polysaccharide, and gum arabic as food emulsif i ers. 1. effect of concentration, pH, and salts on the emulsifying properties[J]. Food Hydrocolloids, 2008, 22(7): 1254-1267.DOI:10.1016/j.foodhyd.2007.09.004.
[27] KIM Y, WICKER L. Valencia PME isozymes create charge modif i ed pectins with distinct calcium sensitivity and rheological properties[J].Food Hydrocolloids, 2009, 23(3): 957-963. DOI:10.1016/j.foodhyd.2008.07.006.
[28] NAKAMURA A, FUJII N, TOBE J, et al. Characterization and functional properties of soybean high-molecular-mass polysaccharide complex[J]. Food Hydrocolloids, 2012, 29(1): 75-84. DOI:10.1016/j.foodhyd.2012.01.018.
[29] RAZZAK M A, KIM M, CHUNG D. Elucidation of aqueous interactions between fi sh gelatin and sodium alginate[J]. Carbohydrate Polymers, 2016, 148: 181-188. DOI:10.1016/j.carbpol.2016.04.035.
[30] MCCLEMENTS D J. Critical review of techniques and methodologies for characterization of emulsion stability[J].Critic Review Food Science Nutrition, 2007, 47(7): 611-649.DOI:10.1080/10408390701289292.
[31] CHANAMAI R, MCCLEMENTS D J. Comparison of gum arabic,modif i ed starch and whey protein isolate as emulsif i ers: inf l uence of pH, CaCl2and temperature[J]. Journal of Food Science, 2002, 67(1):120-125. DOI:10.1111/j.1365-2621.2002.tb11370.x.
[32] MCCLEMENTS D J. Protein-stabilized emulsions[J]. Current Opinion in Colloid and Interface Science, 2004, 9(5): 305-313. DOI:10.1016/j.cocis.2004.09.003.
Emulsifying Activity and Stability of Sugar Beet Pectin
CHEN Hao1,2, ZHANG Kaihua2, LIU Shiyong3, YUE Xiaoqiang4, GAN Jing2, QIU Shuang2, JI Aiguo1, YIN Lijun2,5,*
(1. Marine College, Shandong University (Weihai), Weihai 264209, China; 2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, China Agricultural University, Beijing 100083, China; 3. Department of Food Engineering, Weihai Ocean Vocational College, Weihai 264300, China; 4. Cargill Asia Pacif i c Food System (Beijing) Co. Ltd., Beijing 102200, China;5. College of Cereal and Food, Henan University of Technology, Zhengzhou 450001, China)
Sugar beet pectin (SBP) is an acidic anion polysaccharide extracted from beet pulp. The backbone of SBP is comprised of rhamnose and galacturonic acid, which are rich in neutral sugar side chains, including rhamnose, arabinose,galactose and fructose. The proteins are covalently attached to the end of the neutral sugar side chains, contributing to the excellent emulsifying properties of SBP. This paper focuses on a comparison of the emulsifying properties of SBP and citrus pectin (CP). The effects of the growing area of sugar beet pulp, pectin concentration, pH, thermal treatment and storage time on the emulsifying properties (including drop size distribution, average particle size, zeta-potential, and turbidity) of the pectin were investigated. It was found that the geographical origin of sugar beet pulp showed a great in fl uence on the protein composition in SBP. The drop size of the emulsion prepared with citrus pectin was much larger than that of SBP emulsion, and the former also exhibited poorer emulsifying activity. Emulsions coated with 10—25 mg/mL sugar beet pectin maintained good stability during the storage period (four weeks), while the droplet size of citrus pectin emulsion increased signi fi cantly. Emulsion droplet size remained stable in the swrange of pH 2—6. The droplet size of CP emulsion increased signi fi cantly during thermal treatment(25—85 ℃). This study veri fi ed that SBP exhibited excellent emulsifying activity and emulsion stability.
sugar beet pectin; geographical origin; citrus pectin; emulsifying activity; emulsion stability
10.7506/spkx1002-6630-201801010
TS202.3
A
1002-6630(2018)01-0065-08
陈浩, 张凯华, 刘世永, 等. 甜菜果胶乳化活性及稳定性[J]. 食品科学, 2018, 39(1): 65-72.
10.7506/spkx1002-6630-201801010. http://www.spkx.net.cn
2016-09-19
公益性行业(农业)科研专项(201303079);“十二五”国家科技支撑计划项目(2014BAD04B06)
陈浩(1988—),女,讲师,博士,研究方向为亲水胶体理论及技术。E-mail:chenhao_2016@sdu.edu.cn
*通信作者简介:殷丽君(1971—),女,教授,博士,研究方向为亲水胶体理论及技术。E-mail:ljyin@cau.edu.cn
CHEN Hao, ZHANG Kaihua, LIU Shiyong, et al. Emulsifying activity and stability of sugar beet pectin[J]. Food Science,2018, 39(1): 65-72. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801010. http://www.spkx.net.cn
