青藤碱对肺癌模型大鼠抑癌基因P16和P53的影响*
2018-01-05郑化军王贤和柯昌斌
郑化军,王贤和,柯昌斌,李 莉
(1.湖北医药学院附属人民医院 十堰 442000;2.十堰市太和医院十堰 442000;3.湖北医药学院 十堰 442000)
P53为编码53的蛋白,是最常见抑癌基因之一[1]。P53参与调控细胞增殖和分化,在一定程度上维持基因的稳定性,防止肿瘤细胞突变转移。P53高表达与肿瘤的生长、浸润及转移有密切关系[2]。P16基因也是一种抑癌基因,参与调控细胞分化与增殖[3]。P53和P16直接或间接地参与细胞周期调控,这种负调控可抑制细胞无限分化与增殖,因此,任何引起P53和P16基因突变的因素均会引起细胞周期紊乱,导致肿瘤细胞逃避这种负性调控,细胞出现无绪分化与增殖而引发恶性肿瘤[4]。因此,纠正P53和P16基因过度表达可使细胞增殖与调亡周期维持在正常范围内,降低肿瘤的发生概率。青藤碱是目前已知的抗癌中草药之一,其主要通过抑制肿瘤细胞G1-S期,对乳腺癌、肺癌、前列腺癌等多种恶性肿瘤细胞的分化增殖均有肯定的抑制作用[5]。目前青藤碱对肺癌的治疗机制鲜有实验报告,其对肺癌极具研究价值,本实验通过观察其对WALKER-256移植性肺癌大鼠抑癌基因P53和P16及其基因表达的影响,研究其治疗机制。
1 实验材料
1.1 药物与试剂
青藤碱(成都德思特生物技术有限公司,批号:017020293);大鼠Walker癌肉瘤256瘤株购自上海鑫闵生命科学有限公司;鼠P16、P53ELISA试剂盒均购自上海双赢生物科技有限公司;Matrigel基质胶(上海前尘生物科技有限公司,批号:354230);注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号:0170123012)。
1.2 实验动物
SPF级SD大鼠50只,雄性,体重160±10 g,免疫缺陷的雄性BALB/c-nu/nu2裸小鼠4只,体重20±2 g,所有实验动物均由湖北医药学院实验动物中心提供,动物许可证(SCXK(鄂)2017-0008),设施许可证号(SYXK(鄂)2017-0031)。
2 实验方法
2.1 瘤源处理
取出储存Walker癌肉瘤256瘤株的冷冻管,立即放入37℃水槽中快速解冻,轻摇冷冻管使其全部融化,直接倒入含有10 mL新生小牛血清的RPMI-1640培养液的培养角瓶复苏24 h,去除溶质二甲基亚砜(Dimeth⁃yl Sulfoxide,DMSO),然后注入离心管低速1000 r⋅s-1离心,5 min,弃上清液,取底部Walker-256癌细胞,用RPMI-1640培养液配制成1×107mL-1的混悬液,注射到BALB/c-nu/nu2裸小鼠腹腔(0.2 mL/只),一周后抽取BALB/c-nu/nu2裸小鼠腹水,作为瘤源置于4℃冷冻管保存备用[6]。
2.2 建立Walker-256移植性肺癌模型方法
参照文献[7],将储存的Walker癌肉瘤256瘤株小鼠腹水,先用细胞计数仪计数,然后再用生理盐水稀释成1.5×106mL-1癌细胞混悬液备用。用3%戊巴比妥钠腹腔注射麻醉大鼠,碘伏消毒大鼠左胸皮肤,将1.5×106mL-1的WALKER-256细胞悬液与等体积的Matrigel基质胶在冰面上混匀,用10注射器抽取以上混合液,于左肺5-6肋间注射0.5 mL(进针深度约0.6 cm),停针10 s后缓慢拔出针管,3周后可得Walker移植性肺癌模型。注射建模后单笼饲养,自然光照,自由饮水和摄食,动物房恒温在20-22℃,恒湿60%-70%。本方法制备简单、对大鼠损伤小、肿瘤病灶部位明确、单一、成瘤率高,且动物死亡率低。本实验在注射瘤源3周后,死亡大鼠7只,经影像学拍片检查,成瘤大鼠30只,成肿瘤率为75%。
2.3 实验动物分组与处理
挑选成瘤SD大鼠30只,采用随机数字表编号后随机分为模型组、环磷酰胺组、青藤碱治疗组(n=10),另取10只健康SD大鼠设为正常对照组。青藤碱治疗组按100 mg⋅kg-1⋅d的剂量背部皮下注射10%青藤碱,正常对照组和模型组按1 mL⋅kg-1⋅d剂量注射生理盐水,环磷酰胺组按5 mg·kg-1·d的剂量注射作为阳性对照。4组均按1次/日,连续给药10周。

表1 P53,P16及β-actin引物序列表及其扩增产物大小
2.4 Walker-256移植性肺癌抑瘤率检测及细胞周期比值检测
于最后一次给药后,处死大鼠,摘取左肺瘤体,分离包膜,称重,用游标卡尺准确测量瘤体长、短径各3次,取均其均值计算瘤体积。瘤体积=ax6/2,a为肿瘤长径,b为肿瘤短径。抑瘤率(%)=(模型组平均瘤重-青藤碱治疗组平均瘤重)/模型组平均瘤重×100%。将分离好的瘤体用生理盐水冲洗干净,编号,-4℃冷藏备检。检测时将肿瘤组织匀浆,采用美国Epics Altra流式细胞仪检测WALKER-256癌细胞在G1、G2、M和S期的增殖周期比例。
2.5 免疫组化法检测P53和P16
采用免疫组化法检测瘤体P53和P16蛋白阳性表达率,P53和P16蛋白阳性为染色后棕黄色或黄褐色,检测时在高倍镜下随机取10个视野,各计数100个细胞,分别计算P53和P16蛋白阳性表达率。
2.6 RT-PCR方法检测瘤体P53,P16 mRNA表达
取瘤体组织50 mg,一步法提取瘤体组织总RNA,取1 μg总RNA,用AMV逆转录酶进行逆转录,逆转录产物PCR扩增,以β-actin为内参,检测P53和P16mRNA表达。引物序列见表1。PCR反应体系:反转录产物1 μL、Taq酶(5 u·μL-1)0.45 μL、dNTPs(10 mmo1 ⋅L-1)1 μL、含 15 mmol/LMg2+缓冲液5 μL,β-actin的上、下游引物各1 μL,P53和P16上、下游引物各1 μL,用灭菌水补充至50 μL。PCR反应条件为:93℃,30 s;94℃,3 min;64℃,30 s;71℃,1 min;35个循环,71℃,7 min。以目的基因灰度值/β-actin灰度值之比值表示P53、P16mRNA的相对值[8]。
2.7 统计学处理
用SPSS 19.0统计分析软件处理实验所测数据,先对各组进行方差分析,实验所测数据以(±s)表示,组间差异则采用两样本均数Dunnet-t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 青藤碱对肺癌模型大鼠瘤体形态及抑瘤率的影响
青藤碱组瘤质量、瘤体积均低于模型组,抑瘤率高于模型组,与模型组比较,P<0.05,与正常对照组和环磷酰胺组比较,P<0.05,差异有统计学意义。结果见表2。
3.2 青藤碱对大鼠瘤体P53和P16蛋白及基因表达的影响
正常对照组大鼠肺组织上均有P53和P16蛋白阳性表达。模型组大鼠肺瘤体组织上有大量P53和P16蛋白阳性表达,P53mRNA和P16mRNA高表达,与正常对照组比较,P<0.05,差异有统计学意义。环磷酰胺组P53和P16蛋白阳性率明显降低,P53mRNA和P16mRNA低表达,与模型组比较,P<0.05,差异有统计学意义,提示经阳性药治疗后,瘤体P53和P16蛋白及基因表达均降低。青藤碱治疗组P53和P16蛋白阳性率明显降低,P53mRNA和P16mRNA低表达;与模型组比较,P<0.05,但均未完全达到正常水平;与正常对照组和环磷酰胺组比较,P<0.05,差异有统计学意义。结果见表3。
3.3 青藤碱对肿瘤细胞G1、G2、M和S增殖周期比例的影响
模型组大鼠肺瘤体组织G1和G2期细胞增殖比值降低、S期显著提高,与正常组比较,P<0.05,差异有统计学意义。环磷酰胺组G1和G2期细胞增殖比值提高、S期降低,与模型组比较,P<0.05,差异有统计学意义。青藤碱治疗组G1、G2期细胞增殖比值提高、S期降低,与模型组比较(P<0.05),但均未完全达到正常对照组水平,与正常对照组和环磷酰胺组比较,P<0.05,差异有统计学意义。结果见表4。
4 讨论
肺癌是最为常见、多发的呼吸系统恶性肿瘤肿瘤之一,其发病率呈逐年上升趋势,严重危害着人类的生命及健康[9]。肺癌的治疗以手术切除、抗癌药、化疗为主,其副作用及化疗反应大,5年生存率不高。中医中药在对肺癌的治疗上由来已久,至今有不少中医家和学者对肺癌进行了系统的研究,积累了很多独到诊疗经验,对提高患者免疫机能、减少肿瘤细胞复发或转移,延长患者生存时间具有一定的优势,已成为肺癌等恶性肿瘤肿瘤的一种有效的治疗方法[10]。在祖国医学中肺癌以“积”名之,属于“肺壅”、“肺积”之范畴,认为癌毒先侵袭于肺而导致肺部症积。肺之气阴不足是本、瘀血、痰浊、热毒及内停是标,癌毒阻于内、阻碍肺气,耗伤气津、步入损途而致肺癌[11,12]。而从西医的角度分析,肺癌的病理以身改变是由于P53和P16基因突变,G1、G2、M和S各细胞周期紊乱,由此导致肿瘤细胞的分化、生长和凋亡失控,引起细胞无限制性分化、增殖,并导致肿瘤细胞恶化和转移[13]。P53和P16基因编码的P53和P16蛋白能直接或间接地抑制细胞周期依赖激酶的活性,负调控细胞周期,抑制细胞增殖[14]。因此,从理论上讲,任何影响P53和P16基因表达的药物均可能与肿瘤细胞分化、生长和凋亡密切相关。本实验基于这一理论,对青藤碱是否会影响肺癌P53和P16基因表达进行了系统的观察和研究。
结果表明,模型组抑瘤率仅2.47%,P16mRNA和P53mRNA高表达,瘤体积、瘤质量、P16和P53蛋白阳性表达率明显高于正常对照组,肺瘤体组织G1和G2期细胞增殖比值降低、S期显著提高,这证实P16和P53蛋白在Walker-256移植性肺癌起到了负调控作用,细胞增殖周期紊乱,高表达的P16和P53引起肿瘤细胞无限制性分化、增殖,使P16和P53无法起到抑癌调控作用,肿瘤瘤体积、瘤质量因无限制性分化、增殖而增大。而在使用青藤碱注射治疗10周后,青藤碱组抑瘤率达30.15%,瘤体积、瘤质量、P16和P53蛋白阳性表达率明显降低,P16mRNA和P53mRNA低表达。青藤碱(Sinomenine)又名防己碱,是从防己科植物青风藤的干燥根茎中采用化学方法分离提取的纯生物碱[15]。在体外细胞培养中,青藤碱对肿瘤细胞G1周期阻滞,诱导肿瘤凋亡,对G2期也有一定的抑制作用[16,17]。在实验中,青藤碱通过对P16和P53负调控作用而发挥抑癌作用,这一作用虽无阳性对照组环磷酰胺组强,但与其作用类似,调整肿瘤细胞周期,抑制肿瘤细胞分化、增殖。在青藤碱对照组中,经流式细胞仪检测,显示本组G1和G2期细胞比值提高,S期细胞比例降低,这提示青藤碱通过诱导肿瘤细胞的G1、G2、S期这一细胞周期限制点,阻滞肿瘤的生长。环磷酰胺为抗肿瘤药,在进入体内后先在肝脏中经微粒体功能氧化酶转化成醛磷酰胺。而醛酰胺不稳定,在肿瘤细胞内分解成酰胺氮芥及丙烯醛,酰胺氮芥对肿瘤细胞有细胞毒作用。环磷酰胺是双功能烷化剂及细胞周期非特异性药物,可干扰DNA及RNA功能,尤以对前者的影响更大,它与DNA发生交叉联结,抑制DNA合成,对S期作用最明显。在本实验中,青藤碱抑癌机制与环磷酰胺相似,但作用没有环磷酰胺强,青藤碱通过影响细胞周期这一节点抑制肿瘤细胞的生长。
表2 青藤碱对肺癌模型大鼠瘤形态及抑瘤率的影响(±s,n=10)
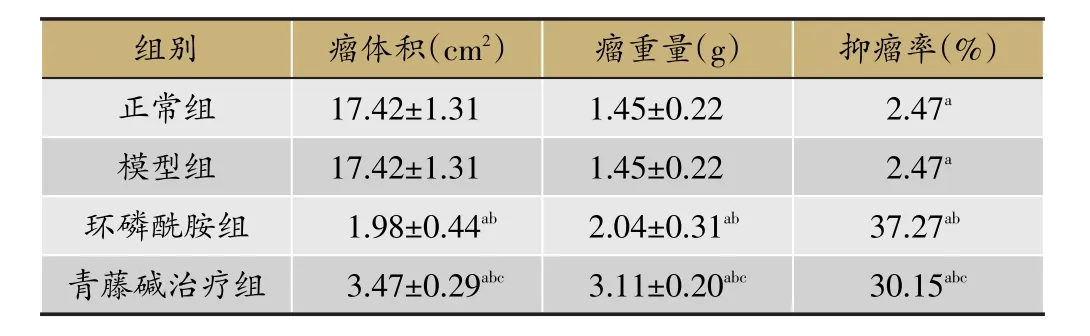
表2 青藤碱对肺癌模型大鼠瘤形态及抑瘤率的影响(±s,n=10)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05
表3 大鼠肺组织P53、P16表达及其mRNA表达比较(±s,n=10)

表3 大鼠肺组织P53、P16表达及其mRNA表达比较(±s,n=10)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05
表4 G1、G2、M和S四增殖周期细胞比例比较(±s,n=10)
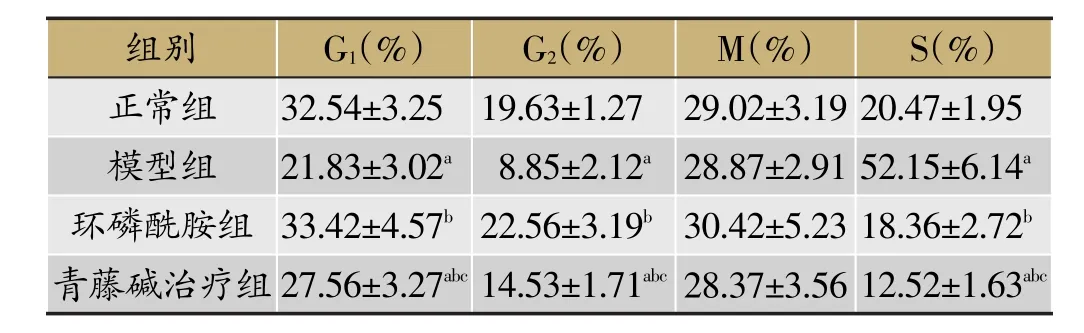
表4 G1、G2、M和S四增殖周期细胞比例比较(±s,n=10)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05
综上所述,青藤碱可能通过影响抑癌基因P16和P53表达,并调节G1和G2和S期细胞比值而起到抑制大鼠WALKER-256移植性肺癌肿瘤细胞的分化和增殖,降低了肿瘤细胞无限制的分化风险而发挥了抑瘤作用。
1 刘东芳,王晓红,刘春秋.P53蛋白在非小细胞肺癌中表达及与其临床特征、同步放化疗疗效的关系分析.实用癌症杂志,2016,31(1):26-28.
2 Mayo L D,Dixon J E,Durden D L,et a1.PTEN protects P53 from Mdm2 and sensitiz-es cancer cells to chemotherapy.J Biol Chem,2002,277(7):5484-5489.
3 冯蓓,杨卫卫,杨小平.P16基因在不同非小细胞肺癌之间的表达比较.陕西医学杂志2015,44(5):618-619.
4 Pascoe J,Hoiler D,Stamateris R,et a1.Free fatty acids block glucoseinduce β-cell proliferation in mice by inducing cell cycle inhibitors Pl6 and P18.Diabetes,2012,61(3):632-641.
5 陈伟毅,秦春宏,银晓刚.青藤碱抗肿瘤作用研究进展.中国药师,2013,16(10):1902-1903.
6 徐小华,李清林.基于C57/BL6J小鼠的动物移植性肺癌模型的建立及评价研究.中华中医药学刊,2015,10(2):281-283.
7 黄文革,李婕,陈凤英.大鼠Walker-256移植性肺癌模型的建立.中国比较医学杂志,2012,22(4):64-67.
8 张立广,王军,胡潺潺.赤芍总苷对肺癌模型大鼠抑癌相关基因表达的影响.中国药房,2016,27(16):2218-2220.
9 屠洪斌,董志毅,王少墨.原发性肺癌中医证型规律与化疗及靶向治疗的相关性研究.世界科学技术-中医药现代化,2014,16(9):1997-2001.
10 张水宝,何小鹤,范宏宇.肺癌的中医治疗进展.中医研究,2016,29(12):70-72.
11 李春香.肺癌中医虚证的研究进展.中医临床研究,2016,8(10):141-143.
12 许玲,李和根,王中奇.聚焦重大疑难疾病,提高中医药自主创新能力-国家中医临床研究基地(恶性肿瘤)建设.世界科学技术-中医药现代化,2013,15(5):1100-1107.
13 王应熊.肿瘤与遗传.分子与细胞,北京:人民卫生出版社,2016,9:23-33.
14 温桂兰,李江琪,邹国明.P16、P53、P2l基因对肺癌细胞增殖的影响.中华结核和呼吸杂志,1999,22(3):169-172.
15 康小东,杨绪芳,李峰.痛安注射液青风藤中间体纯化工艺研究.世界科学技术-中医药现代化,2015,17(5):1090-1094.
16 姜廷枢,李胜歧.青藤碱对肺腺癌细胞系A549增殖和凋亡的影响.中国老年学杂志,2010,30(5):655-657.
17 汪蕊,秦叔逵,陈余清.环磷酰胺节拍化疗联合重组人血管内皮抑制素对非小细胞肺癌移植瘤裸鼠的影响及其机制研究.中国病理生理杂志,2013,29(3):436-441.
