三七植物化学成分及药理作用研究进展*
2018-01-05袁一怔尉广飞张连娟董林林
杨 娟,袁一怔,尉广飞,张连娟,徐 江,董林林**
(1.云南农业大学农学与生物技术学院 昆明 650201;2.中国中医科学院中药研究所 北京 100700;3.多伦多大学应用科学与工程学院 多伦多 M5S 1A1)
三七(Panax notoginseng(Burk.)F.H.Chen)属五加科人参属多年生宿根草本植物,主要产于我国云南省[1]。据文献记载,三七在我国已有近500年的药用历史,当今已有400余种中成药含有三七成分,如云南白药、三七血伤宁胶囊、神农镇痛膏等[2]。三七植物中含有皂苷类、多糖类、氨基酸核蛋白质、黄酮类、有机酸类、甾醇类等多种成分,主要可分为皂苷及非皂苷两大类。皂苷类物质为三七主要有效药用成分[3]。三七为药的传统功效为止血、散瘀、消肿、止痛、补虚等,现代药理研究发现三七在免疫系统、心血管系统、神经系统、抗肿瘤、抗衰老等方面同样具有药理活性,而且有研究表明将三七多种单体皂苷配伍使用会增强其药理作用。
本文综述了三七中主要化学成分三七总皂苷和多糖的研究进展,包括提取分离工艺、主要药理作用等内容,为优化工业上的三七提取工艺,提高三七药用成分的提取效率与提取质量,推广三七的药用价值提供参考。
1 三七主要化学成分
三七中含有多种化学成分,如皂苷类、多糖类、黄酮类、炔类、醇类等,其中主要药用成分为皂苷类化合物、三七素、蛋白质及氨基酸成分等[2]。
1.1 皂苷类
三七中主要化学成分为皂苷类化合物。利用现代科技手段已发现三七有百余种单体皂苷类成分,根据甘元的不同可分为4类:20(S)-原人参二醇型(PPD)、20(S)-原人参三醇型皂苷(PPT)、C17侧链变化型及其它种类,还有新的化合物不断被发现[2]。三七主要单体皂苷母核结构如图1所示,PPD型皂苷为主要类型,PPT型皂苷含量较少[2]。主要单体皂苷为人参皂苷Rb1、人参皂苷Rg1、三七皂苷R1、人参皂苷Rd及人参皂苷Re,我国规定三七中以上5种皂苷类物质总含量不得低于75%[5]。在三七总皂苷中,人参皂苷Rb1含量至少为30%,人参皂苷Rg1含量至少为25%,人参皂苷Rb含量至少为5%,人参皂苷Re含量至少为2.5%,才符合相应的质量标准[5]。
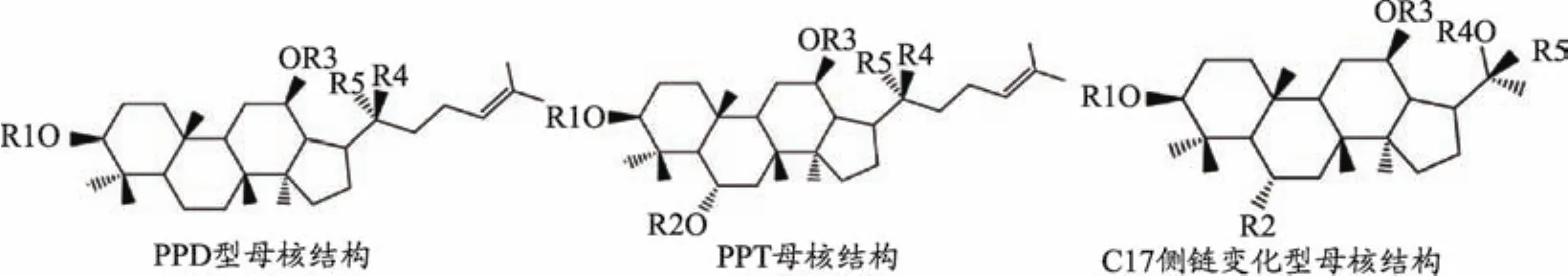
图1 三七皂苷基本结构[2]

表1 三七皂苷提取工艺对比
1.2 多糖类
糖类为三七中的药用成分之一,主要含有多糖、低聚糖、木糖及鼠李糖等,由DNS法测得三七总多糖平均含量为9.45%[4]。三七中含有多种多糖类活性物质,有三七多糖I、II(IIa、IIb)、III三大类,主要由半乳糖、葡萄糖、甘露糖、阿拉伯糖、鼠李糖组成[6,7]。三七多糖II由半乳糖、葡萄糖、阿拉伯糖组成,并含有糖醛酸[7]。我国学者通过研究测得三七多糖IIa为分子质量28300及998800的混合物,三七多糖IIb为分子质量为20700的物质,主要由葡萄糖、半乳糖、阿拉伯糖组成[7,8]。
三七根部多糖的含量与其规格、采收期及产地密切相关。研究表明,三七块根越大,其多糖含量越高,如20头三七中多糖含量为160头中多糖含量4倍;采收月份为4月、8月、11月的三七多糖含量最高;产地不同多糖含量差异较大,如砚山者腊三七多糖含量为0.18%,广西靖西三七多糖含量仅为0.011%;且不同部位多糖含量也不一,三七主根、花及茎多糖含量分别为45%、26%、20%[9]。
2 三七化学成分提取工艺
三七中不同化学成分的提取工艺大致相同,主要分为传统提取工艺及新型提取工艺。传统提取工艺包括煎煮法、醇回流法等,新型提取工艺包括超声波提取法、酶解法、闪式提取法等。
2.1 三七总皂苷提取方法
三七总皂苷的传统提取方法为煎煮法,但此方法耗时较长。目前,三七总皂苷的常用提取方法为醇回流法(表1)。随着现代科技的发展,一些新型科技的提取方法也应用到生产实践中来,如闪式提取法、超声波提取法等,此类方法虽提取效率高,但成本较高,暂未实现大规模工业化生产。
煎煮法可以提取出三七中大部分有效成分。将三七粉末或切片加水浸泡一段时间后,加热至保持水轻微沸腾,将煎出液分离开,加入定量的水煎煮药渣数次,最终使煎出液浓缩达到规定浓度[10]。该方法适用于易溶于水、受热不会变性的有效成分[11]。煎煮法为最传统的三七总皂苷提取方法,为工业上常用的提取方法之一。
醇回流提取法使用工业甲醇、工业乙醇等挥发性醇类为有机溶剂,加热蒸馏浸出液,有机溶剂挥发后被冷凝管冷却,重回流至容器,直至有效成分完全被提取[10]。樊钰虎等[12]发现三七醇回流提取法的最佳条件为:用8倍体积的50%乙醇浸泡三七粗粉40 min,共回流提取2次,每次2 h。该类方法为工业上常用的提取工艺,提取效率较煎煮法相比较高。
闪式提取法又名细胞破碎提取法。利用新型的闪式提取器,依靠机械剪切力将植物组织切碎至微小颗粒,并使植物颗粒内外翻动,产生搅拌,直至体系的浓度达到稳定。相较于醇回流法及超声波提取法,使用该方法将提取时间缩短了约16倍,并且提取率也有所提高[13]。利用闪式提取法提取三七总皂苷后可以简化后续对皂苷单体的监测步骤[13,14]。

表2 三七多糖提取工艺对比
超声波提取法的原理是液体空化作用,可以避免高温对有效物质的破坏,增加介质表面积,使溶剂穿透力增强,进而使提取效率提高[15]。丁艳芬等[15]通过改良超声波提取技术,使三七总皂苷含量及人参皂苷含量达到80%以上,改良后的提取条件为:75%乙醇浸泡三七粉末后,提取温度为40℃,使用超声波提取,每次提取30 min,提取4次。
根据树脂及其处理方法的不同,大孔吸附树脂法可以吸附有机溶剂或水中的不同化学有效成分。陈佳亮等[16]经对比发现AB-8型大孔树脂分离三七总皂苷效果最佳,并设计优化了纯化工艺:树脂与三七药材量应等量,上样流速为1.0 mL·min-1,上样药液浓度为0.1 g·mL-1,除杂使用3倍量水,洗脱为8倍量的70%乙醇,且分离时应去除树脂内的气泡,串联塔板式柱相较于普通树脂柱分离效果佳。大孔吸附树脂对三七总皂苷的吸附效果与温度有关,当温度为40℃时,大孔吸附树脂柱对三七总皂苷的吸附的比例明显增加,比常温条件(20℃-30℃)下增加18.1%,且当三七总皂苷洗脱量相同时,40℃条件下比常温时的洗脱溶剂用量减少2倍;当外界温度达到60℃条件时,吸附比例下降明显[16]。谢茵等[13]使用HPD-100型大孔树脂柱纯化三七总皂苷,发现当使用5倍柱体机的70%乙醇时,洗脱率可达98.3%,已达到工业生产水平,可用于工业生产。
超滤技术用于分离纯化三七总皂苷中分子量不同的单体皂苷,可以去除三七皂苷提取液中的杂质,提高澄清度。使用选择性透过膜为分离介质,可以分离混合物中不同分子大小的有效物质[17]。使用能滤过特定分子量的膜除杂质,使小分子的活性物质透过膜,截流大分子物质,达到分离特定分子量物质的目的。陈彤等[18]通过实验发现,使用截留分子量为100 KD的卷式聚醚砜超滤膜为中试超滤膜,可以滤过大部分异物,且截流率小于0.7%。但由于人参皂苷Rb1极性较小,故Rb1截流量过高,截流液中Rb1含量较原液相比提高了约2%。为优化此类提取工艺,应减少极性小的三七单体皂苷的截流量,选择截流量较低的超滤膜。
2.2 三七多糖的提取过程
三七多糖的提取方法包括超声波萃取法、超声波萃取法、内部沸腾法等(表2)。研究发现,三七根部中多糖含量较少,最高仅为0.18%,而提取三七总皂苷后的药渣具有高达3.8%的三七多糖[19,20]。故直接提取三七多糖消耗过大,相较之下,利用三七叶、花或提取三七总皂苷后的滤渣提取三七多糖较为经济。
内部沸腾法利用三七中的有效化学成分易溶于乙醇溶剂的特点,使用50℃水浴加热,使乙醇汽化并带出活性物质,过滤去除皂苷类、单糖等三七小分子物质。翁艳英等[21]研究表明,当提取温度达到95℃时,使用体积分数为80%的解吸剂,溶剂用量与样品容量的比为15:1时,提取时间为8 min,三七多糖提取率可达6%,含量为60%,比普通的醇回流提取方法速度提升了15倍,且三七多糖得率提高了2%。
超声波萃取法对三七粉末产生搅拌及击碎作用,增加活性物质的运行频率及速度,促使活性物质进入有机溶剂。李江霞等[22]研究表明,超声波辅助萃取法提取三七多糖的最佳工艺为:三七粉过40目,料液比为1:15,共提取2次,每次提取时间为30 min,提取温度为60℃,功率为26 kHz时,三七多糖提取率最高,可达6%。
泡沫分离法是利用气泡作为载体,依据表面吸附性质,使表面活性物质吸附于小气泡上,从而达到分离不同活性物质的目的。王良贵等[23]通过实验发现,当进料体积为8.0 mL,氮气流速为15 mL·min-1时,利用水煎煮后得到的三七粗提液提取三七多糖,液相三七多糖的收得率为87.5%。该方法具有高效、操作简便、无污染的优势,并且可以同时分离三七粗提液中的三七皂苷及三七多糖。
3 药理作用
三七皂苷的主要药理作用包括抗炎、抗肿瘤、提高免疫力、保护心血管等,三七多糖主要具有提高免疫力的作用,三七黄酮具有改善血液循环、稳定心率、防止血栓等功效[24]。三七醇类对小鼠肝肿瘤细胞有一定的抑制转移作用、对体外的氧化损伤模型有抗氧化的作用并有一定的氧化修复作用[25,26]。同时三七还在抗休克、抗细胞增殖、抗炎、抗病毒、抗辐射、抗纤维化等方面有明显的药理作用[13]。
3.1 抗炎
三七单体皂苷Rd、Rb1为主要抗炎成分[27]。马岩岩等[27]通过对三七总皂苷(PNS)和五种单体皂苷研究,发现三七皂苷Rd、Rb1对iNOS、TNF-α、IL-6和IL-1β四种炎性因子有抑制作用,并且三七皂苷Rd对p-p38和p-JNK蛋白有明显抑制作用。PNS、三七皂苷Rd、Rb1通过抑制NF-κB和MAPK通路从而起到抗炎的作用[27,28]。
3.2 对神经系统的影响
三七的主要疗效之一是治疗缺血性中风。黄小平等[29]通过将三七的有效成分人参皂苷Rg1、Rb1、三七皂苷R1分别与黄芪的主要有效成分黄芪甲苷配对注入脑缺血的小鼠后发现,人参皂苷Rg1可以降低脑组织中一氧化氮含量,且黄芪甲苷分别与三种皂苷配伍可以抑制细胞质中核转录因子E2相关因子(Nrf2)蛋白含量的增加,提升细胞核中Nrf2含量,促进Nrf2核转位,增强脑组织中蛋白质表达和HO-1基因蛋白质表达,继而增强抗脑缺血及再灌注后氧化应激损伤的作用。
三七总皂苷(PNS)可以增加海马内乙酰胆碱(Ach)的数量,提高甲肾上腺素、5-羟色胺和多巴胺的量,提高神经元细胞的数量,提高乙酰胆碱移位酶活性,起到保护中枢胆碱系统的效果[30,35]。三七主要皂苷成分对血管性痴呆(VD)的大鼠有一定的记忆力提升功效,动物的实验性痴呆症得到明显改善,通过给患有VD的大鼠连续喂养30天三七通舒胶囊(含三七皂苷100 mg,每粒200 mg)后进行Morris水迷宫实验,发现大鼠的空间探索能力明显提高,逃离潜伏期时间缩短[30]。三七总皂苷对阿尔茨海默病(AD)有一定的治疗效果。黄金兰等[31]通过实验研究表明,PNS通过提高ADAM9 mRNA表达,进而提高SAMP8小鼠脑部中α分泌酶活性,通过下调BACE1 mRNA表达,降低β分泌酶活性,达到抑制APP代谢为β淀粉样蛋白的效果。
PNS对中枢神经有一定的镇静作用。人参皂苷Rb1为三七中主要的镇静成分,Rb1可以降低突触体内谷氨酸的含量,抑制动物的自主活动,达到抑制中枢神经的效果[32]。三七挥发油的主要功效是对中枢神经系统有一定的抑制、镇静作用,对多种疼痛感有一定的抑制作用,并没有使人成瘾的副作用[28]。
3.3 对心血管的作用
PNS对心肌有一定的保护作用,具有活血化淤、止血及补血的作用。三七皂苷R1对由缺血所引起的心肌损伤有治疗修复的作用。三七皂苷R1通过促进位于梗死心肌血管内的bFGF及VEPF的蛋白质表达,促进缺血心肌血管的新生[33]。吴颖等[28]经实验表明,三七皂苷R1可以降低心肌组织中IL-1β、TNF-α的浓度,对心肌组织中的单核巨噬细胞等炎性细胞有抑制作用,对由LPS引起的患有左心房功能减弱症的小鼠有保护作用,可以抑制心肌炎症。PNS还具有抗心律失常的作用,PNS可以缩短由BaCl2、CaCl2-Ach和乌头碱混合液所引起的大鼠心率失常的时间,减少房颤发生的次数,降低室性早搏的发生[34]。
三七为云南白药的主要成分。三七中的活血成分主要为三七总皂苷,可能通过促进由肾小管的上皮细胞分泌的尿激酶活性,促进纤维酶活性及纤维蛋白的水解过程,达到抗凝血的效果[34]。郑颖等[35]通过研究表明,PNS对过氧化物的产生、血小板的聚集、白细胞的黏附有一定的抑制作用,可以降低血液黏度,改善血液流动状态,达到活血的作用。赵玉珑[36]通过研究三七根、叶、花的主要皂苷成分的凝血酶原时间,发现三七皂苷通过延长凝血酶凝结时间及凝血酶原时间达到活血的效果,并且三七叶和花的抗凝血酶活性要高于三七根。三七的活血效果与剂量有直接关系,大剂量为活血效果,小剂量止血效果突出[35]。
三七素为三七中主要的止血成分。王珍等[37]研究发现三七素的注射量越大,大鼠凝血时间越短。三七素可以影响鼠体内的血小板聚集性、凝血因子、纤溶系统,并明显提高血小板活性成分(TXB2,6-keto-PGF1α)。三七通过诱导血小板释放Ca2+、血小板因子等凝血因子,提高环磷酸腺苷的代谢过程,促进体内凝血反应,从而起到止血的作用[38,39]。三七总皂苷有促进造血祖细胞增殖、促进GATA-1和GATA-2蛋白质合成、促进造血细胞的增殖分化的作用。郁相云等[38]通过给小鼠喂养三七悬浊液(蒸馏水的体积为三七粉末体积10倍)发现,小鼠体内的白细胞、红细胞与血红蛋白的数量有明显的上升。
3.4 抗肿瘤
三七主要通过提高机体免疫系统的方式达到抗肿瘤的效果。三七中含有的人参皂苷、微量元素等具有一定的抗癌能力,并有多靶点抗肿瘤的作用。人参皂苷Rb1为雌激素受体β的激动剂,可以促进色素上皮源性因子的蛋白质表达及分泌,进而起到对管状结构的抑制作用,抑制肿瘤生长时血管的生成[40]。实验发现,三七总皂苷对白细胞数量的提高有一定的促进作用,并且可以抑制特定肿瘤细胞的生长,诱导肿瘤细胞分化与凋亡,抑制肿瘤细胞的转移,促进细胞间通讯功能[40]。
3.5 免疫系统
三七中提高免疫系统的主要成分是三七多糖及PNS。研究表明,PNS对提高淋巴细胞、白细胞的数量和造血干细胞的增生有一定的促进作用[41]。PNS可以促进LPS和ConA的分泌,进而刺激小鼠B、T淋巴细胞的增殖[42]。经体外实验发现,三七多糖II有加强小鼠的脾淋巴细胞的转化增值作用,加速抗体产生过程,并且三七多糖IIb可以促进IL-2的分泌,进而提高小鼠的免疫能力[6,8,42]。
3.6 抗衰老、抗氧化及抗疲劳
PNS通过提高血清超氧化物歧话酶、过氧化氢酶及还原型谷胱甘肽的活性水平,达到清除自由基的作用[43]。三七活性成分可以缓解一定的体力疲劳。研究表明,小鼠连续喂养三七提取物30天后,小鼠的负重游泳时间明显增长,肝糖原含量明显增加,抑制运动时体内产生血清尿素氮,乳酸含量也有所降低,从而达到抗疲劳的功效[44]。
4 展望
本文主要对三七皂苷类物质、多糖类物质的提取工艺及其化学成分研究现状进行了概述,并归纳了三七主要活性物质的药理作用。目前对三七多糖的研究主要集中在三七根部,但关于三七叶、茎及花多糖的报道较少;工业化提取三七有效成分的方法仍为传统方法,这些方法对三七活性物质会造成极大的损失,其它高科技的提取方法没有得到广泛的运用;研究表明,三七中含有的活性成分与其它中药类活性物质配伍后药用效果明显增加[47]。因此,应加强三七多糖的研究、优化三七活性物质的提取工艺及完善三七总皂苷与其它药用成分配伍体系,将更有助于三七药材的开发与使用。
4.1 加强三七多糖的研究
通过对提取三七总皂苷后的药渣进行再提取,可以得到一定数量的多糖,这种方法成本比较廉价,可以最大化的提升中药材的使用价值。实验数据显示,提取三七总皂苷后的药渣具有高达3.8%的多糖,且多糖含量在50%以上[20]。三七叶中含有多糖含量约为20%,根中含45%,三七叶与根多糖结构基本一致,但三七叶可以多次采取,价格相对廉价[45]。对三七多糖的研究相对较为缓慢。因此,应加大对三七多糖的进一步研究,利用三七叶、花等部位及提取总皂苷后的药渣提取多糖,提高三七资源的利用率,形成完整的三七有效成分提取系统,以达到更为有效的利用和开发三七中药资源的目的。
4.2 优化三七活性物质的提取工艺
通过现代高科技技术对三七皂苷的分析,已分离了百余种三七单体皂苷。随着科技的不断发展,将有更多的新型三七单体皂苷被发现。目前可用于中药材活性物质的提取方法有很多,但工业化提取三七有效成分的方法仍为传统方法,如煎煮法、醇回流法等,这些方法虽投资较少、操作简易,但对三七活性物质会造成很大的损失。而其它高科技的提取方法,如超声波萃取法、大孔树脂吸附法、酶解法等,在工业生产中并没有得到广泛的运用。应当将高科技的提取方法运用于工业生产中,简便三七提取工艺,实现高科技技术的大规模工业化生产,形成工业上完整的三七总皂苷提取、纯化、分离体系,促进我国三七商业药物的发展。
4.3 完善三七总皂苷与其它药用成分配伍体系
三七中含有的大部分活性成分都有一定的药用价值,将其配伍后药用效果明显增加。例如,三七总皂苷与多糖都有一定的提高免疫力、抗癌症效果,并且研究发现三七总皂苷提取物中含有一定数量的多糖,若能对三七总皂苷与多糖的配伍效果进行进一步的研究,将提高三七整体的药用价值[20]。同时,应完善三七单体皂苷与其它中药药用成分配伍体系。三七皂苷与其它中药类活性物质配伍后,药用效果明显提高,例如某些三七单体皂苷与黄芪甲苷配伍后,对提高缺小鼠脑部血后能量代谢过程的促进作用远大于三七单体皂苷[46,47]。因此,对三七药用价值的研究不应限于三七单体皂苷的配伍或三七单体皂苷与其含有的药用物质的配伍使用,更应该探究三七与其它中药的配伍效果。应当了解三七及其他中药活性物质的药效机理,进行临床试验,分析药效结果,进一步改善有效药用成分的配伍比例或配伍组合。但中药成分及含量较为复杂,配伍后化学成分及药效更为复杂,应当完善中药配伍禁忌理论体系,完善中药药效机制研究,推动三七进入“高效低毒”的时代,将三七中药广泛引入世界。
1 国家药典委员会.中国药典(2010年版).北京:中国医药科技出版社,2010:11-12.
2 夏鹏国,张顺仓,梁宗锁,等.三七化学成分的研究历程和概况.中草药,2014,45(17):2564-2570.
3 张崇喜.人参、西洋参和三七化学成分的研究.长春:吉林农业大学博士学位论文,2004.
4 熊艺花,李婧,黄松,等.DNS法对三七总多糖含量测定.亚太传统医药,2011,7(7):7-9.
5 郑丽华,卢昌均,周志昆,等.HPLC测定三七总皂苷中5种皂苷的含量及稳定性考察.中医药临床杂志,2012,24(1):73-75.
6 盛卸晃,王建,郭建军,等.三七多糖的分离纯化及理化性质研究.中草药,2007,38(7):987-989.
7 宫德瀛,黄建,王红,等.三七花多糖的分离纯化及结构初步研究.天然产物研究与开发,2013,25(12):1676-1679.
8 王健.三七多糖的分离纯化及免疫活性的研究.杭州:浙江大学硕士学位论文,2001.
9 崔秀明,董婷霞,陈中坚,等.三七多糖成分的含量测定及其变化.中国药学杂志,2002,37(11):818-820.
10樊钰虎,史晓梅,陈前锋,等.三七提取工艺的筛选.安徽农业科学,2007,35(6):1792-1793.
11陈桥.三七活性成分的提取分离及丹参活性成分的提取工艺研究.上海:华东理工大学硕士学位论文,2011.
12赵孟春,段瑞旭,李宏安,等.中药提取方法研究进展.猪业科学,2007,24(2):32-38.
13谢茵,邢桂琴,刘秀芬.三七提取液中三七总皂苷的分离纯化工艺研究.山西医科大学学报,2006,37(6):613-616.
14 Shi S M,Liu Y Z,Tai W,et al.Smashing tissue extraction and HPLC determination of active saponins from different parts ofPanax notoginseng.CHM,2012,4(4):340-344.
15丁艳芬.三七皂苷提取分离关键技术工程研究.昆明:昆明理工大学硕士学位论文,2013.
16陈佳亮.大孔吸附树脂在中药分离纯化应用中影响因素研究.北京:北京工业大学硕士学位论文,2012.
17徐龙泉,彭黔荣,杨敏,等.膜分离技术在中药生产及研究中的应用进展.中成药,2013,35(9):1989-1994.
18陈彤,甘献文,张要武,等.超滤法纯化三七总皂苷的工艺研究.昆明医学院学报,2010,31(6):7-10.
19郭立玮.中药膜分离领域的科学与技术问题.膜科学与技术,2003,23(4):209-213.
20韦云川,王红,龙江兰.有效利用三七总皂苷提取后的药渣提取三七多糖.文山师范高等专科学校学报,2006,19(4):95-96.
21翁艳英,韦藤幼,童张法.内部沸腾法提取三七多糖的研究.时珍国医国药,2011,22(6):1435-1436.
22李江霞,丁艳芳,陈金东,等.三七渣中多糖超声提取工艺研究.中国现代中药,2013,15(2):131-134.
23王良贵,孙小梅,李步海.三七粗提液中皂甙与多糖泡沫分离的研究.分析科学学报,2003,19(3):267-269.
24李媛,李强,姜泽.三七中黄酮类成分的研究进展.齐鲁药事,2012,31(2):109-111.
25胡军霞,海春旭,梁欢.三七醇提物对大鼠肝组织体内抗氧化作用的研究.癌变∙畸形∙突变,2011,23(3):171-175.
26陈培丰,刘鲁明,陈震,等.三七醇提液对恶性肿瘤肝转移的干预作用.中西医结合学报,2006,4(5):500-503.
27马岩岩.三七皂甙成分对脂多糖诱导巨噬细胞炎性因子的影响极其机制的研究.广州:暨南大学硕士学位论文,2013.
28吴颖,孙冰,肖静,等.三七皂苷R1对LPS诱导的小鼠心肌损伤的保护作用.中国药理学通报,2013,29(2):179-184.
29黄小平,邓常清,邱咏园,等.黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血/再灌注后氧化应激和Nrf2/HO-1途径的影响.中国药理学通报,2013,29(11):1596-1601.
30陈忠伦,段劲峰,吴孝萍,等.三七通舒胶囊对血管性痴呆模型大鼠学习记忆的影响.华西药学杂志,2010,25(2):159-160.
31 Cicero A F,Bandieri E,Arletti R.Orally administered Panax notoginseng influence on rat spontaneous behavior.J Ethnopharmacol,2000,73(3):387-391.
32于俊民,鞠礼,王慧冬,等.三七皂苷R1对大鼠缺血心肌VEGF,bFGF的影响.现代生物医学进展,2014,14(30):5845-5848.
33黄胜英,谢世荣,黄彩云,等.三七叶皂甙抗心律失常作用的实验研究.大连大学学报,2001,22(6):82-84.
34黄小平,王蓓,邱咏园,等.黄芪甲苷和三七的主要有效成分配伍对小鼠缺血再灌注后脑组织能量代谢的影响.中草药,2014,45(2):220-226.
35郑颖,徐治国.人参与三七的药效学比较研究.中药药理与临床,2000,16(5):22-24.
36赵玉珑.不同来源三七的“谱-效”关系及其抗凝血有效成分的研究.咸阳:西北农林科技大学硕士学位论文,2013.
37王珍,杨靖亚,宋书杰,等.三七素对凝血功能的影响及止血机制.中国新药杂志,2014,23(3):356-359.
38郁相云,钟建华,张旭.中药三七对血液系统的药理活性研究.中国中医药现代远程教育,2010,8(12):249.
39任真真,张燕玲,王星,等.三七皂苷类成分的蛋白质相互作用网络分析.中国中药杂志,2014,39(11):2097-2101.
40 Leung K W,Cheung L W T,Pon Y L,et al.Ginsenoside Rb1 inhibits tube-like structure formation of endothelial cells by regulating pigment epithelium-derived factor through the oestrogen beta receptor.Brit J Clinton Pharmaco,2007,152(2):207-215.
41 Liu J,Wang S,Liu H,et al.Stimulatory effect of saponin fromPanax ginsengon immune function of lyphocytes in the Elderly.Mech Ageing Dev,1998,83(1):43-58.
42梁勇,秦枫,唐肖蕾.三七不同部位总皂苷溶血性及体外免疫活性研究.湖北农业科学,2011,50(23):4905-4907.
43屈泽强,谢智光,王乃平.三七总皂苷抗衰老作用的实验研究.广州中医药大学学报,2005,22(2):130-133.
44陈东方,李立,张聪恪,等.人参三七提取物抗疲劳作用的研究.安徽农业科学,2011,39(8):4536-4537.
45钟思恩,黄光球,陈金仙,等.三七叶多糖的提取分离及结构信息.中国实验方剂学杂志,2016,22(21):50-54.
46黄金兰.三七总皂苷对快速老化痴呆模型小鼠SAMP8大脑β淀粉样蛋白代谢通路影响的研究.南宁:广西医科大学博士学位论文,2013.
47 Zhong Z G,Qu Z Q,Wang N P,et al.Protective effects of Panax notoginseng sapoins on cholinergic neurons in rats with Alzheimer disease.Chinese J Clin Rehab,2006,10(19):174-176.
