鸭源大肠杆菌 Ⅰ 型菌毛的鉴定及FimA、FimH基因特征分析
2018-01-05黄书伦郑凯文李章程程方俊宋振辉周作勇刘国林林春发林永润张婷婷
黄书伦,郑凯文,胡 洋,李章程,程方俊,2,*,宋振辉,2,周作勇,2,刘国林,林春发,林永润,张婷婷
(1.西南大学 动物科学学院,重庆 402460;2. 重庆市兽医科学工程研究中心,重庆 402460)
鸭源大肠杆菌 Ⅰ 型菌毛的鉴定及FimA、FimH基因特征分析
黄书伦1,郑凯文1,胡 洋1,李章程1,程方俊1,2,*,宋振辉1,2,周作勇1,2,刘国林1,林春发1,林永润1,张婷婷1
(1.西南大学 动物科学学院,重庆 402460;2. 重庆市兽医科学工程研究中心,重庆 402460)
为了解川渝部分地区鸭源大肠埃希菌Ⅰ型菌毛产生情况及分子特征,采用MSHA/MRHA试验、PCR扩增Ⅰ型菌毛基因(FimA、FimH)进行菌毛类型鉴定;通过分析FimA氨基酸序列的亲水性、抗原性、表面可及性来预测抗原位点。MSHA/MRHA试验结果显示,MSHA检测阳性率为44.3%;PCR检测FimA阳性率为63.41%,FimH阳性率为100%。氨基酸序列比对结果显示:FimA氨基酸序列与比对株大肠埃希菌(ECOR61)相比,存在19个差异位点;FimH氨基酸序列与比对株(ECOR45)相比,仅少数菌株出现1~2个氨基酸位点差异,表明该片段高度保守。对FimA氨基酸序列进行抗原位点预测,结果显示,多数菌株抗原表位共同区域分布在84~88、142~146、149~150位氨基酸之间,除上述位点外,部分菌株在101~105、130~134位氨基酸出现抗原表位。
大肠埃希菌;Ⅰ型菌毛;氨基酸;序列比对;抗原表位
禽大肠埃希菌病(avian colibacillosis)是由禽致病性大肠埃希菌(avian pathogenicEscherichiacoli,APEC)引起的禽类急性、全身性肠外感染的一系列疾病的总称,临床上以心包炎、肝周炎、气囊炎、蜂窝织炎、败血症及输卵管炎、腹膜炎等为主要特征[1]。APEC是危害养禽业的主要病原微生物之一,给世界养禽业造成了巨大的经济损失,同时也是重要的食源性人畜共患病原菌[2-3]。禽大肠埃希菌菌毛主要有Ⅰ型菌毛和P型菌毛2种,Ⅰ型菌毛作为一种重要的毒力因子,在大肠埃希菌感染过程中可介导细菌与多种细胞的D-甘露糖受体特异性结合,使细菌黏附于消化道黏膜表面从而引起感染,而P型菌毛仅在细菌进一步致病过程中起作用[4]。致病性大肠埃希菌的菌毛具有良好的免疫原性[1],可诱导机体产生特异性抗体,可用于菌毛亚单位疫苗的制备。Ⅰ型菌毛由多个基因群编码,其中FimA基因是Ⅰ型菌毛主要结构亚单位基因,FimH基因可负责Ⅰ型菌毛甘露糖特性的表达和特殊黏附素受体的识别[5]。大肠埃希菌Ⅰ型菌毛的检测常用电子显微镜检查、甘露糖敏感血凝试验及甘露糖抵制血凝试验(MSHA/MRHA)、玻板凝集反应、酶联免疫吸附试验、核酸探针及PCR扩增等方法。目前,国内对鸭源大肠埃希菌Ⅰ型菌毛FimH基因的报道较少,尚未见重庆地区鸭源大肠埃希菌菌毛相关研究报道。
为了解重庆、四川地区禽大肠埃希菌Ⅰ型菌毛的产生情况及分子特征,本试验采用MSHA/MRHA及PCR扩增,对2005—2015年收集的重庆、四川部分地区鸭源大肠埃希菌分离株进行Ⅰ型菌毛鉴定,并通过FimA和FimH序列分析和FimA抗原位点预测,为鸭源大肠埃希菌的防控及亚单位疫苗的制备提供理论基础。
1 材料与方法
1.1 菌株及供试动物
70株鸭源大肠埃希菌菌株由西南大学动物科学学院鉴定保存。其中,2005—2015年从重庆多地区分离到42株,以YC N-n、RC N-n编号,四川地区分离到28株,以LC N-n编号;豚鼠购自重庆市中药研究院。
1.2 主要试剂
小剂量DNA提取试剂盒、DL 2 000 DNA Marker购自生工生物工程(上海)有限公司;PCR试剂盒购自宝生物工程(大连)有限公司;DNA回收试剂盒购自广州飞扬生化有限公司;D-甘露糖、改良Minka培养基、LB培养基、1%豚鼠红细胞悬液等。
1.3 引物及参考序列
FimA和FimH基因分别参考文献[6-7]设计引物,由生工生物工程(上海)有限公司合成。引物序列如下:FimA基因(预扩增长度315 bp)上游引物5’-AGTTAGGACAGGTTCGTACCGCAT-3’,下游引物5’-AAATAACGCGCCTGGAACGGAATG-3’;FimH基因(预扩增长度508 bp)上游引物5’-TGCAGAACGGATAAGCCGTGG-3’,下游引物5’-GCAGTCACCTGCCCTCCGGTA-3’。
1.4 MSHA/MRHA试验
将各菌株分别用改良Minka液体培养基37 ℃静置培养48 h,同样培养条件下连续传代3次,即为菌毛化菌体。细菌悬液浓度控制为约109cfu·mL-1,甘露糖敏感血凝试验及甘露糖抵制血凝试验(MSHA/MRHA)按文献[8]所述方法作适当调整。每株细菌进行3组平行实验。
1.5 FimA和FimH基因的PCR扩增
根据MSHA/MRHA试验结果,选取41株菌株经LB培养基培养后,用基因组提取试剂盒提取其基因组,作为扩增菌毛基因的模板。采用上述引物,分别对FimA和FimH基因进行PCR扩增。PCR反应体系为:上、下游引物(20 pmol·L-1)各0.5 μL,ddH2O 9.5 μL,模板2.0 μL,2×PremixExTaq12.5 μL,总体积25 μL。FimA基因PCR扩增反应条件:94 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 40 s,30个PCR循环;72 ℃ 10 min。FimH基因PCR扩增反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 35 s,30个循环;72 ℃ 10 min。
取PCR产物经1%琼脂糖凝胶电泳检测,观察结果。对目的片段进行回收与纯化,送生工生物工程(上海)有限公司测序。测序结果利用NCBI的Blast在线翻译成氨基酸序列后,采用软件MEGA 5.0进行比对,运用DNA Star Protean程序预测FimA的抗原表位。
2 结果与分析
2.1 MSHA/MRHA试验结果
70株鸭源大肠埃希菌MSHA/MRHA试验结果显示,有31株可以产生红细胞凝集现象且不能抵抗D-甘露糖的抑制作用,39株未出现红细胞凝集现象,空白对照组无自凝现象,部分结果见图1。表明31株菌毛化大肠埃希菌呈MSHA阳性,阳性率为44.3%,其中,重庆分离株阳性率为45.2%,四川分离株阳性率为42.9%。
2.2 FimA和FimH基因检测结果
共检测41株菌株,其中,26株菌株可扩增出与FimA基因片段大小相符的条带(约300 bp),PCR检测阳性率为63.41%,其中,重庆分离株阳性率为64%,四川地区分离株阳性率为62.5%;15株未扩增出目的片段,部分结果见图2。41株菌株均能扩增出与FimH基因片段大小相符的条带(约500 bp),阳性率为100%,部分结果见图3。
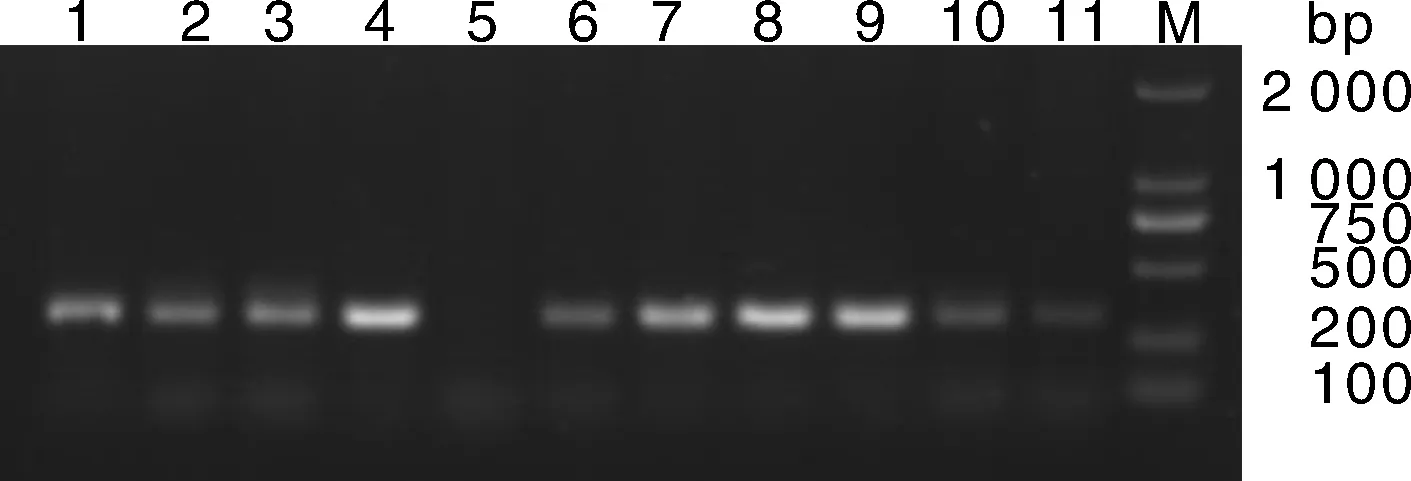
1, RC2-2; 2, LC4-2; 3, LC4-1; 4, LC2-4; 5, LC3-6; 6, RC2-1; 7, RC1-2; 8, LC2-3; 9, LC1-5; 10, YC1-2; 11, YC1-1; M, DL 2 000 DNA Marker图2 部分大肠埃希菌FimA基因PCR扩增结果Fig.2 PCR amplification results of FimA gene from some Escherichia coli strains

12, LC1-4; 13, LC3-5; 14, LC1-3; 15, LC4-2; 16, LC3-4; 17, LC3-3; 18, LC1-2; 19, LC1-1; 20, LC3-2; 21, LC3-1;M, DL 2 000 DNA Marker图3 部分大肠埃希菌FimH基因PCR扩增结果Fig.3 PCR amplification results of FimH gene from some Escherichia coli strains
2.3 FimA氨基酸序列比对
将26株鸭源大肠埃希菌和GenBank中的大肠埃希菌ECOR61(登录号为KC405511.1)的FimA基因核苷酸序列在线翻译成氨基酸序列后进行对比,结果显示,FimA基因编码97个氨基酸(FimA 65-161),与参考株相比,有19个氨基酸位点存在差异(表1)。
2.4 FimH氨基酸序列比对
将41株大肠埃希菌和GeneBank中的大肠埃希菌ECOR45(登录号为FJ865819.1)的FimH核苷酸序列在线翻译成氨基酸序列后进行比对,结果显示,所扩增条带可编码162个氨基酸(FimH 125-287),其中,仅RC3-4菌株180位点(R→H)、11株菌株在228位点(A→V)出现差异。由此推断,该FimH氨基酸片段高度保守。
2.5 FimA抗原位点
运用DNA Star Protean程序预测FimA氨基酸序列抗原表位,结果显示,多数菌株抗原表位区域主要分布在84~88、142~146、149~150位氨基酸(如LC1-1,图4)。除上述位点外,部分菌株在101~105位(如RC1-2,图5)、130~134(如RC1-3,图6)位氨基酸出现抗原表位。
表12005—2015年重庆、四川部分鸭源大肠埃希菌FimA氨基酸位点比对
Table1Comparison of FimA amino acid mutation sites inEscherichiacolifrom some ducks in Chongqing and Sichuan from 2005 to 2015

菌株编号StrainsNo.氨基酸残基位点Sitesofaminoacidresidue78879094100103104105106107121129132133135140142143144KC4055111NNSVAAGHTNNRAATTSSELC1⁃1--------------A----LC1⁃2--------------A----LC1⁃3--------------A----LC1⁃4--------------A----LC1⁃5--------------A----LC1⁃6--------------A----LC2⁃1-----------------EQLC2⁃2Y----V-------------LC2⁃3Y-------------A----LC2⁃4Y-------------A----RC1⁃1YTDI-GT-P-K---A--AQRC1⁃2-TDI-GT-P-K---A--AQRC1⁃3-ST--SA-PK--NE---AQRC1⁃4-ST--SA-PK--NE---AQRC1⁃5-ST--SA-PK--NE---AQRC2⁃1YD--TTN----K--AS-AQRC2⁃2-D--TTN----K--AS-AQRC2⁃3-D--TTN----K--AS-AQRC2⁃4-D--TTN----K--AS-AQRC2⁃5-D--TTN----K--AS-AQYC1⁃1-TT----R-D--N----AQYC1⁃2-TT----R-D--N----AQYC1⁃3-TT----R-D--N---MAQYC1⁃4-TT------D----A---KYC1⁃5-TT------D----A-I-KYC1⁃6-TT------D-K--A---Q

图4 LC1-1株FimA蛋白亲水性、抗原性、表面可及性Fig.4 Hydrophilicity plot, antigenic index, surface probability plot of FimA protein from LC1-1 strain
3 结论与讨论
大肠埃希菌在侵袭机体过程中,Ⅰ型菌毛对机体呼吸道的黏附起着重要作用,可介导细菌与多种细胞的D-甘露糖受体特异性结合,使细菌定居于黏膜表面从而引起感染,且这种特异性黏附能被D-甘露糖所抑制[9-11],因而可通过D-甘露糖敏感血凝特性(MSHA)试验对大肠埃希菌Ⅰ型菌毛进行初步的鉴定。本研究Ⅰ型菌毛鉴定中,MSHA阳性率为44.3%,四川地区报道185株鸭源致病性大肠埃希菌MSHA阳性率为65.9%,45株鸡源致病性大肠埃希菌MSHA阳性率为80%[12-13],表明不同地区、不同动物源的大肠埃希菌Ⅰ型菌毛的表达情况存在差异。FimA基因检测阳性率为63.41%,FimH基因阳性率为100%,两者阳性率均高于MSHA阳性率,同国内相关报道一致[12-14],说明传统的MSHA/MRHA试验适用于检测Ⅰ型菌毛的表达情况,即Ⅰ型菌毛表现型检测,而FimA及FimH基因的PCR扩增对Ⅰ型菌毛基因携带情况检测更具优越性,即基因型检测。本试验中部分菌株检测出Fim基因却未表现MSHA阳性,即Ⅰ型菌毛未表达,研究表明Fim基因在表达过程中受到基因以外诸多因素的调控,推测外界环境影响了Ⅰ型菌毛的表达[15]。MSHA/MRHA试验和PCR方法各有优劣,在Ⅰ型菌毛鉴定过程中,应根据实际情况采取不同方法或多种方法结合的方式进行。FimA和FimH基因检测阳性率的差异以及Ⅰ型菌毛表达的影响因素还有待进一步研究。

图5 RC1-2株FimA蛋白亲水性、抗原性、表面可及性Fig.5 Hydrophilicity plot, antigenic index, surface probability plot of FimA protein from RC1-2 strain
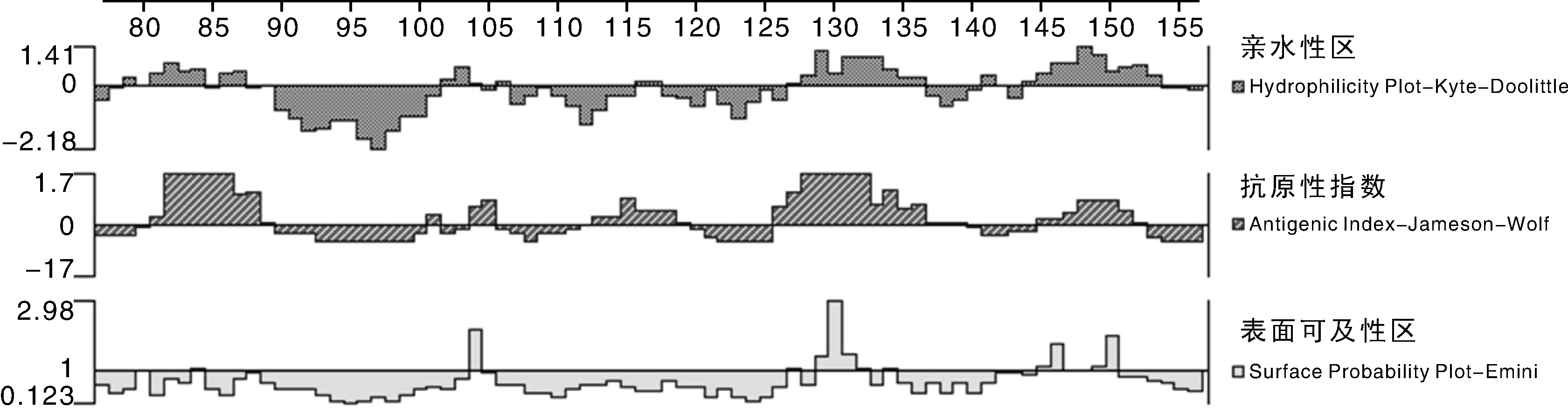
图6 RC1-3菌株FimA蛋白亲水性、抗原性、表面可及性Fig.6 Hydrophilicity plot, antigenic index, surface probability plot of FimA protein from RC1-3 strain
试验株与参考株FimA共有19个氨基酸位点差异,说明川渝地区鸭源大肠埃希菌Ⅰ型菌毛FimA在进化过程中存在不同程度的变异,部分菌株差异较大,氨基酸位点的差异对Ⅰ型菌毛具体功能的影响还有待进一步研究。本试验结果显示,多数菌株抗原表位共同区域分布在84~88、142~146、149~150位氨基酸,少数菌株在101~105、130~134位,说明川渝地区鸭源大肠埃希菌抗原表位存在变异。叶如俊等[16]报道,8株鸡源致病性大肠埃希菌Ⅰ型菌毛蛋白在1~4、49~53、82~91、126~132、145~150位氨基酸有较高抗原性,本试验结果与此大致相同,说明不同禽源大肠埃希菌一定程度上具有相同的抗原位点。致病性大肠埃希菌的Ⅰ型菌毛具有良好的免疫原性,虽然多数分离株具有相似的抗原位点,但在实际生产中,由于不同菌株Ⅰ型菌毛抗原位点的差异会影响亚单位疫苗的实际免疫效果。本试验发现川渝部分菌株Ⅰ型菌毛的抗原表位存在差异,因此,在利用Ⅰ型菌毛制备亚单位疫苗时,应充分考虑此因素,建议制备多价亚单位疫苗以增强临床免疫效果。
[1] 马兴树. 禽大肠杆菌病疫苗研究进展[J]. 中国畜牧兽医, 2015, 42(1): 234-244.
MA X S. Research progress on vaccines of avian colibacillosis[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2015, 42(1): 234-244. (in Chinese with English abstract)
[2] TIVENDALE K A, LOGUE C M, KARIYAWASAM S, et al. Avian pathogenicEscherichiacoliare similar to neonatal meningitisE.colistrains and are able to cause meningitis in the rat model of human disease[J].InfectionandImmunity, 2010, 78 (8): 3412-3419.
[3] DZIVA F, STEVENS M P. Colibacillosis in poultry: unraveling the molecular basis of virulence of avian pathogenicEscherichiacoliin their natural hosts[J].AvianPathology, 2008, 37(4): 355-366.
[4] DOZOIS CM, CHANTELOUP N, DHO-MOULIN M, et al. Bacterial colonization andinvivoexpression of F1 (type 1) fimbrial antigens in chickens experimentally infected with pathogenicEscherichiacoli[J].Aviandiseases, 1994,38(2): 231-239.
[5] KROGFELT K A, BERGMANS H, KLEMM P. Direct evidence that the FimH protein is the mannose-specific ofEscherichiacolitype 1 fimbriae[J].InfectionandImmunity, 1990, 58(6): 1995-1998.
[6] HERNANDES R T, VELSKO I, SAMPAIO S C, et al. Fimbrial adhesins produced by atypical enteropathogenicEscherichiacolistrains[J].AppliedandEnvironmentalMicrobiology, 2011, 77(23): 8391-8399.
[7] CHAPMAN T A, WU X Y, BARCHIA I, et al. Comparison of virulence gene profiles ofEscherichiacolistrains isolated from healthy and diarrheic swine[J].AppliedandEnvironmentalMicrobiology, 2006, 72(7): 4782-4795.
[8] JOHNSON J R, SWANSON J L, BARELA T J, et al. Receptor specificities of variant Gal(alphal-4) Gal-binding PapG adhesins of uropathogenicEscherichiacolias assessed by hemagglutination phenotypes[J].TheJournalofInfectiousDiseases, 1997, 175(2): 373-381.
[9] MALAVIYA R, IKEDA T, ROSS E, et al. Mast cell modulation of neutrophil influx and bacterial clearance at sites of infection through TNF-alpha[J].Nature, 1996, 381: 77-80.
[10] MUNDI H, BJÖRKSTÉN B, SVANBORG C, et al. Extracellular release of reactive oxygen species from human neutrophils upon interaction withEscherichiacolistrains causing renal scarring[J].InfectionandImmunity, 1991, 59(11): 4168-4172.
[11] STEADMAN R, TOPLEY N, JENNER D E, et al. Type 1 fimbriateEscherichiacolistimulates a unique pattern of degranulation by human polymorphonuclear leukocytes[J].InfectionandImmunity, 1988, 56(4): 815-822.
[12] 于小娜. 鸭源致病性大肠杆菌Ⅰ型菌毛pilA基因序列分析与原核表达产物免疫原性研究[D]. 雅安: 四川农业大学, 2006.
YU X N. The sequence analysis and research in immunogenicity of the prokaryotic expression product ofpilAgene of pathogenicE.coliisolated from ducks[D]. Ya’an: Sichuan Agriculture University, 2006. (in Chinese with English abstract)
[13] 叶如俊. 鸡源致病性大肠杆菌1型菌毛pilA基因的PCR克隆及序列分析[D]. 雅安: 四川农业大学, 2002.
YE R J. The PCR and sequence analyse ofpilAgene of type 1 pili of pathogenicEscherichiacoliisolated from chick[D]. Ya’an: Sichuan Agriculture University, 2002. (in Chinese with English abstract)
[14] 王剑飞.fimH基因对尿路致病性大肠埃希菌1型菌毛粘附功能影响的初步探索[D]. 天津: 天津医科大学, 2014.
WANG J F. Primary exploration on the role offimHgene in uropathogenicEscherichiacoliType 1 fimbriae adhesion[D]. Tianjin: Tianjin Medical University, 2014. (in Chinese with English abstract)
[15] WITHMAN B, GUNASEKERA T S, BEESETTY P, et al. Transcriptional responses of uropathogenicEscherichiacolito increased environmental osmolality caused by salt or urea[J].InfectionandImmunity, 2013, 81(1): 80-89.
[16] 叶如俊, 王红宁, 谭丙乾.鸡源致病性大肠杆菌1型菌毛pilA基因的PCR扩增克隆及序列分析[J]. 畜牧兽医学报, 2004, 35(1): 83-88.
YE R J, WANG H N, TAN B Q. The PCR and sequence analyse ofpilAgene of type 1 pili of pathogenicEscherichiaColiisolated from chick[J].ActaVeterinariaetZootechnicaSinica, 2004, 35(1): 83-88. (in Chinese with English abstract)
IdentificationoftypeⅠfimbriaeofEscherichiacoliisolatedfromducksandgeneticcharacteristicsoftheirFimAandFimHgenes
HUANG Shulun1, ZHENG Kaiwen1, HU Yang1, LI Zhangcheng1, CHENG Fangjun1,2,*, SONG Zhenhui1,2, ZHOU Zuoyong1,2, LIU Guolin1, LIN Chunfa1, LIN Yongrun1, ZHANG Tingting1
(1.CollegeofAnimalScience,SouthwestUniversity,Chongqing402460,China; 2.VeterinaryScienceEngineeringResearchCenterofChongqing,Chongqing402460,China)
To study the generation and molecular characteristics ofEscherichiacolitypeⅠfimbriae from ducks in parts of Sichuan-Chongqing region, the typeⅠfimbriae was identified by MSHA/MRHA test, and theirFimAandFimHgenes were identified by PCR amplification; The hydrophilicity, antigenicity, and surface probability of FimA amino acid sequences were analyzed by DNAStar to predict antigenic sites. The MSHA/MRHA test results showed that the positive rate of MSHA was 44.3%. PCR results indicated that the positive rate ofFimAandFimHwere 63.41% and 100%, respectively. Amino acid sequences of FimA and FimH were deduced and contrasted respectively with comparativeEscherichiacolistrain ECOR61 and ECOR45. Amino acid sequence alignment showed that there were 19 different positions in FimA amino acid sequences. However, there were 1-2 different positions in FimH amino acid sequences, it was believed that FimH amino acid sequences were highly conserved. The antigenic sites of FimA amino acid sequences were predicted. The results indicated that antigenic epitopes of most strains were distributed in 84-88, 142-146 and 149-150 amino acids. In addition, some other strains’ antigenic epitopes appeared at 101-105 and 130-134 amino acids.
Escherichiacoli; typeⅠfimbriae; amino acid; sequence alignment; antigenic epitope
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(12): 1994-1999
http://www.zjnyxb.cn
黄书伦,郑凯文,胡洋, 等. 鸭源大肠杆菌Ⅰ型菌毛的鉴定及FimA、FimH基因特征分析[J]. 浙江农业学报, 2017, 29(12): 1994-1999.
10.3969/j.issn.1004-1524.2017.12.06
2017-05-15
重庆市社会事业与民生保障科技创新专项(CSTC2015SHMSZX80020);重庆市前沿与应用基础研究(cstc2016jcyA0235);中央高校基本科研业务费(XDJK2017D083)
黄书伦(1994—),男,福建南安人,动物医学专业本科生。E-mail: 572974812@qq.com
*通信作者,程方俊,E-mail: cfj-xn@163.com
S855.3
A
1004-1524(2017)12-1994-06
(责任编辑侯春晓)
