一株具有抑菌活性的酸枣内生菌的分离
2018-01-05邓振山魏婷婷刘玉珍陈邦凯莫达锐许红霞
邓振山,魏婷婷,苏 瑞,高 飞,刘玉珍,陈邦凯,莫达锐,何 茜,许红霞
(延安大学 生命科学学院,陕西 延安 716000)
一株具有抑菌活性的酸枣内生菌的分离
邓振山,魏婷婷,苏 瑞,高 飞,刘玉珍,陈邦凯,莫达锐,何 茜,许红霞
(延安大学 生命科学学院,陕西 延安 716000)
采用组织分离法和研磨涂布法筛菌以及对峙培养法进行抑菌试验,C-22-1菌株的发酵液经过反复萃取分离得到有抗菌活性的物质,以抑菌圈大小为指标对C-22-1菌株发酵条件中的碳源、氮源和发酵时间进行单因素优化。C-22-1菌株发酵液及其活性物质对7种人体常见致病菌抑菌活性测定显示,C-22-1菌株发酵液对白色葡萄球菌(Staphylococcusalbus)的抑菌圈直径达29 mm,定性试验显示菌株C-22-1产皂苷类物质,单因素优化结果表明,菌株C-22-1的最佳碳源、氮源、时间分别是葡萄糖、酵母膏、8 d。初步确定C-22-1菌株可产抗菌活性物质为三萜皂苷。
陕北酸枣;内生菌;组织分离法;研磨涂布法;抑菌活性
植物体内普遍存在着内生菌,植物内生菌(endophyte)是指整个生活史或者是生活史中的某一阶段能够定殖在宿主植物健康细胞内或者细胞之间,却不对其宿主产生病害症状的微生物[1-2],可寄存在植物的根、茎、叶、花、果实及种子中。近年来,颜华等[3]、郑艳等[4]、刘莹等[5]、刘胜贵等[6]众多学者从经济林木、药用植物、杂草等植物中分离到大量的内生菌,2010年黄海东等[7]从云雾龙胆中分离得到一株内生细菌,它的发酵液对金黄色葡萄球菌和大肠埃希菌有抑菌效果。
酸枣[ZiziphusjujubaMill. var.spinosa(Bunge)Hu ex H.F.Chow.]为鼠李科,广泛分布于我国中、北部地区,抗逆性强,是一种耐旱、耐寒、耐盐碱的野生药用植物。酸枣素有“天然维生素丸”之称,此外酸枣还具有养心安神、补肝、敛汗的功效,主治心烦失眠、惊悸怔忡、体虚多汗、神经衰弱、多梦、汗少口干等症状。孙延芳等[8]发现酸枣中有酒石酸、柠檬酸、草酸等,有学者发现酸枣果肉中含有多种三萜类化合物[9-10]如蛇滕酸、麦珠子酸等。王向红等[11]分析发现多种枣中的齐墩果酸和熊果酸的含量均显著低于酸枣。
酸枣中有很多活性物质,1997年,首次从酸枣仁中分离得到黄酮类化合物[12],曾路等[13]分离得到了斯皮诺素和酸枣黄素两种黄酮类物质以及酸枣仁皂苷A、B(jujubosides A、B)。有研究表明,酸枣仁中的黄酮类化合物还有药黄素[14]、当药素(swertisin)、异斯皮诺素(isospinosin)、6″-对香豆酰斯皮诺素(6″-p-coumaroylspinsin)[15]、异牡荆素(isovitexin)[16]、槲皮素(quercetin)[17]。酸枣仁中含有的皂苷类物质有酸枣仁皂苷A1、B1、C[18]、D[19],羽扇环烷型三萜类化合物有罗珠子酸甲酯。
目前对酸枣的研究也很多,但对酸枣内生菌的研究较少,目前仅刘东[20]、高振峰等[21]分别从山西酸枣体内分离获得76株内生细菌和40株内生真菌,但有关陕北酸枣内生菌的研究鲜有报道。鉴于此,本研究从陕北酸枣叶片筛选内生菌,通过生物活性测定的方法选出有抑菌作用的菌株,并对其内生菌的次生代谢产物进行初步研究。
1 材料与方法
1.1 材料
1.1.1 材料的采集
酸枣[ZizyphusjujubaMill.var.spinosa(Bunge)Hu]植株于2015年5月采自延安大学后山、延安凤凰山(不带根),采样后立即带回实验室供当天试验使用,剩余的叶片置于4 ℃冰箱备用。
1.1.2 指示菌株
指示菌株均来于延安大学医学院,由延安大学生命科学学院微生物实验室保藏,指示菌编号见表1。
1.1.3 培养基
筛选培养基:(1)PDA培养基;(2)牛肉膏培养基;(3)高氏培养基;(4)改良培养基1:叶片煮沸滤液1 000 g、NaCl 5 g、蔗糖10 g、琼脂18 g、pH 自然;(5)改良培养基2∶NaCl 1 g、CaCl20.5 g、K2HPO40.5 g、FeCl30.02 g、(NH4)2SO41 g、MgSO4· 7H2O 1 g,蒸馏水1 000 mL、pH 7.0~7.2;
发酵培养基:马铃薯200 g、葡萄糖20 g、蛋白胨10 g 、NaCl 5 g、MgSO45 g、K2HPO41 g、蒸馏水1 000 mL、pH自然;
优化培养基:(1)碳源筛选用基础培养基(g·L-1):各种碳源3 g、蛋白胨10 g、K2HPO43 g、MgSO4· 7H2O 1 g,蒸馏水1 000 mL、pH自然。(2)氮源筛选用基础培养基(g·L-1):葡萄糖3 g、各种氮源10 g、K2HPO43 g、MgSO4· 7H2O 1 g,蒸馏水1 000 mL、pH自然。
1.2 方法
表1指示菌株编号
Table1Indicator strain number

菌株编号No.ofstrains指示菌株IndicatorstrainP⁃1大肠埃希菌(Escherichiacoli)P⁃2伤寒杆菌(Salmonellatyphi)P⁃3柠檬色葡萄球菌(Staphylococcuscitreus)P⁃4福氏痢疾杆菌(Shigellaflexneri)P⁃5白色念球菌(Moniliaalbican)P⁃6金黄色葡萄球菌(Staphylococcusaureus)P⁃7白色葡萄球菌(Staphylococcusalbus)
1.2.1 酸枣叶片内生菌的筛选

1.2.2 内生菌抑菌活性测定
挑取备用斜面上的菌种复壮,无菌条件下取直径为10 mm的复壮菌株的菌饼3~5个,接种于已灭菌的PDA液体培养基中,置于32 ℃恒温振荡培养器中以160 r·min-1培养18~24 h。无菌条件下,用无菌棉签将致病菌株涂满牛肉膏固体培养基,接着用直径10 mm的无菌打孔器在涂满致病菌的培养基上打孔并注入内生菌发酵液,对照组在孔中注入无菌水,试验组设置3个重复,置于32 ℃恒温培养箱培养2~4 d后观察并测量抑菌圈直径。发酵产物抑菌活性测定参考文献[22]。
1.2.3 菌种鉴定
生理生化鉴定:筛选的内生菌菌株进行革兰氏染色、甲基红测定、V-P 测定、淀粉水解、吲哚产生和柠檬酸利用检测试验,试验测定方法及初步鉴定方法参考《常见细菌系统鉴定手册》[23]。
16S rRNA鉴定:采用菌落PCR[24]方法扩增菌株C-22-1的16S rDNA,采用基因保守序列通用引物,P1(5’-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3’)和P6(5’-CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3’)进行 PCR扩增,50 μL 反应体系:2×EsTaqMasterase 25 μL,上下游引物各 1 μL(10 μmol·L-1),模板DNA 1 μL,无菌双蒸水补足至反应总体积50 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃终延伸7 min;4 ℃保存。获得的 16S r RNA 基因序列提交到NCBI的GenBank基因库,进行BLAST比对,与数据库中的已知序列进行同源性分析,运用MEGA 6.06软件生成NJ进化树。
1.2.4 代谢产物的分离提取
将菌株C-22-1扩大培养,无菌条件下,取直径1 mm的内生菌菌饼4~5个,接种于含200 mL的发酵液培养基中,接种25瓶,置于32 °C、160 r·min-1摇床中振荡培养7 d。将发酵液离心去菌体,收集并浓缩菌液,将5 L的发酵液浓缩至300 mL。浓缩后的发酵液与70%乙醇按体积比1∶9混合后浸泡2 h,40 °C超声处理10 min,收集液体,浓缩,用正丁醇进行萃取,浓缩,再用正丁醇反复萃取2次,收集液体并用砂芯过滤装置过滤,最后进行浓缩并收集。
1.2.5 C-22-1发酵产物的定性试验
在研究C-22-1菌株所产皂苷的生物活性之前,首先通过皂苷的通性进行定性试验,确定C-22-1菌株发酵产物的总皂苷中含有皂苷类物质,从而对其进行下一步研究。泡沫试验、浓硫酸-乙酸反应、氯仿-浓硫酸反应、香草醛-高氯酸反应参考邵青[25]的方法进行定性试验。
HPLC检测:甲醇分别溶解标准品、样品于容量瓶中备用。
皂苷检测:色谱柱为Kromasil C18(5 μm,4.6 mm×150 mm);流动相:V(甲醇)∶V(0.2%磷酸)=50∶50;流速0.8 mL·min-1;检测波长210 nm;柱温25 °C;进样量10 μL。
1.2.6 菌株发酵条件优化
单因素试验:菌株C-22-1分别接种于以葡萄糖、甘露醇、蔗糖、麦芽糖、淀粉为碳源的液体培养基和以蛋白胨、酵母膏、硝酸钠、硫酸铵、硝酸铵为氮源的液体培养基中,在32 °C,恒温振荡培养器中以160 r·min-1的转速培养4 d后取出备用。以金黄色葡萄球菌(Staphylococcusaureus)为指示菌,参照1.2.2节的方法进行抑菌活性测定,设置3重复。选出最佳碳源、氮源的培养基为发酵培养基,发酵时间按5、6、7、8、9 d,参照1.2.2节进行试验。
响应面试验设计:为了优化发酵条件,在单因素试验的基础上,采用Design-Expert试验设计软件对菌株C-22-1的发酵条件进行优化,以对金黄色葡萄球菌的抑菌圈大小为响应值(Y),对碳、氮源和发酵时间3个因素设计3因素3水平的Box-Behnken中心组合试验因素与水平(表2)。
表2响应面设计表
Table2Response surface design
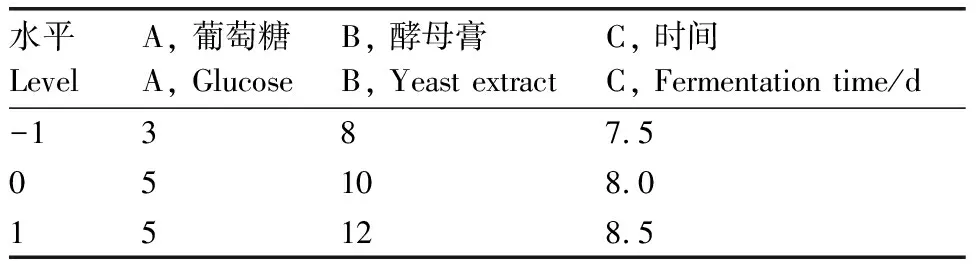
水平LevelA,葡萄糖A,GlucoseB,酵母膏B,YeastextractC,时间C,Fermentationtime/d-13875051080151285
2 结果与分析
2.1 酸枣内生菌的筛选
采用组织分离法和研磨涂布法从酸枣叶片组织中共分离得到23株内生菌,编号为C-01-1至C-23-1,C-22-1的发酵液的抑菌效果好,对7种人体常见致病菌均有抑制作用,除对白色念球菌(Moniliaalbican)的抑菌圈直径为12 mm外,对其他病原菌的抑菌圈直径均大于16 mm,抑菌活性强,所以选择其作进一步研究。
2.2 酸枣内生菌发酵液抑菌活性测定及产物抑菌活性测定
对所分离的内生菌的抑菌活性进行初步筛选,其中菌株C-22-1对7种人体常见致病菌的抑制效果均较好(表3),因此选择其进行后续试验。同时发酵产物对人体常见致病菌的抑菌活性测定结果(图1)显示,4号致病菌(福氏痢疾杆菌Shigellaflexneri)的最低抑制浓度最小,对其抑制效果最好。
2.3 菌株鉴定
菌株C-22-1的菌落特征是表面粗糙,扁平,菌落不规则,菌株C-22-1的细胞呈直杆状,菌落圆形,乳白色,边缘整齐,光滑;菌株C-22-1的V.P、柠檬酸盐反应均为阴性,产生吲哚、能水解淀粉,甲基红试验显阳性。菌株C-22-1的16S rDNA序列(GenBank登录号KY393358)与NCBI数据库进行比对分析,与其同源性较高的菌株均属于芽孢杆菌属,通过构建的系统发育树聚类分析可以看出,菌株C-22-1与BacillusgaemokensisKCTC 13318 (登录号LTAQ01000012)属于同一分支即它们有可能为同一类群(图2)。综合形态、结构、生理生化特征和同源性分析,菌株C-22-1为蜡状芽孢杆菌。
表3C-22-1对7种致病菌的抑制直径
Table3Inhibitory effect of C-22-1 on 7 kinds of pathogenic bacteria in diameter

病原菌株Pathogen抑菌圈直径/mmAntibioticcirclediameter/mmP⁃12433±1155abABP⁃22133±1527bBCP⁃32300±2bABP⁃42433±4932abABP⁃51367±2,887cCP⁃62400±4582abABP⁃72933±3055aA
同列数据后标有不同小写字母者表示差异显著(P<0.05),标有不同大写字母者表示差异极显著(P<0.01)。
Different from the column data is marked with a lowercase letter, the difference was significant (P<0.05), marked with a different capital letters, the differences were extremely significant (P<0.01).

1,大肠埃希菌(Escherichia coli);2,伤寒杆菌 (Salmonella typhi);3,柠檬色葡萄球菌(Staphylococcus citreus);4,福氏痢疾杆菌 (Shigella flexneri);5,白色念球菌(Monilia albican)图1 C-22-1产物对5种致病菌的抑制直径Fig.1 Inhibitory effect of C-22-1 on 5 kinds of pathogenic bacteria in diameter

图2 菌株C-22-1的16S rDNA基因系统发育树Fig.2 Phylogenntic tree of strain C-22-1 based on 16S rDNA gene sequence
2.4 C-22-1发酵产物的定性试验结果
(1)泡沫试验:样品产生了肥皂样泡沫,且15 min后泡沫仍未消失,空白对照处理虽然也出现泡沫,但量极少且在30 s内消失,此结果也可以初步说明C-22-1粗皂苷样品中可能含有皂苷。
(2)浓硫酸-乙酸反应:试管内显示红色,并未出现污绿色,说明样品中含有三萜皂苷。
(3)氯仿-浓硫酸反应:试验结果显示溶液出现分层,在氯仿层颜色为浅红色,硫酸层出现绿色的荧光。空白对照试验则无此色泽变化。
(4)香草醛-高氯酸反应:试管溶液最终显示红色。香草醛-高氯酸反应是皂苷类物质的显色方法,高氯酸的酸性极强,可与皂苷发生氧化反应使其脱氢,再与香草醛作用继而形成特征性的红色。
(5)HPLC检测:由图3-a-可以发现,标准品的出峰时间大约在3.762 min,受样品中杂质等干扰的影响,两个图谱存在一定的差别,但两图谱就总体对比而言,C-22-1正丁醇部位的样品的出峰时间和柴胡皂苷A标准品的出峰时间大致相同(图3-b),因此可以初步判定C-22-1正丁醇部位提取的样品中含有皂苷类物质。
2.5 发酵培养条件优化
由图4-a可知,菌株C-22-1以葡萄糖为碳源时抑菌圈最大,故最优碳源选为葡萄糖;由图4-b可以看出,菌株C-22-1以酵母膏为氮源时抑菌圈最大,因此最佳氮源为酵母膏;由图4-c可知,菌株C-22-1在发酵前8 d抑菌圈也呈上升趋势,第9天开始下降,因此最佳发酵时间为8 d。
回归模型P<0.01表明,回归模型极显著;失拟项P=0.392,不显著,说明该模型成立,回归模型中一次项A、二次项A2、B2、C2以及AC的交互作用对金黄色葡萄球菌的抑菌圈的影响极显著(P<0.01)。
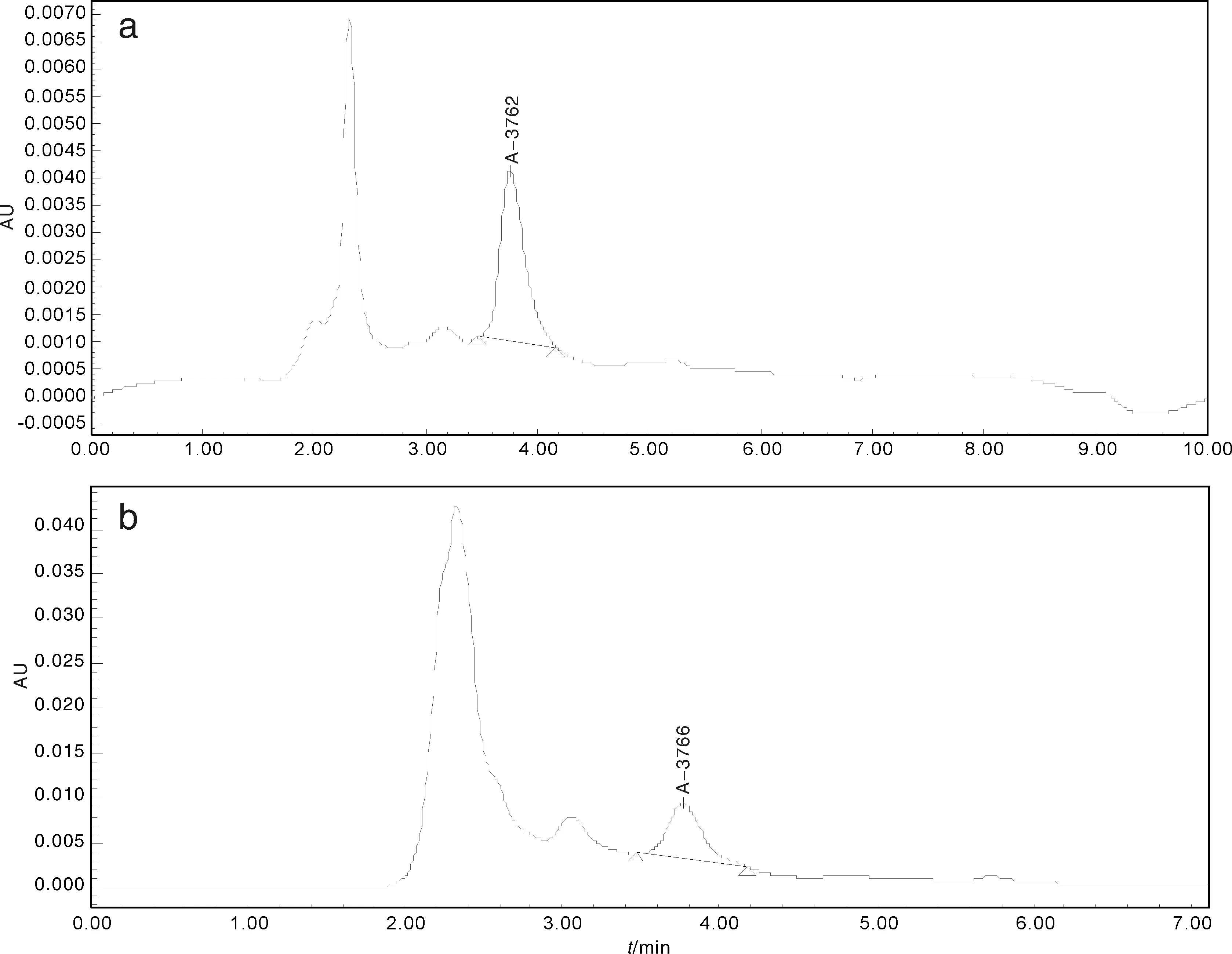
a, 柴胡皂苷A标准品的HPLC色谱图;b, C-22-1正丁醇部位提取的样品的HPLC色谱图a, Saiko saponin A standard HPLC chromatogram;b, C-22-1 N-butanol extraction HPLC chromatogram of the sample图3 HPLC色谱图Fig.3 High performance liquid chromatography (HPLC) figure



图4 不同碳源、氮源、时间对菌株C-22-1抑菌活性的影响Fig.4 Effect of different carbon source, nitrogen source and time on antibacterial activity of strain C-22-1
响应曲面能直观地反映出各因素交互作用对响应值的影响,交互作用不显著时,表现为曲线较为平滑,近似圆形,交互作用极显著时表现为曲线较陡,接近椭圆形。由图5可以看出,A和B、C和D的交互作用不显著,A和C的交互作用显著,与表4结果基本一致。
利用Design-Expert 8.06软件得出菌株C-22-1的最佳发酵条件为葡萄糖4.28 g·L-1,酵母膏10.12 g·L-1,发酵时间8.01 d,考虑到实际操作,将最佳发酵条件设定为葡萄糖4.30 g·L-1,酵母膏10 g·L-1,发酵时间8 d。
3 讨论
从菌株C-22-1发酵液及活性物质抑菌试验结果显示其对人体一些常见致病菌的抑制效果很明显,可以为药物制备提供种质资源。有研究者从酸枣植株中分离提取出黄酮类、皂苷类化合物[26],菌株C-22-1可以产生皂苷类化合物,这可能与内生菌与宿主植物长期共生的协同演化有关。尽管初步鉴定了两株菌代谢产物均含有黄酮、皂苷类化合物,但还需要进一步对其代谢产物分离纯化。从HPLC图中可看出样品中杂质较多,纯度低,需要借助紫外光谱、质谱、红外光谱、核磁共振等技术手段进行结构分析。
植物内生菌可在离体培养的条件下,采用发酵获得大量活性物质[27],从而解决某些药用植物资源紧缺、生长缓慢和生态破坏等问题。本试验发现,酸枣内生菌可合成多种活性物质,具有广谱的抗菌作用。本试验采用组织分离法和研磨涂布法从陕北酸枣叶片中筛选内生菌共23株,包括20株内生细菌,内生细菌占总数的86.96%,初步证实酸枣叶片中内生菌种类丰富。经测定得到10株有抑菌活性的菌株,占分离总数的43.48%。其中菌株C-22-1对七种病原菌以及与几种常用抗生素相比,C-22-1发酵液均具有较强的抑菌效果,所以选其进行更多的研究。本试验还对菌株C-22-1发酵的主要影响因素碳源、氮源以及发酵时间进行单因素优化分析,明确碳源、氮源和时间对菌株抑菌活性的影响,以及得出最佳发酵条件。
表4回归模型方差分析
Table4Regression model variance analysis

变异源Source平方和SS自由度df均方MSF值FvalueP值Pvalue显著性Significance模型Model151099117691678879085168007914100006SignificantA⁃葡萄糖231125123112524909545800016∗∗B⁃酵母膏0101251010125109122401803309C⁃时间040510405436489607400751AB00025100025002694380308743AC0811081872979214800013∗∗BC0091009096997690503575A^21413918421114139184211523853572<00001∗∗B^2692551692557463972286<00001∗∗C^2210760526312107605263227147603400020∗∗残差Residual0649570092785714失拟项Lackoffit025753008583333308758503405244notsignificant纯误差Pureerror039240098总误差Cortotal298211764716
表5方差分析其他参考项
Table5Other variance analysis references

参考项Referenceitems数值Value参考项Referenceitems数值Value标准偏差Std.Dev.0304607476R⁃Squared0978220175Mean2954117647AdjR⁃Squared0950217543C.V.%1031128452PredR⁃Squared0841304048PRESS47325AdeqPrecision162226991



图5 葡萄糖、酵母膏和发酵时间对金黄色葡萄球菌的抑菌圈的响应曲面Fig.5 Response surface of glucose, yeast extract and fermentation time
从酸枣叶片中筛选出的菌株C-22-1的生理生化反应以及16S rRNA的结果与Jung等[28]从潮滩沉积物中筛出来的菌株BL3-6的结果一致,结果显示,该菌株为蜡状芽孢杆菌,可以降解石油。
[1] 张新国, 唐鹏, 刘英娟, 等. 6 种药用植物内生菌提取物的抗氧化活性研究[J]. 现代食品科技, 2016, 32(4): 86-74.
ZHANG X G, TANG P, LIU Y J, et al. Antioxidant activity of endophyte Extracts isolated from six medicinal plants[J].ModernFoodScienceandTechnology, 2016, 32(4): 86-74.(in Chinese with English abstract)
[2] 赵龙飞, 徐亚军, 彭丁华,等.稻瘟病菌拮抗性大豆根瘤内生细菌的筛选及抑制效果[J]. 微生物学通报, 2016,43(5): 998-1008.
ZHAO L F, XU Y J, PENG D H, et al. Screening and inhibitory effect of antagonistic endophytic bacteria associated with soybean root nodules againstMagnaporthegrisea[J].JournalofMicrobiology, 2016,43(5): 998-1008. (in Chinese with English abstract)
[3] 颜华, 何姣, 李素俭, 等. 丹参植株内生菌的分离纯化及其抗病性研究[J]. 西北植物学报, 2016, 36(9): 1813-1818.
YAN H, HE J, LI S J, et al. Isolation and anti-microbial activity of endophytes fromSalviamiltiorrhiza[J].AciaBotanicaBoreali-OccidentaliaSinica,2016, 36(9): 1813-1818. (in Chinese with English abstract)
[4] 郑艳, 戴婧婧, 管玉鑫, 等. 凤丹内生菌的分离鉴定及抑菌活性研究[J]. 中国中药杂志, 2016, 41(1): 45-50.
ZHENG Y, DAI J J, GUAN Y X, et al. Isolation, identification and inhibition activity of endophytes in Fengdan[J].ChinaJournalofChineseMateriaMedica, 2016, 41(1): 45-50. (in Chinese with English abstract)
[5] 刘莹, 侯英敏, 孙业兵,等. 三七内生菌的分离及其产皂苷发酵条件的优化[J]. 大连工业大学学报, 2016, 35 (1): 15-18.
LIU Y, HOU Y M, SUN Y B, et al. Isolation of endophytes fromPanaxnotoginsengfor saponin production and optimization of its fermentation of its fermentation conditions[J].JournalofDalianUniversityofTechnology, 2016, 35 (1): 15-18. (in Chinese with English abstract)
[6] 刘胜贵, 周玉莎, 易江, 等. 柑橘内生菌的分离、鉴定及其对沙皮病的防治作用[J]. 生命科学研究, 2016, 20(5): 429-434.
LIU S G, ZHOU Y S, YI J, et al. Screening and identification of citrus endophytic bacterium for biocontrol ofSandpaperrusset[J].LifeScienceResearch, 2016, 20(5): 429-434. (in Chinese with English abstract)
[7] 黄海东, 杨红澎, 王玉,等. 云雾龙胆内生菌的分离鉴定及抗茵活性分析[J]. 微生物学通报, 2010, 37(7): 1017-1021.
HUANG H D, YANG H P, WANG Y, et al. Isolation and antibiotic activities of endophytes inGentiananubigena[J].JournalofMicrobiology, 2010, 37(7): 1017-1021. (in Chinese with English abstract)
[8] 孙延芳, 梁宗锁, 杨开宝, 等.高效液相色谱法分析酸枣中的有机酸和维生素C[J].黑龙江农业科学, 2011(8):80-82.
SUN Y F, LIANG Z S, YANG K B, et al. Analysis of organic acids and Vc in sour jujube by high performance liquid chromatography[J].HeilongjiangAgriculturalSciences, 2011(8):80-82. (in Chinese with English abstract)
[9] LEE S M, PARK J G, LEE Y H, et al. Anti-complementary activity of triterpenoides from fruits ofZiziphusjujuba[J].BiologicalandPharmaceuticalBulletin, 2004, 27(11): 1883-1886.
[10] GUO S, DUAN J A, TANG Y P, et al. Triterpenoids from the fruits ofZiziphusjujubavar. spinisa[J].BiochemicaSystematics&Ecology, 2011, 39(4/6):880-882.
[11] 赵祥忠,李哲.利用野生酸枣酿制果醋的研究[J]. 中国调味品, 2007(7):13-15.
ZHAO Z X, LI Z. Research on brew fruit vinegar with wildSpondiasaxillaris[J].ChineseCondiment, 2007(7):13-15. (in Chinese with English abstract)
[12] 王向红, 崔同, 齐小菊, 等. HPLC法测定不同品种枣及酸枣中的齐墩果酸和熊果酸[J]. 食品科学, 2002, 23(6): 137-138.
WANG X H, CUI T, QI X J, et al. Determination of ursolic acid and oleanolic acid in jujuba and wild jujuba by HPLC[J].FoodScience, 2002, 23(6): 137-138. (in Chinese with English abstract)
[13] 曾路, 张如意, 王序.酸枣仁化学成分研究Ⅱ[J]. 药学学报,1987, 22(2): 114-120.
ZENG L, ZHANG R Y, WANG X. Studies on the constituents ofZizyphusspinosusHU[J].ActaPharmaceuticeSinica, 1987, 22(2): 114-120. (in Chinese with English abstract)
[14] 王贱荣, 张健, 殷志琦, 等.酸枣仁的化学成分[J]. 中国天然药物, 2008, 6(4): 268-270.
WANG J R, ZHANG J, YIN Z Q, et al. Chemical constituents from the seeds ofZiziphusjujubavar. spinosa[J].ChineseJournalofNaturalMedicines, 2008, 6(4): 268-270. (in Chinese with English abstract)
[15] NIU C Y, WU C S, SHENG Y X, et al. Identification and characterization of flavonoids from semen zizyphy spinosae by high-performance liquid chromatography/ linear ion trap FTICR hybrid mass spectrometry[J].JournalofAsianNaturalProductsResearch,2010, 12(4):300-312.
[16] CHENG G, BAI Y J, ZHAO Y Y, et al. Flavonoids fromZiziphusjujubaMill. var. spinosa[J].Tetrahedron, 2000, 56(45):8915-8920.
[17] 曹琴,王凯伟.中药酸枣仁的化学成分研究[J]. 药学实践杂志, 2009, 27(3):209-210.
CAO Q, WANG K W. Studies on the chemical constituents of the seeds ofZizyphusjujubaMill.[J].JournalofPhaimaceuticalPractice, 2009, 27(3):209-210. (in Chinese with English abstract)
[18] YOSHIKAWA M, MURAKAMI T, IKEBATA A, et al. Bioactive saponins and glycosides. X. on the constitutents of zizyphi spinosi semen, the seeds ofZizyphijujubaMill. var. spinosa Hu(1): structures and histamine release-inhibitory effect of jujubosides Al and C and acetyl jujuboside B[J].Chemical&PharmaceuticalBulletin, 1997, 45(7): 1186-1192.
[19] 刘沁舡, 王邠, 梁鸿, 等. 酸枣仁皂苷 D的分离及结构鉴定[J]. 药学学报, 2004, 39(8): 601-604.
LIU Q C, WANG B, LIANG H, et al. Structure identification of jujuboside D[J].ActaPharmaceuticeSinica, 2004, 39(8): 601-604. (in Chinese with English abstract)
[20] 刘东. 酸枣内生拮抗细菌SZG-23的分离鉴定及抗菌蛋白分离纯化[D]. 晋中:山西农业大学, 2014.
LIU D. Isolation and identification endophytic bacterium SZG-23 from sour jujube and purification of its antifiingal protein[D]. Jinzhong: Shanxi Agricultural University, 2014. (in Chinese with English abstract)
[21] 高振峰, 张宝俊, 刘慧芹,等. 酸枣内生真菌的分离及抑菌活性测定[J]. 山西农业大学学报, 2014, 34(2): 121-123.
GAO Z F, ZHANG B J, LIU H Q, et al. Isolation of endophytic fungus from wild Jujube and determination of their antifungal activity[J].JournalofShanxiAgriculturalUniversity(NaturalScienceEdition), 2014, 34(2): 121-123. (in Chinese with English abstract)
[22] 张昊. 山丹鳞茎总黄酮提取分离及抗氧化和抑菌活性的研究[D]. 延安: 延安大学, 2016.
ZHANG H. Study on extraction & separation and antioxidation & anti-bacterial of total flavonoids fromLiliumpumilumbulb[D], Yan’an: Yan’an University, 2016. (in Chinese with English abstract)
[23] 蔡信之, 黄君红. 微生物学实验[M]. 北京.科学出版社, 2010.
[24] 张德全, 刘涵, 廖勇, 等. 菌落PCR改良技术快速鉴定阿萨希毛孢子[J]. 中国真菌学杂志, 2015, 10(1): 6-10.
ZHANG D Q, LIU H, LIAO Y, et al. Study of improved colony PCR technologies for the identification ofTrichosporonasahii[J].ChineseJournalofMycology, 2015, 10(1): 6-10. (in Chinese with English abstract)
[25] 邵青. 山丹鳞茎总皂甙提取纯化及其抗氧化、抑菌活性研究[D]. 延安:延安大学, 2016.
SHAO Q. Study on the extraction, purification, antioxidant and anti-bacterial activities of saponins formLiliumpumilum[D]. Yan’an: Yan’an University, 2016. (in Chinese with English abstract)
[26] 张巧月, 杨浩天, 史贺,等. HPLC-MS 法同时测定酸枣仁中 9 种成分[J]. 中草药, 2015, 46(1): 123-127.
ZHANG Q Y, YANG H T, SHI H, et al. Simultaneous quantification of nine constituents inZiziphispinosaeSemen by HPLC-MS[J].ChineseTraditionalandHerbalDrugs, 2015, 46(1): 123-127. (in Chinese with English abstract)
[27] STROBEL G, DAISY B. Bioprospecting for microbial endophytes and their nature products[J].MicrobiologyandMolecularBiologyReviews, 2003,67(4): 491-502.
[28] JUNG M Y, PAEK W K, PARK I S, et al.Bacillusgaemokensissp. nov.,isolated from foreshore tidal flat sediment from the Yellow Sea[J].TheJournalofMicrobiology, 2010, 48 (6): 867-871.
Isolationofanendophyticbacterialstrainwithantifungalactivityfromwildjujube
DENG Zhenshan, WEI Tingting, SU Rui, GAO Fei, LIU Yuzhen, CHEN Bangkai, MO Darui, HE Xi, XU Hongxia
(CollegeofLifeScience,Yan’anUniversity,Yan’an716000,China)
Using tissue separation and grinding coated method, the endophytes were screened out to study the active substances in the leaves of wildjujubeendophytic microbes and species identification, and the filter method was used to test the antibacterial activities. The fermented product extraction of strain C-22-1 was extracted again and again to gain the antimicrobial substances. The single fermentation conditions of strain C-22-1, including carbon source, nitrogen source and time, were optimized according to the size of inhibition zone. The antibacterial activities of fermented liquid of C-22-1 and the antimicrobial substances were detected to seven human common pathogenic bacteria; the strain C-22-1’s antibacterial circle diameter reached 29 mm toStaphylococcusalbus. Qualitative test showed the strain C-22-1 produce saponins. Single factor optimization results showed that best carbon, nitrogen source and time was glucose, yeast extract and 8 d, respectively. Strain C-22-1 produce antimicrobial substances, which was initially identified as triterpenoid saponins.
wildZizyphusjujube; endophytes; tissue separation method;grinding coated method; antimicrobial activity
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(12): 2068-2076
http://www.zjnyxb.cn
邓振山,魏婷婷,苏瑞,等. 一株具有抑菌活性的酸枣内生菌的分离[J].浙江农业学报,2017,29(12): 2068-2076.
10.3969/j.issn.1004-1524.2017.12.15
2017-06-14
陕西省科技统筹创新工程(2012KTZB03-02-03,2012CGX7,2016TTC-N-3-1) ; 延安市科技局重大专项(2014CGZH-06);陕西省教育厅服务服务地方专项计划项(16JF029);延安市菌草工程研究中心专项基金;延安市生物资源开发与利用科技创新团队专项基金;延安大学“陕北微生物资源与利用研究中心” 科研机构专项基金;延安大学产学研合作研发项目
邓振山(1969—),男,陕西黄陵人,博士,副教授,主要从事微生物资源与利用和环境微生物学研究。E-mail: zhenshandeng214@163.com
S476.1
A
1004-1524(2017)12-2068-09
(责任编辑张 韵)
