水体中有机磷农药分析基质效应影响及其补偿方式研究
2018-01-05兰秀敏赵晶璨
宋 洲, 兰秀敏, 赵晶璨
(湖北省地质实验测试中心,湖北 武汉 430034)
水体中有机磷农药分析基质效应影响及其补偿方式研究
宋 洲, 兰秀敏, 赵晶璨
(湖北省地质实验测试中心,湖北 武汉 430034)
采用固相萃取富集、气相色谱分离、氮磷检测器测定水体中有机磷农药敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷和乐果,对测定过程中的基质效应进行研究。结果表明,水体中有机磷农药测定的过程中存在基质效应,其基质增强比例为1.006~3.147。基质效应与色谱分析条件、有机磷农药种类等有关。通过添加分析保护剂可有效降低基质效应对测定结果的影响,在对L-古洛糖酸γ内脂、聚乙二醇200和聚乙二醇400等的研究中,发现添加PEG200的效果最优。分析保护剂的加入不仅提高了测定的灵敏度,而且可以提高测定结果的精密度和准确度,用于实际样品分析可获得较高的回收率,满足分析检测要求。
有机磷农药;基质效应;分析保护剂
有机磷农药是目前生产和使用最多的农药品种,作为一种高效广谱杀虫剂,已被广泛用于农业生产活动中。喷洒在农作物上的有机磷农药一般只有10%~20%的附着,其余部分漂浮在大气中和降落在土壤上,通过雨水沉降和地表径流的方式进入地表水,造成污染。现有有机磷农药残留分析对象主要集中在蔬菜、水果、茶叶、药材、果汁等农作物基质中[1-5],对于水体中有机磷农药残留分析报道较少。然而受污染的饮用水、饮用水源和地下水对人类健康威胁重大。因此,建立水体中有机磷农药残留分析检测技术是十分必要的。
目前,有机磷农药分析检测技术主要有薄层色谱法[6]、气相色谱法[7]、液相色谱法[8]、气相色谱—质谱联用技术[9]、液相色谱—质谱联用技术[10]和生物测定法[11]等。其中,70%的农药残留检测采用气相色谱法来进行,结合高灵敏度的检测器如氮磷检测器或火焰光度检测器可以实现有机磷农药低残留水平的分析,具有应用范围广、分离效率高和分析速度快的特点。然而在实际样品分析中基质效应的影响及其消除方法是该技术应用的关键[12-14]。已有研究的重点是植物样品农药残留分析基质效应的影响[15-17],而对于水体中该方面的研究报道较少。
有机磷农药种类繁多,目前关注较多的主要包括以下几种:一是被美国环保局(US EPA)列入饮用水污染物候选清单中(CCL-3)的,比如乙酰甲胺磷、甲胺磷、乐果等;二是高毒,国内产量高的有机磷品种,比如敌敌畏、甲基对硫磷、对硫磷、氧化乐果、甲胺磷、久效磷等。已有研究表明,上述有机磷农药具有强的极性,其辛醇—水分配系数小,广泛存在于地表水中[18]。因此,本研究以敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷和乐果为代表,研究基质效应对上述有机磷农药检测的影响,并探讨基质补偿的方法,以期为水体中有机磷农药准确测定提供技术支撑。
1 实验部分
1.1 主要仪器
CNW24位真空固相萃取装置;隔膜真空泵(天津津腾);TurboVapII全自动氮吹浓缩仪(瑞典Biotage公司);Agilent 7890B气相色谱仪(美国Agilent公司),配氮磷检测器(NPD);KQ-500DE型数控超声波清洗器(昆山市超声波仪器有限公司);DGG-9140B型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);Milli-Q Direct 8型超纯水机(美国密理博公司)。
1.2 试剂与材料
固相萃取柱:CNWBOND HC-C18 SPE柱(1 g,6 mL),CNWBOND Carbon-GCB SPE柱(500 mg,6 mL),购于上海安谱实验科技股份有限公司;毛细管色谱柱:DB-1701P(30 m×0.25 mm×0.25 μm,美国Agilent公司);敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷、乐果:浓度均为100 μg/mL,丙酮介质,购于农业部环境保护科研监测所,理化性质如表1所示;L-古洛糖酸γ内酯:纯度≥98.0%,购于上海安谱实验科技股份有限公司;聚乙二醇200(PEG200)、聚乙二醇400(PEG400):分析纯,纯度≥98.5%,购于上海国药公司;丙酮(农残级),二氯甲烷(农残级),正己烷(农残级),甲醇(农残级),乙腈(农残级),无水硫酸钠(分析纯,650 ℃灼烧4 h),超纯水。

表1 7种有机磷理化性质Table 1 Physicochemical properties of the seven organophosphorous pesticides
1.3 水样固相萃取条件
首先依次用5 mL甲醇和10 mL超纯水活化固相萃取柱,接着取200 mL水样通过调整真空度使其以10 mL/min速度上样富集,待水样全部通过后继续抽滤10 min,最后加入淋洗剂15 mL浸泡10 min后洗脱,收集淋洗液并用无水硫酸钠除水,转入浓缩瓶中氮吹浓缩,丙酮换相并定容至1 mL,备GC测定。
1.4 分析条件
进样口温度:240 ℃;进样方式:脉冲不分流进样,脉冲压力40 psi,脉冲时间0.5 min;进样体积:1 μL;升温程序:初温110 ℃,以20 ℃/min升至250 ℃,保持3 min;氮磷检测器温度:280 ℃;尾吹气流量:3.0 mL/min;氢气流量:3.0 mL/min;空气流量:100 mL/min。
2 结果与讨论
2.1 气相色谱分析条件优化
7种有机磷气相色谱分离效果如图1所示。由图可知,在本文所建立的分析条件下,7种有机磷能够得到有效的分离。在气相色谱法测定的过程中,由于有机磷的热不稳定性、强的极性以及在气相色谱柱上的吸附性,容易导致检测信号的减弱甚至消失[19],这些均对气相色谱条件提出了较高的要求,因此,本文对此进行了研究。
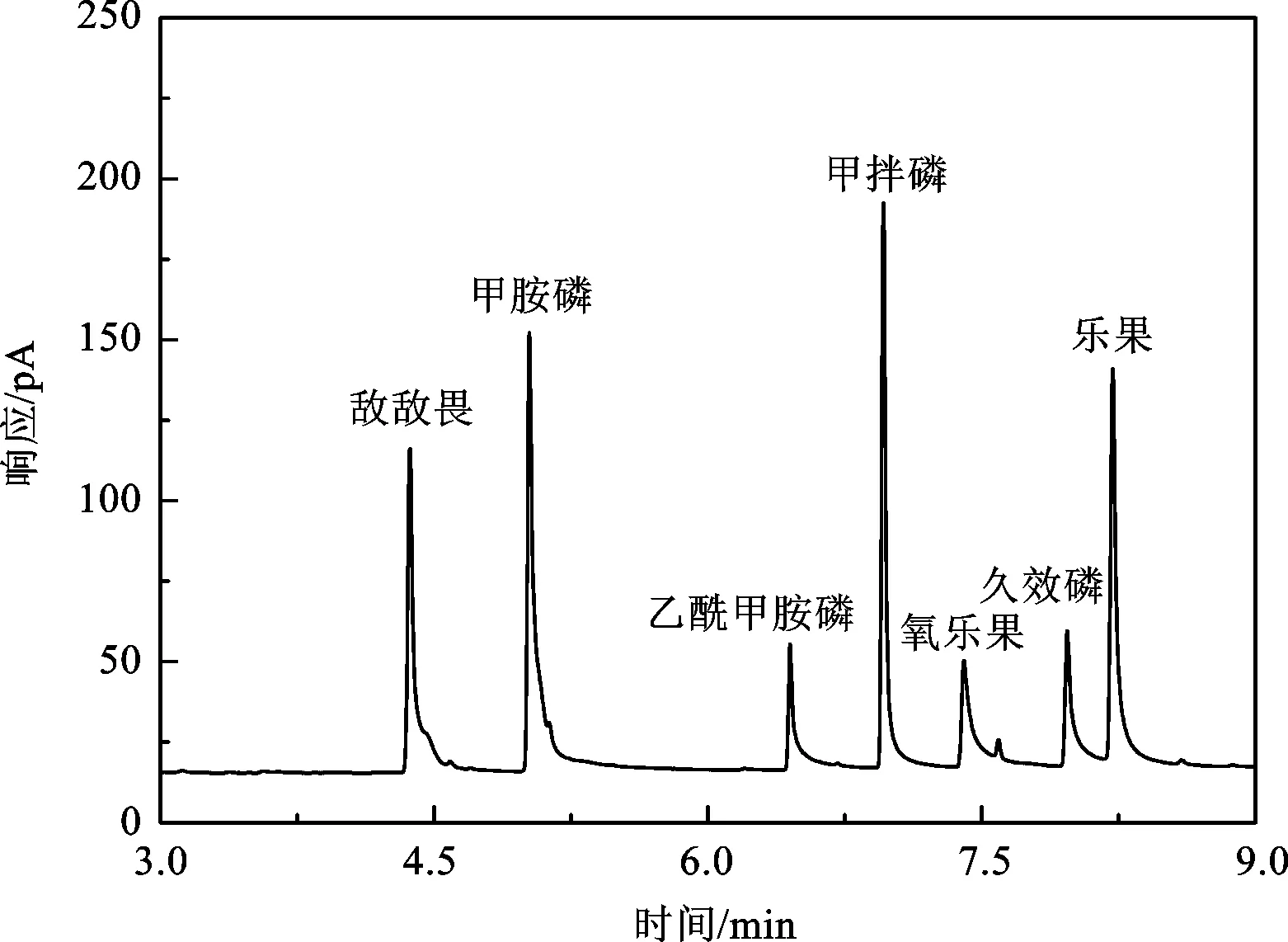
图1 7种有机磷气相色谱图Fig.1 Gas chromatogram of seven organophosphorous pesticide standards
2.1.1 进样口条件优化
有机磷的汽化温度比较低,考虑其热不稳定性,一般进样口温度设置为250 ℃。本文研究了进样口温度为230 ℃、240 ℃和250 ℃下7种有机磷的气相色谱响应情况,结果如图2-a所示。由图可知,在进样口温度为240 ℃时,7种有机磷的响应最高,这可能是由于在该温度下,7种有机磷能够充分汽化而且分解较低。此外,乐果、甲拌磷等受进样口温度的影响更为明显,这可能与其沸点较低有关(如表1所示)。因此,本文选择进样口温度为240 ℃。
除了进样口温度外,进样方式也会对有机磷的气相色谱响应产生影响。如图2-b所示,相比于不分流进样,在脉冲不分流进样下,7种有机磷响应均得到不同程度的提高;随着脉冲压力的增加,响应均出现先增加后降低的现象。为兼顾甲胺磷、乙酰甲胺磷等响应本身较弱的物质,本文选择进样脉冲压力为40 psi。在此基础上,进一步研究了脉冲时间的影响(如图2-c所示),发现0.5 min的脉冲使得7种有机磷色谱响应最高。对比图2-a和图2-b的结果可知,进样方式对有机磷的响应影响更大。这主要是由于本文所选择的7种有机磷极性大,在进样汽化的过程中,受玻璃衬管活性位点的影响大,即使采用高惰性的材质,随着进样数的增加,衬管活性不可避免的会随之增加,从而导致有机磷的吸附甚至降解,严重影响其色谱响应。当在进样过程中施加脉冲后,在保证有机磷正常汽化的同时,可以减少其在进样口的驻留,降低了与衬管活性位点接触的机会与时间,从而有效避免吸附与降解,使得色谱响应增强。由此可见,在实际应用中选择脉冲不分流的进样方式,可降低衬管更换与维护的频率,有效控制检测成本。

图2 气相色谱进样口条件影响图Fig.2 Influence of gas chromatographic conditions
2.1.2 检测器条件优化
氮磷检测器温度的提高有助于提升其灵敏度和稳定性,但是会缩短铷珠的使用寿命,因此,检测器温度设定的原则是在灵敏度允许的条件下,尽可能低些,但通常应高于150 ℃,避免过低的温度引起基线干扰以及因载气或尾吹气流速变化而导致的灵敏度变化。图3表明,在检测器温度为280 ℃条件下,7种有机磷可获得较高的色谱响应,该温度低于普遍使用的300~340 ℃。因此,本文选择检测器温度为280 ℃,可兼顾分析灵敏度与铷珠使用寿命。
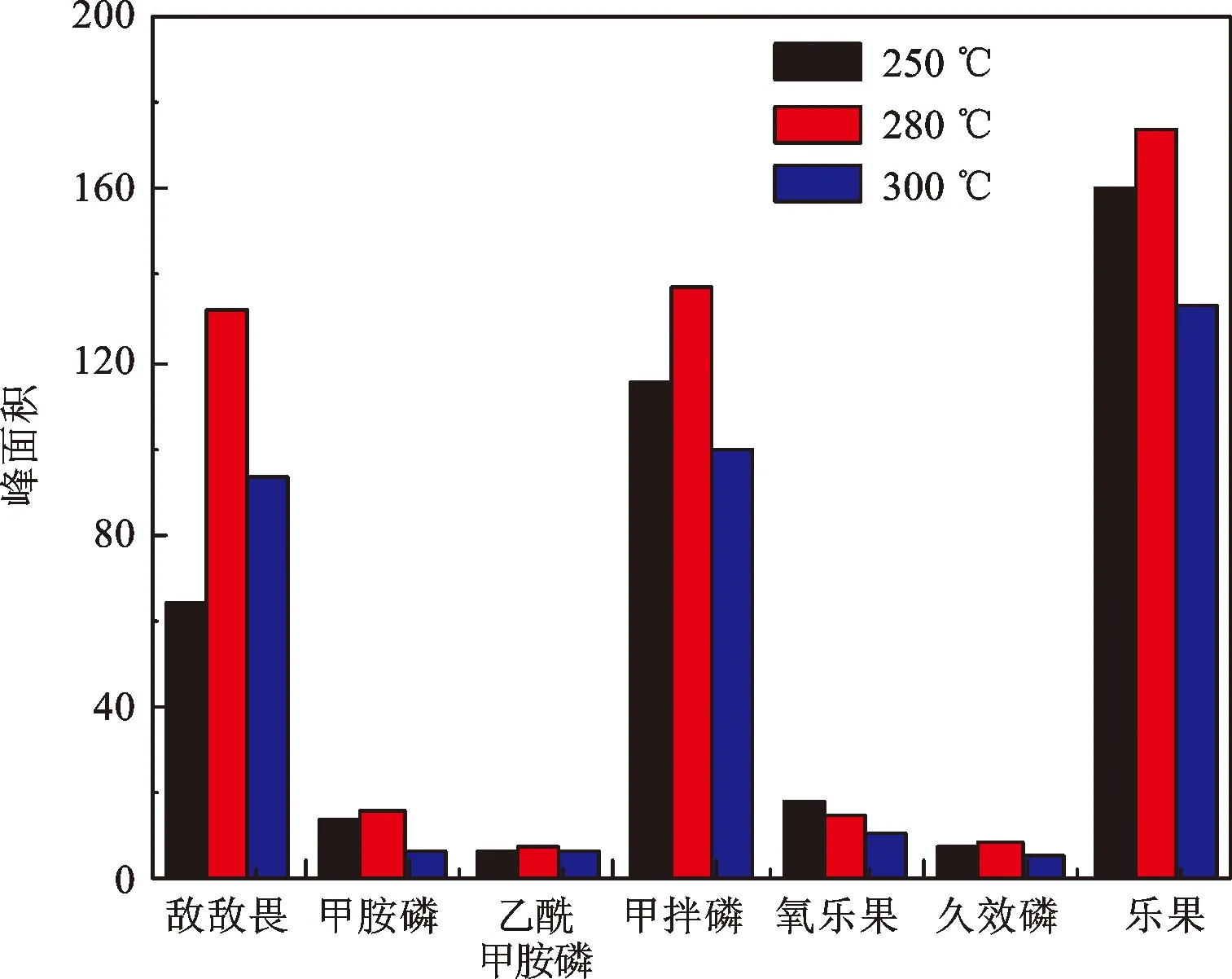
图3 气相色谱检测器温度影响Fig.3 Influence of detector temperature on the analysis of organophosphorous pesticide by gas chromatograph
2.1.3 色谱柱条件优化
对于有机磷多组分分析而言,程序升温有助于目标组分与干扰物的分离,获得尖锐峰形,同时缩短分析时间。其中,初始温度的设定较为关键。初始温度太低容易导致色谱峰展宽、拖尾以及分离度下降,设定过高容易导致活性有机磷组分分解。本文研究了初始温度在60~110 ℃范围内变化时对7种有机磷的色谱响应及其分离效果的影响,结果如图4所示。由图4-a可知,随着初始温度的增加,7种有机磷的色谱响应随之增加;除了敌敌畏之外,其余组分在100 ℃和110 ℃时的响应变化已不大。从图4-b的分离效果来看,随着初始温度的增加,分离时间缩短,峰拖尾现象得以改善,尤其对于敌敌畏而言。综合考虑,本文选择色谱柱程序升温初始温度为110 ℃。
2.2 基质效应及其补偿
在实际样品分析过程中,除目标分析物之外的其它基质组分会对待测物响应信号产生影响,此即基质效应,其会严重影响检测结果的准确性。该效应可以通过样品基质中待测物与纯溶剂中待测物响应值的比较来评价,即:

(1)
现有消除基质效应的方法主要有基质净化法、基质匹配校准法和基质补偿法等。基质净化法增加了前处理的工作量,处理不当,会降低目标物回收率,而且该法不能完全解决基质效应的问题。基质匹配校准法是利用不含有机磷农药的空白基质匹配标准溶液校准,同等程度地补偿标准溶液和样品溶液中农药的响应。虽然该法是解决基质效应最实际的方法,但是样品基质的复杂性使得寻找匹配的基质工作量大,增加了分析检测成本。在基质补偿法中最常用的方法是加入分析保护剂,利用保护剂有效地与待测农药竞争检测系统活性位点,最大程度降低基质效应影响。该法操作简单,可选择性强,能够覆盖不同性质的农药。
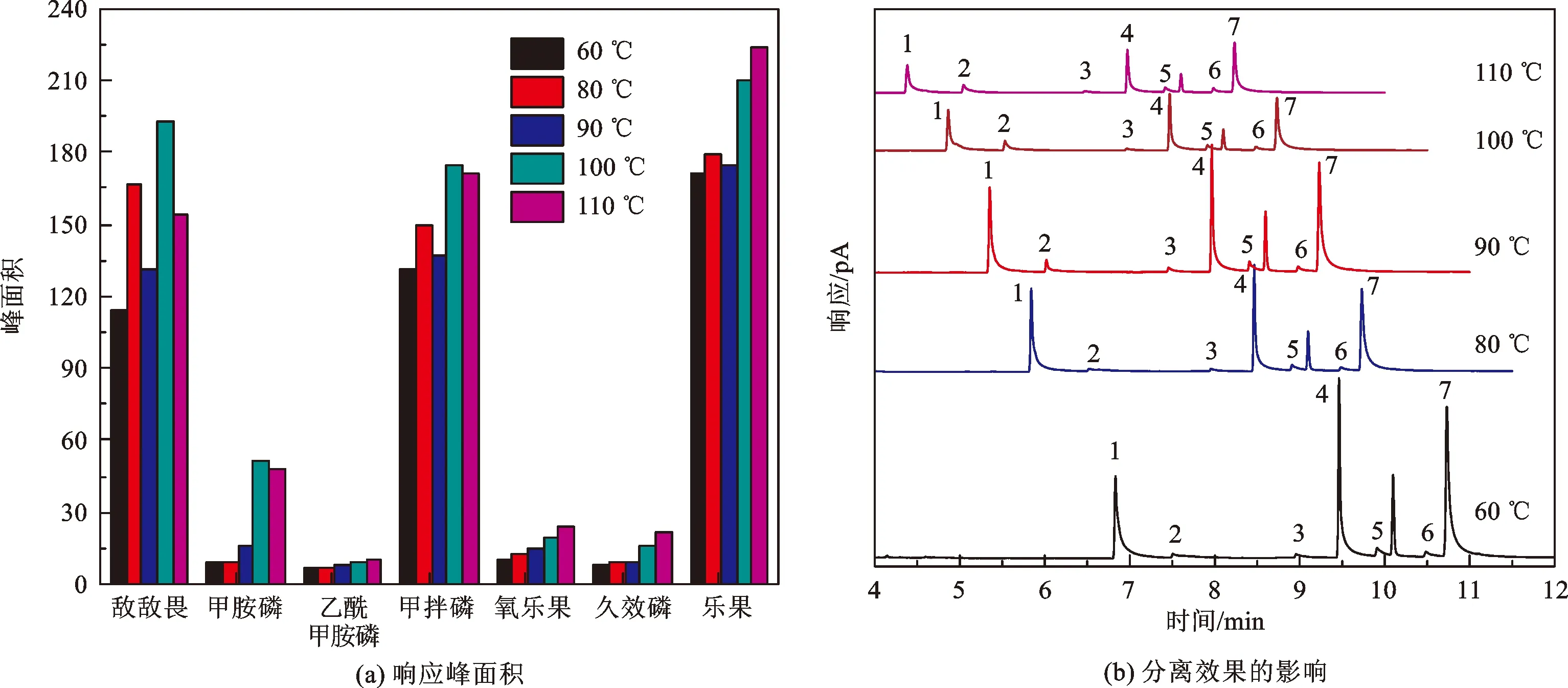
图4 色谱柱初始温度对有机磷(a)响应峰面积和(b)分离效果的影响Fig.4 Influence of initial column temperature on the (a) peak area and (b) separation of organophosphorous pesticide analyzed by gas chromatograph注:1~7分别代表敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷、乐果
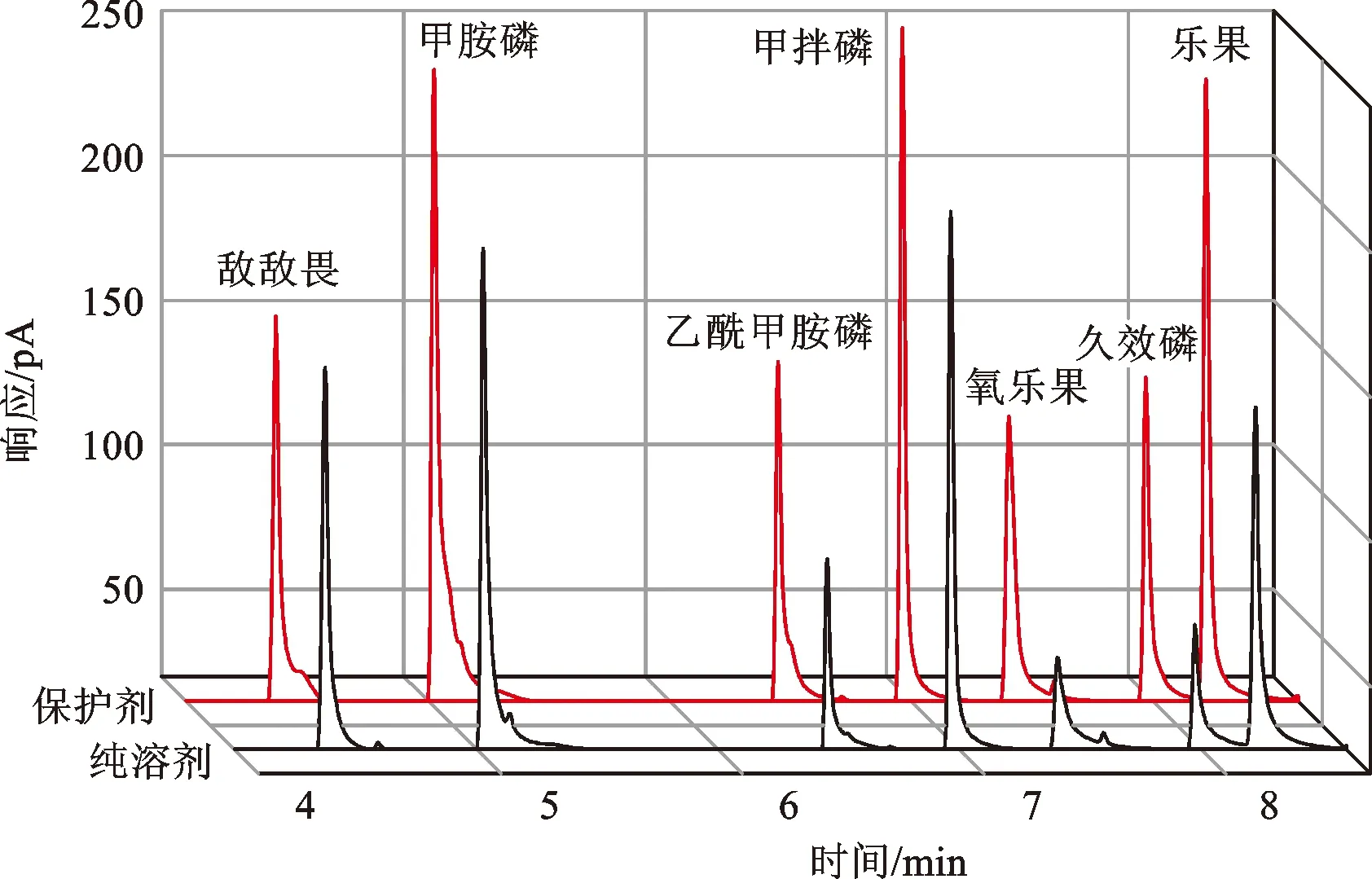
图5 分析保护剂对有机磷色谱响应信号的影响Fig.5 Effect of analyte protectant on the chromatographic signal of organophosphorous pesticide analyzed by gas chromatograph
图5所示为加入分析保护剂后对7种有机磷农药色谱响应的影响情况。由图可知,分析保护剂的加入对甲胺磷、乙酰甲胺磷、氧乐果、久效磷和乐果等的响应信号增加显著,而对敌敌畏和甲拌磷的响应信号影响较小。在所研究的分析保护剂中,PEG200的作用效果最优(图6);保护剂浓度的改变会对基质效应产生影响,对L-古洛糖酸γ内脂而言,200 mg/L浓度的作用效果占优,而对PEG200而言,10~100 mg/L的浓度范围内,作用效果变化不大。综合考虑,后期研究选择PEG200作为分析保护剂,添加浓度10 mg/L。
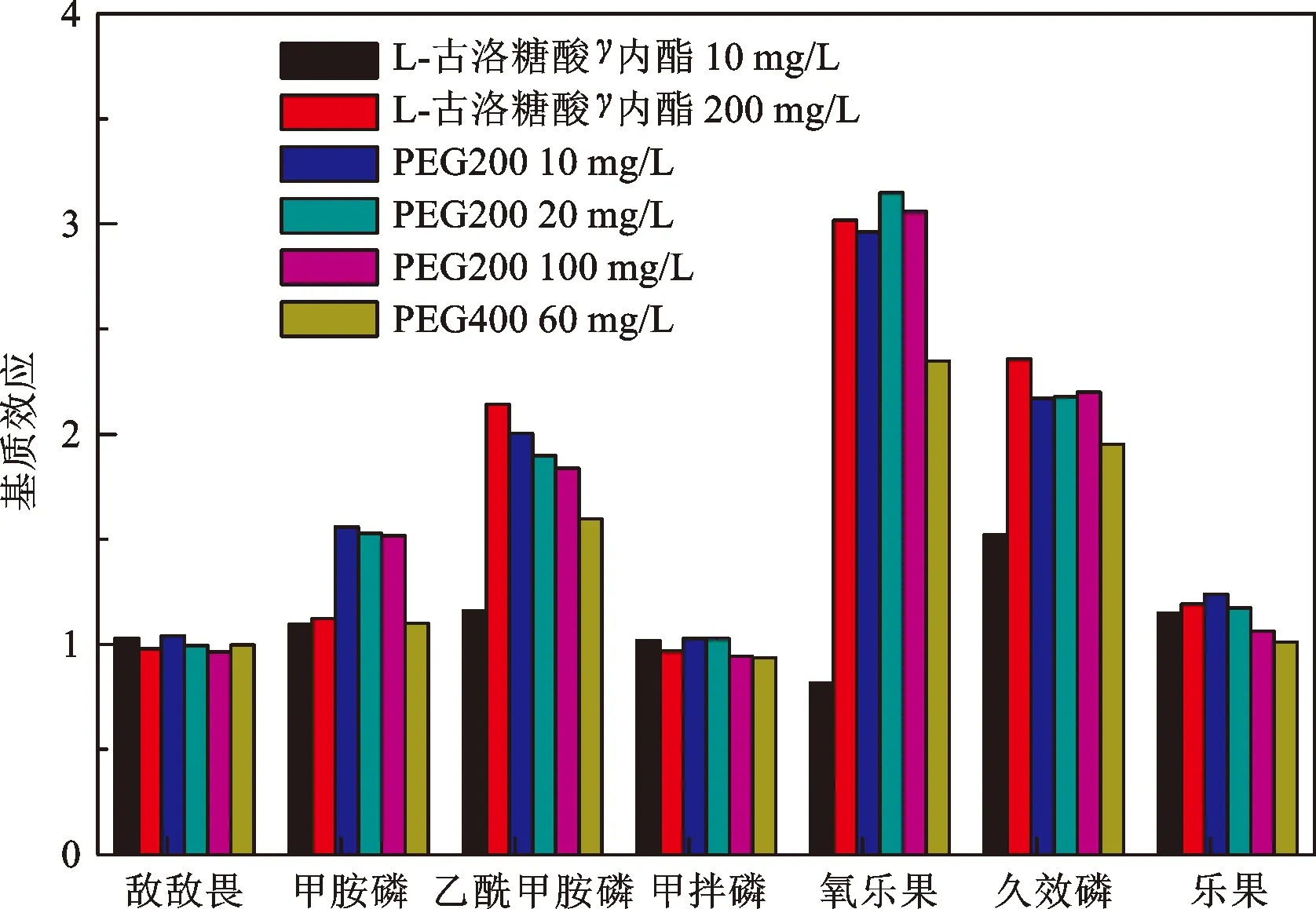
图6 不同分析保护剂对基质效应的影响Fig.6 Effect of different analyte protectants on matrix effect
2.3 基质补偿对分析方法性能的影响
2.3.1 校准曲线
分别以纯溶剂和添加PEG200的溶剂配制系列标准溶液进样分析,绘制校准曲线,结果如表2所示。由表2可知,在所研究的浓度范围内,基质补偿的校准曲线线性相关系数明显优于纯溶剂的,而且前者的斜率普遍高于后者的。由此可见,通过添加分析保护剂进行基质补偿,不仅可以改善校准曲线的线性相关性,而且可以提高目标化合物分析检测的灵敏度。
2.3.2 准确度与精密度
配制15份相同浓度的标准溶液进样分析,依式(2)计算每次分析结果的相对偏差:
相对偏差%=(Ci-Cs)/Cs×100
(2)
式中:Ci为第i次测定结果的浓度;Cs为理论浓度。
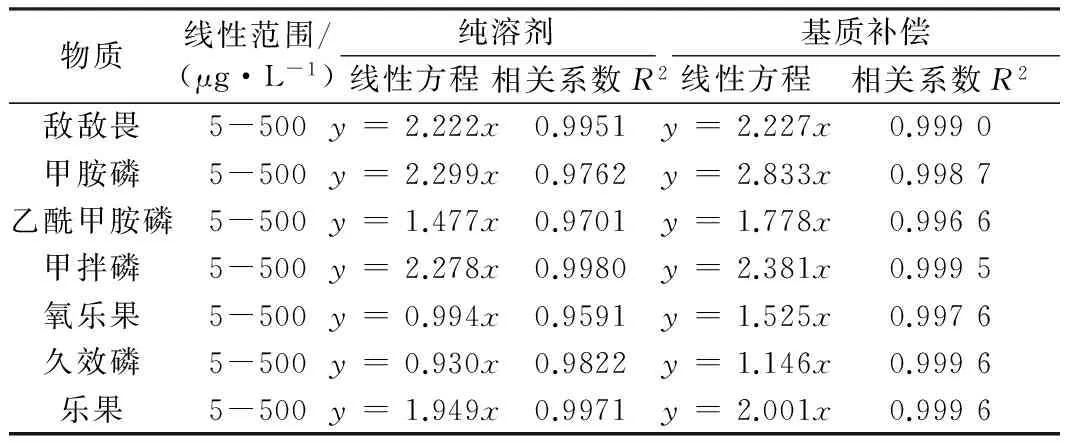
表2 纯溶剂与基质补偿的校准曲线比对Table 2 Comparison of calibration curve in pure solvent versus in matrix
注:y为目标组分色谱响应峰面积,x为目标组分浓度。
7种有机磷重复进样浓度相对偏差变化情况如图7所示。由图可知,在纯溶剂条件下,敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷和乐果重复进样浓度的相对偏差范围分别为-7.87%~4.30%、-20.1%~2.54%、-21.5%~-0.70%、-14.6%~0.84%、-35.5%~-6.62%、-30.1%~-4.70%和-19.3%~3.15%。而在基质补偿溶剂中,敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、久效磷和乐果重复进样浓度的相对偏差范围分别为-3.83%~4.56%、-5.86%~4.90%、-10.3%~10.3%、-6.26%~3.58%、-4.60%~15.5%、-7.89%~9.55%和-11.4%~6.03%。由此可见,相比纯溶剂而言,在有分析保护剂作为基质补偿的溶剂中,重复进样浓度相对偏差变化小且范围窄,表明分析测试结果的准确度与精密度有所提高,而这对实际样品分析而言显得尤为重要。
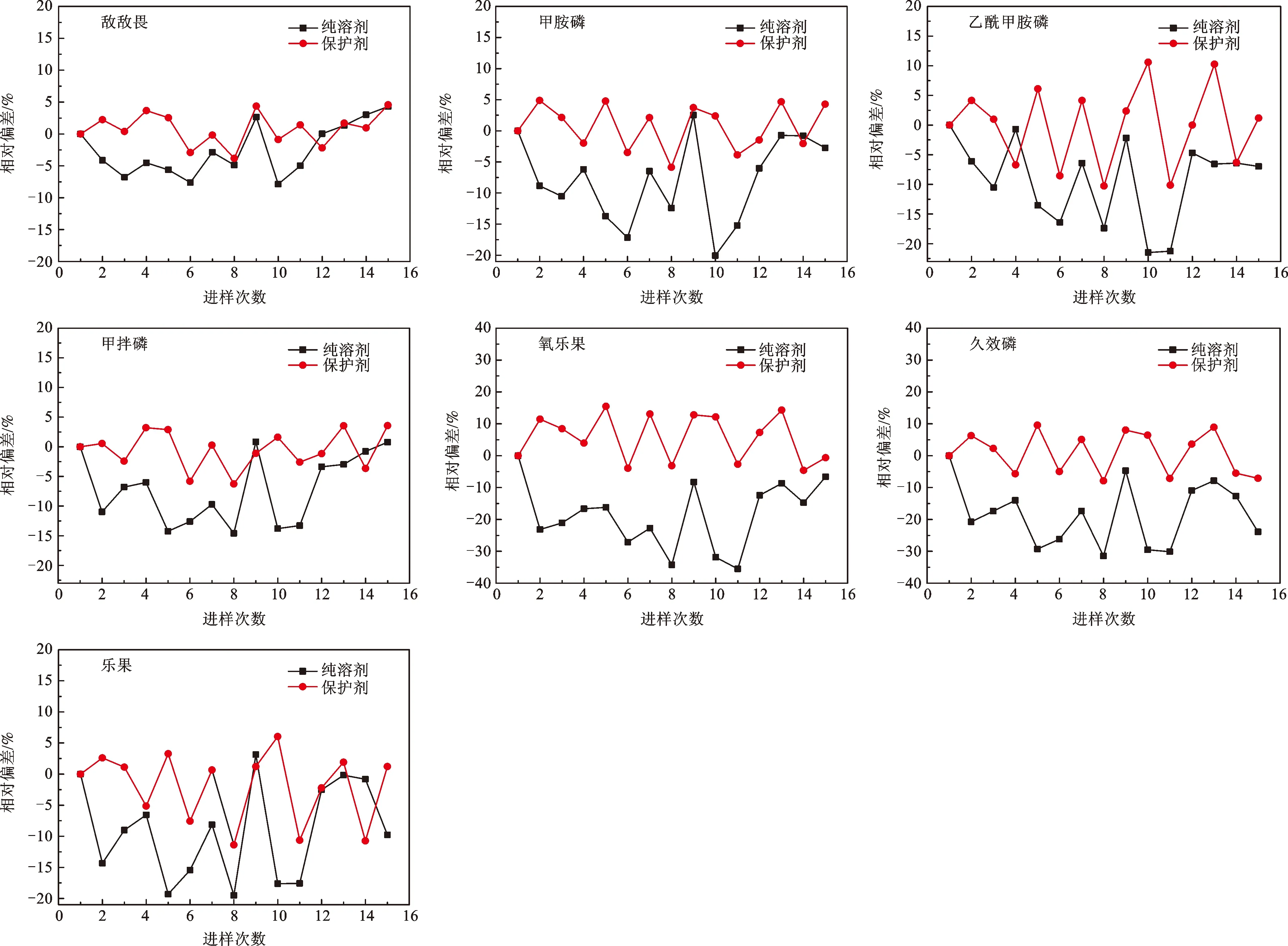
图7 7种有机磷重复进样浓度变化情况Fig.7 Changes of concentration of seven organophosphorous under repeated injection
2.3.3 检出限
方法的检出限定义为目标化合物在保留时间处3倍于噪声的信号所对应的浓度,其依赖于仪器的灵敏度、分析条件和样品基质等。本方法测试条件下目标化合物的检出限见表3所示。
2.4 实际样品测定
分别采用液液萃取、C18固相萃取柱和GCB固相萃取柱提取水体中有机磷,结果发现,由于所选目标有机磷水溶性强,尤其是甲胺磷、乙酰甲胺磷、氧乐果和久效磷,其辛醇—水分配系数<0,液液萃取回收率普遍偏低,如敌敌畏、甲拌磷、氧乐果和久效磷的回收率分别仅有46.2%、52.7%、3.76%和18.5%。相比而言,固相萃取效果占优,相比于C18固相萃取柱而言,GCB固相萃取柱更适合目标有机磷组分的萃取回收,结果如表4所示。由表可知,在添加有分析保护剂的情况下,一方面萃取回收率有所提高,其中氧乐果增加最为明显,由纯溶剂条件下的54.3%增加至119%,这可能与其受基质效应影响大有关;另一方面,测定精密度有所提高,这可从6次测定的相对标准偏差看出。对于甲胺磷和乙酰甲胺磷而言,因其水溶性大,所选固相萃取柱无法将其吸附富集,因此回收实验结果不理想。针对该类物质,可能需要优选固相萃取柱及更换液相色谱法进行测定,这将在后续研究工作中开展。因此,对于实际水体中有机磷的检测,基质效应的影响需加以考虑,通过添加分析保护剂可以有效降低基质效应的影响,从而提高检测结果的准确度。
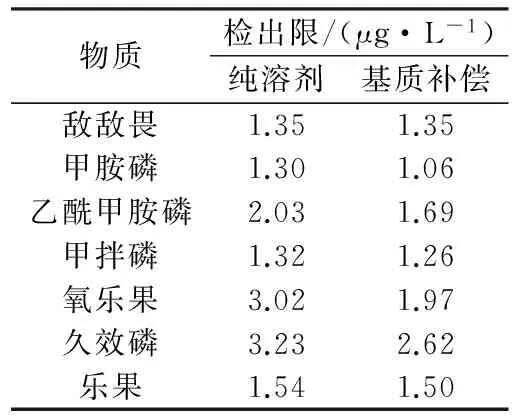
表3 方法检出限Table 3 Detection limits of the method
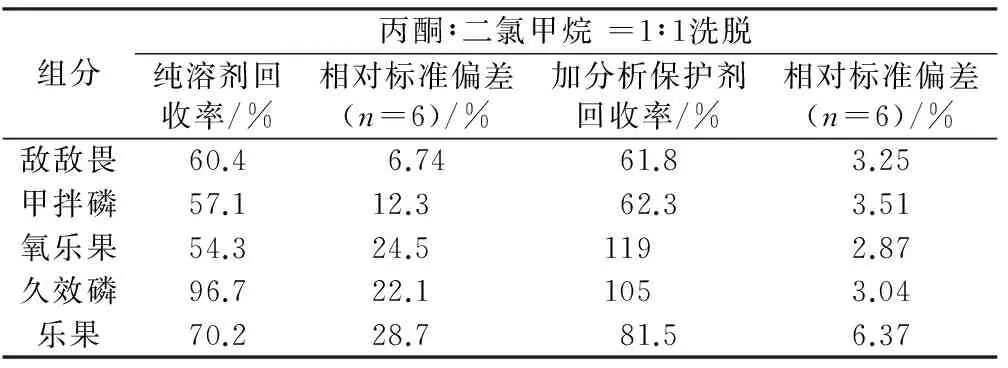
表4 GCB固相萃取柱加标回收率Table 4 Recoveries of organophosphorus pesticides using GCB as solid phase extraction cartridges
3 结语
本文采用固相萃取技术结合气相色谱法对水体中常见的7种有机磷农药进行了检测。结果发现,基质效应对水样测定影响较大,而该效应受色谱分析条件与有机磷农药种类的影响较大。通过添加分析保护剂进行基质补偿可有效降低基质效应的影响,不仅可以提高分析检测的灵敏度,而且可以提升检测的精密度与准确度。在实际样品分析中,发现GCB作为固相萃取柱的富集方法优于液液萃取和C18的固相萃取柱,而且添加分析保护剂后,不仅样品测试回收率得以提高,而且精密度亦大幅度提升。针对甲胺磷和乙酰甲胺磷这类水溶性极强的有机磷,液相色谱法可能更为合适。
[1] 韩梅,杨晓凤,侯雪,等.凝胶渗透色谱净化—气相色谱法测定酱腌菜中多种有机磷农药残留[J].西南农业学报,2011,24(6):2363-2368.
[2] 杨群华,江礼文,杨叶强,等.气相色谱法测定草莓中14种有机磷农药残留[J].现代农业科技,2015(12):126-127.
[3] 吴小亮,欧菊芳,曹赵云,等.气相色谱—质谱法测定蔬菜中农药残留时不同进样条件对基质效应的影响[J].理化检验—化学分册,2015(51):1580-1584.
[4] 黄会秋,黄逊.气相色谱法测定水产品中7种水溶性有机磷农药[J].环境与职业医学,2015,32(10):979-982.
[5] 张前龙,曹云,王宇,等.凝胶渗透色谱净化—气相色谱—串联质谱法测定果蔬中37种有机磷农药残留[J].中国卫生检验杂志,2015,25(17):2848-2856.
[6] 尉志文,贠克明,王玉瑾,等.薄层色谱扫描法和气相色谱/质谱法快速诊断有机磷农药中毒[J].中国药物与临床,2006,6(8):594-596.
[7] 何淼,饶竹.圆盘固相萃取富集—气相色谱法测定地表水中有机氯和有机磷农药[J].岩矿测试,2008,27(1):12-16.
[8] 郑远利,马莉莉,吴晓波,等.固相萃取—高效液相色谱法测定水中3种有机磷农药残留[J].理化检验—化学分册,2017,53(3):355-358.
[9] 林竹光,范玉兰,马玉,等.气相色谱—负离子化学电离质谱法分析测定蔬菜水果中有机磷农药的残留[J].色谱,2006,24(3):221-227.
[10] 潘元海,魏爱雪,赵国栋,等.水中痕量有机磷农药的高效液相色谱/质谱分析[J].环境科学进展,1999,7(1):32-40.
[11] 许翠玲,王改萍,胡胜水.有机磷农药生物电化学传感器的研究进展[J].分析科学学报,2002,18(6):502-507.
[12] 刘莉,罗军.基质效应对气相色谱分析有机磷农药残留的影响和解决方法[J].江西农业学报,2009,21(7):146-148.
[13] 江燕玲,成秀娟,魏燕秋,等.有机磷农药残留量检测过程中基质效应研究[J].农药科学与管理,2012,33(2):25-29.
[14] 杨旭,汤佳峰,巢文军.基质效应对有机磷农药测定的影响及其解决方法[J].分析测试学报,2009,28(12):1368-1372.
[15] 杨燕燕,张晓峰,刘靖,等.气相色谱仪测定蔬菜中有机磷农药残留的回收率和基质效应[J].山西农业大学学报(自然科学版),2014,34(4):328-331.
[16] 罗俊霞,符建伟,王毅红,等.气相色谱火焰光度检测器测定蔬菜中多种有机磷农药残留的基质效应[J].河南农业大学学报,2013,47(2):192-196.
[17] 刘淑梅,刘晓鹏,徐悦,等.不同基质效应对蔬菜中有机磷农药残留的分析[J].南方农业,2014,8(30):156-157.
[18] ZL Zhang,HS Hong,JL Zhou,G Yu.Occurrence and behaviour of organophosphorus insecticides in the river Wuchuan,southeast China[J].Journal of Environmental Monitoring,2002,4(4):498-504.
[19] 冯丽丽,胡晓芳,于晓娟,等.气相色谱法测定有机磷农药残留的常见问题探讨[J].环境监测管理与技术,2013,25(3):47-50.
Study on the Matrix Effects of Organophosphorus PesticidesAnalysis in Water and Its Compensation Methods
SONG Zhou, LAN Xiumin, ZHAO Jingcan
(HubeiProvinceGeologicalExperimentalTestingCenter,Wuhan,Hubei430034)
An analytical method coupling solid phase extraction and GC-nitrogen and phosphorus detectors was applied to the determination of dichlorvos,methamidophos,acephate,phorate,omethoate,monocrotophos,and dimethoate in water.Matrix effect of organophosphorus determination was also conducted.The results showed that there was a matrix effect in the determination of organophosphorus pesticides in water,and the response enhancement ratios ranged from 1.006 to 3.147.The response enhancement effects were different for chromatographic analysis conditions,organophosphorus pesticide types and so on.Matrix effects can be reduced by the use of analyte protectants.It was found that the effect of adding polyethylene glycol 200(PEG200)is the best among the L-gulonic acid gamma-lactone,PEG200 and PEG400.The addition of the analyte protectants not only improved the sensitivity of the measurement,but also enhanced the precision and accuracy of the determination results.It can get a higher recovery rate for the samples analysis to meet the analysis requirements.
organophosphorus pesticides; matrix effect; analyte protectants
X839.2; O657.7
A
1671-1211(2017)06-0802-06
10.16536/j.cnki.issn.1671-1211.2017.06.027
2017-08-21;改回日期2017-09-05
宋洲(1984-),男,工程师,博士,分析化学专业,从事环境中有机污染物分析检测工作。E-mail:sz001123@126.com
数字出版网址:http://www.cnki.net/kcms/detail/42.1736.P.20171026.0843.012.html数字出版日期2017-10-26 08:43
费雯丽)
