重症肌无力伴胸腺瘤或胸腺增生的临床特征及预后①
2018-01-05杨玲王国防丁意平刁珊珊徐耑
杨玲,王国防,丁意平,刁珊珊,徐耑
重症肌无力伴胸腺瘤或胸腺增生的临床特征及预后①
杨玲,王国防,丁意平,刁珊珊,徐耑
目的分析伴胸腺瘤或胸腺增生的重症肌无力患者临床特点及预后。方法回顾性分析2007年1月至2016年12月伴胸腺瘤重症肌无力患者118例和伴胸腺增生重症肌无力患者42例,统计并比较两组发病年龄、性别、首发症状、临床分型、受累肌群、肌无力危象、低频重复神经电刺激及完全稳定缓解资料。结果与伴胸腺增生重症肌无力患者相比,伴胸腺瘤重症肌无力患者平均发病年龄大,Ⅲ型比例高,术后完全稳定缓解率低(P<0.05),更易发生呼吸肌受累(χ2=6.364,P=0.011)及肌无力危象(χ2=5.455,P=0.022)。不同病理分型胸腺瘤伴发的重症肌无力患者之间呼吸肌受累(χ2=8.532,P=0.036)和肌无力危象(χ2=8.956,P=0.030)发生率存在显著性差异,以B3型最高,A+AB型最低。伴胸腺瘤重症肌无力患者重复神经电刺激阳性率高于伴胸腺增生重症肌无力患者,但无显著性差异(χ2<1.357,P>0.05);不同病理分型胸腺瘤重症肌无力患者有上升趋势,但无显著性差异(χ2<6.623,P>0.05)。结论伴胸腺瘤重症肌无力多见于中老年人,临床症状重,易有呼吸肌受累和肌无力危象,伴胸腺增生重症肌无力更能从手术中获益。重症肌无力低频重复神经电刺激阳性率与胸腺病变类型无明显关联。重症肌无力呼吸肌受累和肌无力危象与胸腺瘤病理分型有关。
胸腺瘤;胸腺增生;重症肌无力;呼吸肌受累;肌无力危象
目前公认重症肌无力(myasthenia gravis,MG)的发生、发展与胸腺内发生的异常免疫应答直接相关[1-2]。大约75%的MG患者并发胸腺异常,包括胸腺增生、胸腺瘤[3-5]。胸腺瘤和胸腺增生参与MG的发病机制不同,提示其临床特征和预后可能存在差异。文献报道[6-7]伴胸腺瘤MG组较非胸腺瘤组具有年龄大、病情进展快、易有呼吸肌受累及肌无力危象、咽喉肌受累比率和低频重复神经电刺激(repetitive nerve stimulation,RNS)阳性率相似的特点,但与伴胸腺增生MG组的临床对比研究相对较少。本研究目的是分析伴胸腺瘤和胸腺增生的MG患者临床特征及预后,为临床诊断和治疗提供帮助。
1 资料与方法
1.1 一般资料
回顾性分析2007年1月至2016年12月苏州大学附属第一医院收治的MG患者160例,均已行胸腺切除术,并获得病理结果。依据胸腺病变情况分为胸腺瘤组(n=118)和胸腺增生组(n=42)。80例伴胸腺瘤MG患者和20例伴胸腺增生MG患者进行腋、面、尺神经3 Hz、5 Hz低频RNS检查。对160例患者通过查阅病历和电话的方式进行随访,随访截止时间为2017年3月。
1.2 MG分型
MG按改良Osserman临床分型分为Ⅰ型(单纯眼肌型)、ⅡA型(轻度全身型)、ⅡB型(中度全身型)、Ⅲ型(重度激进型)、Ⅳ型(迟发重症型)和Ⅴ型(肌萎缩型)。肌无力危象的判断:MG患者肌无力症状恶化,因呼吸肌和/或吞咽肌严重无力,出现呼吸衰竭,需依赖机械通气维持呼吸功能。
1.3 胸腺瘤病理分型
依据2004年WHO组织学分型标准分为:A型,肿瘤细胞呈椭圆形或梭形,间质无淋巴细胞浸润;B型,肿瘤细胞呈上皮样或树突样,根据逐渐增加的上皮细胞/淋巴细胞比例及肿瘤上皮出现异型性的情况,将B型又分为B1、B2和B3三个亚型。AB型兼具A型和B型形态。
1.4 电生理检测方法
使用Keypoint型诱发电位/肌电图仪(丹麦Medtronic公司),在室温25℃的屏蔽室内进行。采用表面电极分别在尺、腋和面神经上给予3 Hz、5 Hz的低频超强刺激,记录并计算出复合肌肉动作电位(compound muscle action potential,CMAP)的波幅衰减幅度,第1个CMAP与第4个CMAP相比较波幅衰减大于15%为异常。
1.5 疗效判断标准
根据美国重症肌无力协会干预后状态分类体系将完全稳定缓解(complete stable remission rate,CSR)作为疗效终点观察指标。CSR定义为患者无MG症状和体征,且无需任何治疗至少1年。
1.6 统计学分析
采用SPSS 18.0统计软件进行分析。对计量资料进行正态性检验,符合正态分布采用(xˉ±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析。双向无序列联表采用行×列表资料的χ2检验或Fisher精确检验。双向有序列联表采用秩和检验。Kaplan-Meier法绘制CSR曲线,进行Long-rank检验。显著性水平α=0.05。
2 结果
2.1 临床特点
2.1.1性别、发病年龄
两组性别、发病年龄均有非常显著性差异(P<0.01)。见表1。
2.1.2首发症状
两组首发症状无显著性差异(P>0.05),但胸腺瘤组MG患者存在以呼吸肌无力首发者,胸腺增生组MG患者则无。见表1。
2.1.3临床分型
两组临床分型有显著性差异(P<0.05),胸腺瘤组MG患者较胸腺增生组MG患者Ⅲ型所占比例高而Ⅰ型低,Ⅱ和Ⅳ型差异不明显。见表1。
2.1.4受累肌群
两组眼外肌、四肢肌和咽喉肌受累比率无显著性差异(P>0.05),呼吸肌受累和肌无力危象比率有显著性差异(P<0.05)。见表1。
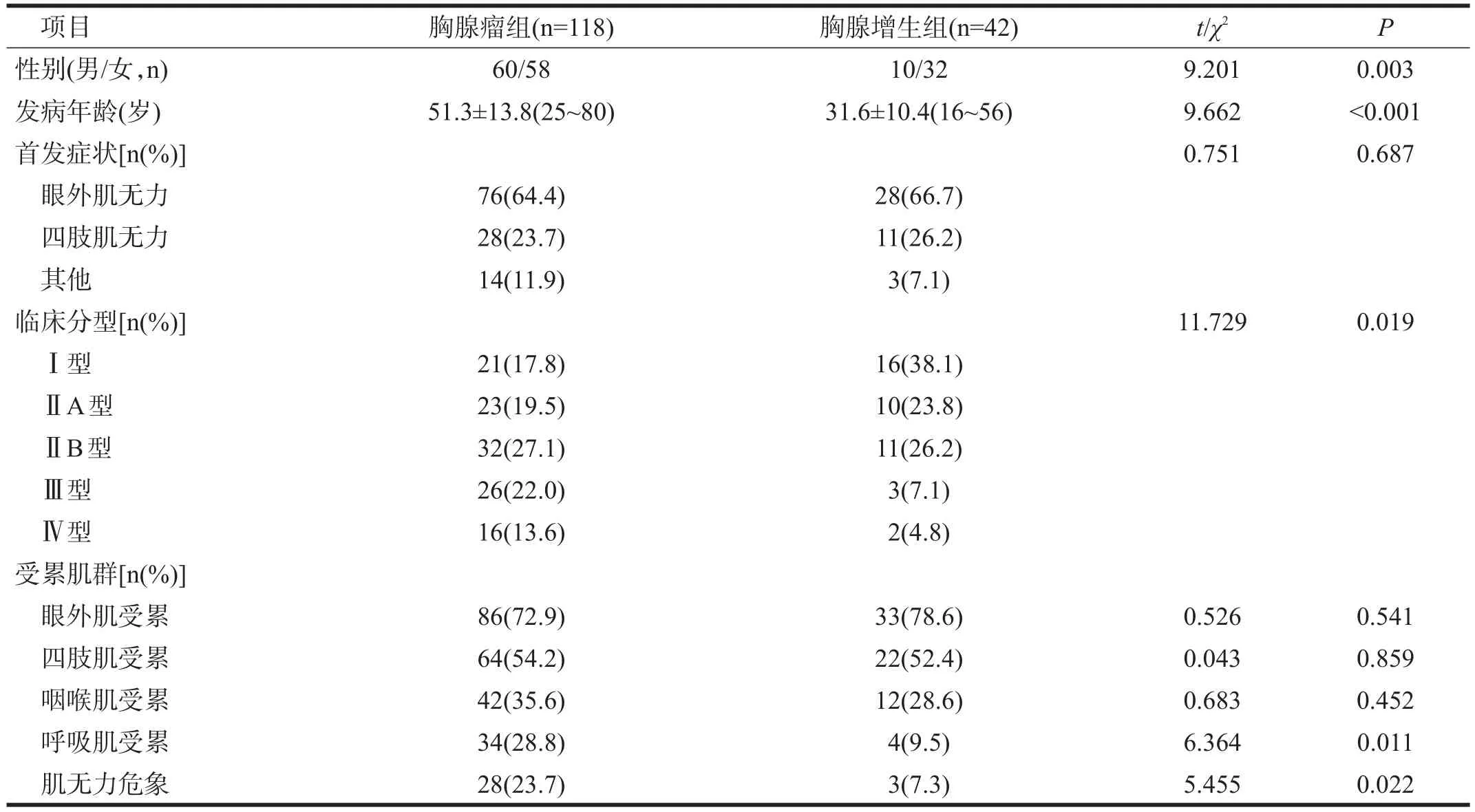
表1 两组MG患者临床特点比较
2.2 胸腺瘤病理分型
在118例伴胸腺瘤MG患者中,B2型44例(37.3%),B1型 34例(28.8%),A+AB 型 26例(22.0%),B3型14例(11.9%)。
2.2.1性别和发病年龄
四型患者平均发病年龄和性别无显著性差异(P>0.05)。见表2。
2.2.2首发症状
四型首发症状无显著差异(P>0.05)。四型均以眼外肌无力症状为首发症状者比例最高,四肢肌无力其次,其他如咽喉肌、呼吸肌等较少,B2型和B3型中存在以呼吸肌无力为首发症状的患者,A+AB型和B1型中无。见表2。
2.2.3临床分型
四型患者Ⅲ+Ⅳ型所占比例有逐渐升高的趋势,但总体临床分型无显著性差异(P>0.05)。见表2。
2.2.4受累肌群
四型患者眼外肌、四肢肌和咽喉肌受累比率均无显著性差异(P>0.05),B3型更易于出现呼吸肌受累,A+AB型则较少。肌无力危象发生率存在统计学差异,B3型较其他各型更易于发生肌无力危象,A+AB型较其他各型较少出现肌无力危象(P<0.05)。见表2。
2.3 腋、面、尺神经异常率
2.3.1胸腺瘤组和胸腺增生组比较
胸腺瘤组腋、面、尺神经及总体阳性率均高于胸腺增生组,但无显著性差异(P>0.05)。两组低频RNS阳性率从高到低均显示为腋、面和尺神经。见表3。
2.3.2不同病理胸腺瘤分型比较
腋、面、尺神经及总体阳性率随分型升高有逐渐上升的趋势,但无显著性差异(P>0.05)。每型低频RNS阳性率从高到低均显示为腋、面和尺神经。见表4。
2.4 CSR
胸腺瘤组MG患者随访时间4~116个月,25例CSR;胸腺增生组MG患者随访时间5~115个月,18例CSR。胸腺增生组的CSR曲线显著高于胸腺瘤组(χ2=6.138,P=0.013)。见图1。
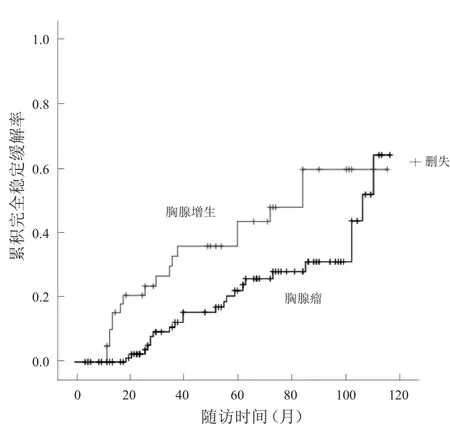
图1 胸腺瘤组和胸腺增生组MG患者CSR曲线比较
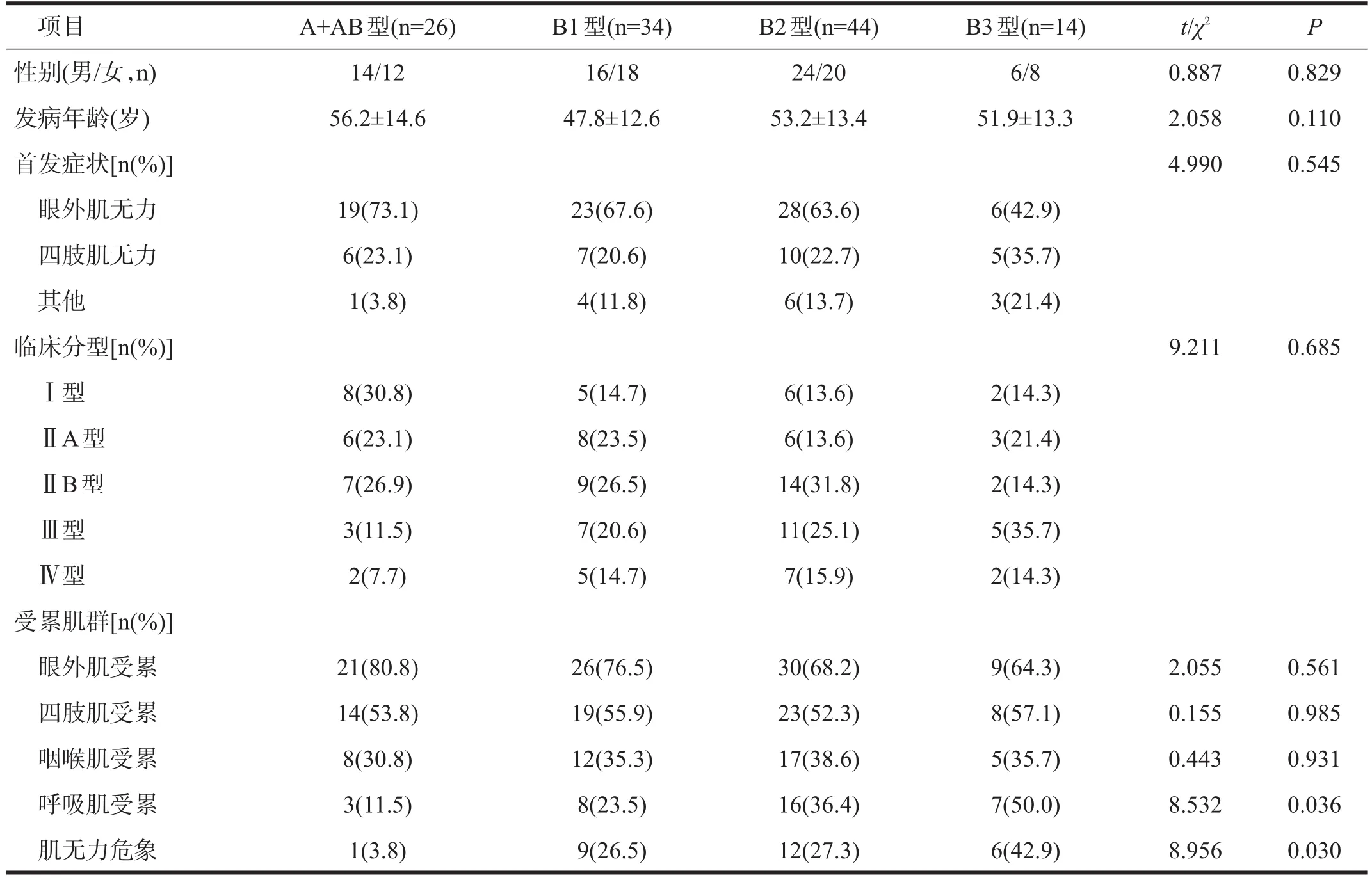
表2 不同病理胸腺瘤分型的MG患者临床特点比较(n=118)
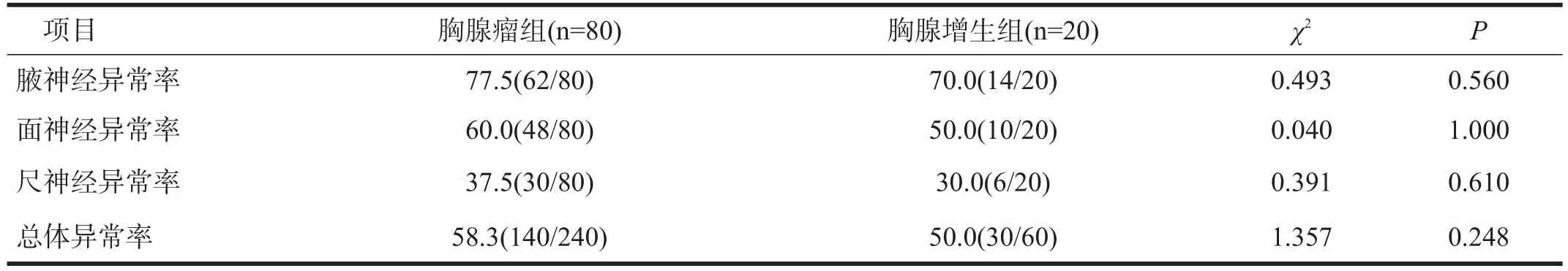
表3 胸腺瘤组和胸腺增生组MG患者低频RNS检测结果比较(%)
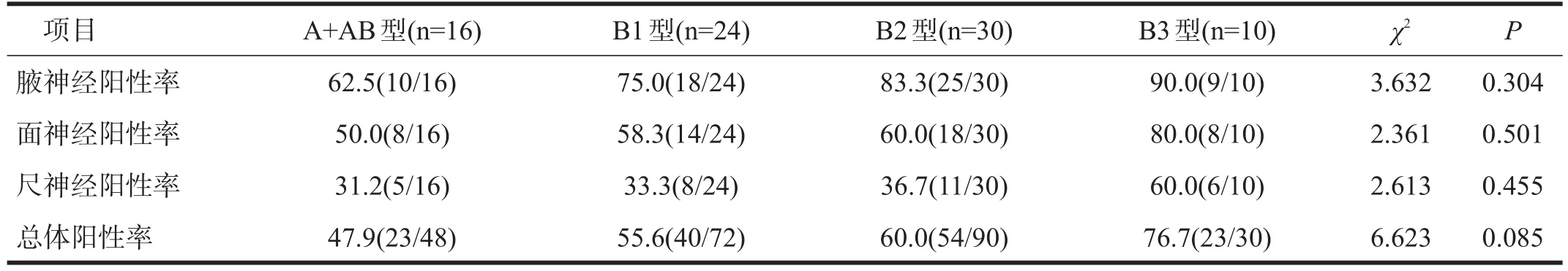
表4 不同病理分型胸腺瘤的MG患者低频RNS检测结果比较(%)
3 讨论
MG患者80%~90%存在胸腺异常,其中65%~70%伴有胸腺增生,10%~15%伴有胸腺瘤[8]。本研究显示,MG伴胸腺瘤和胸腺增生以及不同病理分型胸腺瘤所伴发的MG之间具有不同的临床和神经电生理特点。
本研究结果表明,伴胸腺瘤MG患者发病年龄高峰在50岁左右,男女比例相似,伴胸腺增生MG患者则多见于青年女性,与既往文献报道一致[9]。因此对于青年女性MG患者,应高度警惕胸腺增生的可能性,而中老年MG患者常并发胸腺瘤。本研究胸腺瘤组MG患者资料显示,A和AB型占11.1%,B型占88.9%,与Nakajima等[10]的研究相似,可能与B型胸腺瘤中存在AchR样抗原决定簇蛋白,A和AB型中呈阴性表达有关[11]。亚组分析发现,各病理分型胸腺瘤所伴发的MG患者之间年龄和性别无显著性差异。
本研究胸腺瘤组MG患者和胸腺增生组MG患者的首发症状构成比与Huang等[12]的研究存在不同,分析可能与该研究入组的多为经药物保守治疗无效或症状较重患者,而且都存在胸腺异常有关。
不同病理分型胸腺瘤患者均以眼外肌无力症状首发,在构成比上无显著性差异。根据以上结果推测MG的首发症状可能与胸腺病变类型无关。B2和B3型胸腺瘤伴发的MG患者中存在以呼吸肌无力发病的患者,并发胸腺增生MG患者中则无,提示对于以呼吸困难起病的MG患者应怀疑同时伴发B2或B3型胸腺瘤的可能性。
在临床分型方面,胸腺瘤组MG患者Ⅲ型比例明显高于胸腺增生组MG患者,Ⅰ型所占比例则较低,说明胸腺瘤组MG患者病情较重。AchR抗体是引起伴胸腺瘤MG患者发病的主要原因,该类患者中也存在连接素抗体(Tintin-Ab)和兰尼碱受体抗体(RyR-Ab)[13]。研究显示Tintin-Ab和RyR-Ab阳性的MG患者常伴随延髓肌、呼吸肌及颈部肌肉无力的症状,病情较重[14-15],从另一方面也支持本研究结果。进一步分析显示,MG临床分型与胸腺瘤病理分型无明显相关性,与陈玉萍等[6]的结论一致。
胸腺瘤组MG患者呼吸肌受累比例明显高于胸腺增生组MG患者,眼外肌、四肢肌和咽喉肌受累比率则无明显差异,同以上临床分型的研究结果基本相符。亚组分析发现,B型胸腺瘤患者呼吸肌受累比例明显高于A+AB型,眼外肌、四肢肌和咽喉肌受累则与胸腺瘤分型无明显关联。本研究证实伴胸腺瘤MG患者肌无力危象发生率远高于伴胸腺增生MG患者(23.7%vs.7.3%),尤其以B3型最高。Chu等[16]认为胸腺瘤是术后发生肌无力危象的独立危险因素。一项Meta分析[17]显示,并发胸腺瘤、Osserman分型、肺功能、药物或激素的使用、术后肺部感染及抗体滴度均可能与术后肌无力危象相关。因此,对于胸腺瘤MG患者术前严格控制肌无力症状、预防肺部感染等至关重要,以降低肌无力危象发生的概率。
RNS是针对神经肌肉接头部位病变最常用的电生理检查[18]。本研究结果显示胸腺瘤组MG患者腋、面、尺神经的低频RNS阳性率及总体阳性率均高于胸腺增生组MG患者,这或许与胸腺瘤组MG患者全身型比例高,易有呼吸肌受累有关。伴胸腺瘤MG患者肌肉兴奋收缩偶联反应时间显著长于不伴胸腺瘤MG患者[19],从另一个侧面也支持本研究的结论。但各组低频RNS的阳性率之间无显著性差异,可能与样本量较少、各样本行低频RNS的检查时机不同以及检查前服用胆碱酯酶抑制剂有关。进一步亚组分析发现各不同病理分型胸腺瘤伴发的MG患者腋、面、尺神经低频RNS阳性率和总体阳性率之间无显著性差异,提示低频RNS阳性率与胸腺瘤病理分型之间无明显相关性。伴胸腺瘤MG、伴胸腺增生MG以及各不同病理分型胸腺瘤伴发的MG均显示腋神经低频RNS阳性率最高,其次为面神经,尺神经最低,符合既往研究[20]中MG以近端损害为主的电生理特征。
对伴发或不伴发胸腺瘤的MG而言,胸腺切除术是一种安全、有效的治疗方法[21-22],但有关胸腺异常类型对手术疗效的影响存在不同观点。CSR作为一个明确的远期疗效终点评价指标,可最小化评估者间的差异。文献报道[23]胸腺增生MG患者手术后的CSR高于胸腺瘤MG患者,另有学者[24]发现两者术后疗效无明显差异。本研究结果显示,胸腺瘤MG患者手术后CSR曲线低于胸腺增生MG患者,可能与胸腺瘤MG患者临床症状较重有关[25],胸腺增生MG患者更应积极采取手术治疗[26]。由于本组资料为回顾性分析,样本量相对较少,存在截尾数据,可能对统计结果产生不利影响,有关胸腺瘤和胸腺增生MG患者术后CSR有待于进一步研究。
[1]Marx A,Pfister F,Schalke B,et al.The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes[J].Autoimmun Rev,2013,12(9):875-884.
[2]Cavalcante P,Le PR,Berrih-Aknin S,et al.The thymus in myasthenia gravis:Site of"innate autoimmunity"[J].Muscle Nerve,2011,44(4):467-484.
[3]Buckley C,Douek D,Newsom-Davis J,et al.Mature,long-livedandT cells are generated by the thymoma in myasthenia gravis[J].Ann Neurol,2001,50(1):64-72.
[4]Luther C,Poeschel S,Varga M,et al.Decreased frequency of intrathymic regulatory T cells in patients with myasthenia-associated thymoma[J].J Neuroimmunol,2005,164(1-2):124-128.
[5]Marx A,Willcox N,Leite MI,et al.Thymoma and paraneoplastic myasthenia gravis[J].Autoimmunity,2010,43(5-6):413-427.
[6]陈玉萍,王卫,王中魁,等.重症肌无力伴发胸腺瘤患者的临床特点分析[J].中华内科杂志,2012,51(8):623-625.
[7]邢岩,崔丽英,管宇宙,等.72例重症肌无力伴胸腺瘤的临床及神经电生理研究[J].中华医学杂志,2007,87(45):3188-3191.
[8]Meriggioli MN,Sanders DB.Autoimmune myasthenia gravis:emerging clinical and biological heterogeneity[J].Lancet Neurol,2009,8(5):475-490.
[9]Akaishi T,Yamaguchi T,Suzuki Y,et al.Insights into the classification of myasthenia gravis[J].PLoS One,2014,9(9):e106757.
[10]Nakajima J,Okumura M,Yano M,et al.Myasthenia gravis with thymic epithelial tumour:a retrospective analysis of a Japanese database[J].Eur J Cardiothorac Surg,2016,49(5):1510-1515.
[11]Karasaki T,Murakawa T,Nagayama K,et al.New onset of myasthenia gravis 10 years after proton beam therapy for thymoma[J].Gen Thorac Cardiovasc Surg,2016,64(5):290-293.
[12]Huang X,Liu WB,Men LN,et al.Clinical features of myasthenia gravis in southern China:a retrospective review of 2,154 cases over 22 years[J].Neurol Sci,2013,34(6):911-917.
[13]Romi F.Thymoma in myasthenia gravis:from diagnosis to treatment[J].Autoimmune Dis,2011,2011:474512.
[14]Romi F,Aarli JA,Gilhus NE.Myasthenia gravis patients with ryanodine receptor antibodies have distinctive clinical features[J].Eur J Neurol,2007,14(6):617-620.
[15]Romi F,Skeie GO,Aarli JA,et al.The severity of myasthenia gravis correlates with the serum concentration of titin and ryanodine receptor antibodies[J].Arch Neurol,2000,57(11):1596-1600.
[16]Chu XY,Xue ZQ,Wang RW,et al.Predictors of postoperative myasthenic crisis in patients with myasthenia gravis after thymectomy[J].Chin Med J(Engl),2011,124(8):1246-1250.
[17]刘宇,束余声.胸腺切除术后发生肌无力危象危险因素的Meta分析[J].中华胸心血管外科杂志,2015,31(11):660-664.
[18]Liang T,Boulos MI,Murray BJ,et al.Detection of myasthenia gravis using electrooculography signals[J].Conf Proc IEEE Eng Med Biol Soc,2016,2016:896-899.
[19]Nakata M,Kuwabara S,Kawaguchi N,et al.Is excitation-contraction coupling impaired in myasthenia gravis[J].Clin Neurophysiol,2007,118(5):1144-1148.
[20]Jing F,Cui F,Chen Z,et al.Clinical and electrophysiological markers in myasthenia gravis patients[J].Eur Neurol,2015,74(1-2):22-27.
[21]De Roxas RC,Bagnas MA,Baldonado JJ,et al.Clinical profile and outcome of postthymectomy versus non-thymectomy myasthenia gravis patients in the philippine general hospital:a 6-year retrospective study[J].Front Neurol,2016,7:96.
[22]Bak V,Spalek P,Rajcok M,et al.Importance of thymectomy and prognostic factors in the complex treatment of myasthenia gravis[J].Bratisl Lek Listy,2016,117(4):195-200.
[23]Spillane J,Hayward M,Hirsch NP,et al.Thymectomy:role in the treatment of myasthenia gravis[J].J Neurol,2013,260(7):1798-1801.
[24]Nazarbaghi S,Amiri-Nikpour MR,Mahmodlou R,et al.Clinical outcomes of myasthenia gravis with thymoma and thymic hyperplasia undergoing extended transsternal thymectomy:a single-center experience[J].N Am J Med Sci,2015,7(11):503-508.
[25]Mao Z,Hu X,Lu Z,et al.Prognostic factors of remission in myasthenia gravis after thymectomy[J].Eur J Cardiothorac Surg,2015,48(1):18-24.
[26]Bak V,Spalek P,Rajcok M,et al.Importance of thymectomy and prognostic factors in the complex treatment of myasthenia gravis[J].Bratisl Lek Listy,2016,117(4):195-200.
Characteristics and Outcome in Myathenia GravisAccompanied with Thymoma or Thymic Hyperplasia
YANG Ling,WANG Guo-fang,DING Yi-ping,DIAO Shan-shan,XU Zhuan
The FirstAffiliated Hospital of Soochow University,Suzhou,Jiangsu 215006,China
ObjectiveTo explore the clinical characteristics and outcome in myathenia gravisac companied with thymoma or thymic hyperplasia.MethodsFrom January,2007 to December,2016,118 myathenia gravis patients with thymoma,and 42 myathenia gravis patients with thymic hyperplasia were enrolled.Their age of onset,gender,initial symptom,osserman classification,muscles involved,myasthenia crisis,low-frequency repetitive nerve stimulation and complete stable remission rate data were retrospectively analyzed.ResultsCompared with myathenia gravis patients with thymic hyperplasia,myathenia gravis patients with thymoma showed older age in onset,higher proportion in type III and lower rate in complete stable remission rate(P<0.05),and more respiratory muscle involved(χ2=6.364,P=0.011)and myasthenia crisis(χ2=5.455,P=0.022).There were significant differences in respiratory muscle involved(χ2=8.532,P=0.036)and the incidence rate of myasthenia crisis(χ2=8.956,P=0.030)among thymoma with different pathological types,in which type B3 was the highest,and type A+AB was the lowest.The low-frequency repetitive nerve stimulation positive rate was higher in myathenia gravis patients with thymoma than with thymic hyperplasia,however,there was no significant difference(χ2<1.357,P>0.05).There was a rising trend with pathological classification altered in the low-frequency repetitive nerve stimulation positive rate with no significant difference(χ2<6.623,P>0.05).ConclusionMyathenia gravis patients with thymoma were common in middle-aged to old people,who were serious in clinical symptom,particularly respiratory muscle involved and myasthenia crisis.Myathenia gravis patients with thymic hyperplasia were more benefit from thymectomy.The low-frequency repetitive nerve stimulation positive rate of myathenia gravis patients does not correlate with thymic lesion type.Respiratory muscle involved and myasthenia crisis are relevant with pathological types of thymoma.
thymoma;thymic hyperplasia;myathenia gravis;respiratory involved;myasthenia crisis
XU Zhuan.E-mail:xuzhuan772@126.com
R746.1
A
1006-9771(2017)12-1425-06
[本文著录格式]杨玲,王国防,丁意平,等.重症肌无力伴胸腺瘤或胸腺增生的临床特征及预后[J].中国康复理论与实践,2017,23(12):1425-1430.
CITED AS:Yang L,Yang GF,Ding YP,et al.Characteristics and outcome in myathenia gravis accompanied with thymoma or thymic hyperplasia[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(12):1425-1430.
苏州大学附属第一医院,江苏苏州市215006。作者简介:杨玲(1991-),女,汉族,江苏宿迁市人,硕士研究生,主要研究方向:神经肌肉接头疾病。通讯作者:徐耑(1978-),女,汉族,江苏苏州市人,副主任医师,主要研究方向:神经肌肉接头疾病。E-mail:xuzhuan772@126.com。
10.3969/j.issn.1006-9771.2017.12.012
2017-07-05
2017-09-11)
