脑胶质瘤“综合诊断”和治疗模式的研究进展
2018-01-05董佳玮李子为蔡金全
董佳玮,李子为,蔡金全
(哈尔滨医科大学,黑龙江哈尔滨150081)
脑胶质瘤“综合诊断”和治疗模式的研究进展
董佳玮,李子为,蔡金全
(哈尔滨医科大学,黑龙江哈尔滨150081)
0 引言
脑胶质瘤是最常见的原发性颅脑肿瘤,由大脑胶质细胞癌变产生.目前研究显示,恶性胶质瘤年发病率约为5/100 000,每年新发病例超过14 000例,65岁以上人群中脑胶质瘤发病率明显增高[1].脑胶质瘤大多数呈浸润性生长,与周围正常组织分界不清,目前临床诊断脑胶质瘤多局限于基础形态学,通常采用手术、放疗、化疗相结合的治疗方案,预后较差,极易复发或进展.WHOⅣ级胶质母细胞瘤约占原发GBM的50%,中位生存期仅14个月[2].
脑胶质瘤患者预后受肿瘤级别、病理类型、手术切除范围、发病年龄、KPS评分等多种因素影响.由于临床诊断局限于胶质瘤基础形态学,不能明确判断胶质瘤病理类型、肿瘤生物学行为,也不能为患者预后和术后临床治疗提供太多帮助.
近年来,随着“综合诊断”概念的确定及诊断治疗模式的升级,为肿瘤的准确诊断和划分提供了重要的指导意义,并对相应治疗计划的制定以及治疗反应的评估有较高的价值.本文将就上述脑胶质瘤“综合诊断”及诊断治疗模式的研究进行综述.
1 脑胶质瘤“综合诊断”的临床应用
2014年5月1~3日国际神经病理学会在荷兰Haarlem召开题为“WHO's Next:A Colloquium to Guide Next Steps in Brain Tumor Classification and Grading”的会议,会议讨论了如何将分子信息纳入中枢神经系统肿瘤分类中并达成了“ISN-Haarlem”共识,明确了“综合诊断”的概念.为更加准确地应用于临床诊断,“综合诊断”的内容不仅包括了肿瘤病理类型和肿瘤级别,还纳入了关键的分子信息[3].根据该共识内容形成了一套更科学的用于成人的弥散胶质瘤综合诊断方案.首先通过免疫组织化学检测IDH1-R132H及ATRX表达状态,表达阳性时需对染色体1p/19q状态进行检测,并对IDH1和IDH2突变状态采用测序方法检测(图1).根据WHO 2007版中枢神经系统肿瘤的分类定义,德国癌症研究中心对405例成人胶质瘤(包括61例少突胶质细胞瘤、63例少突星形细胞瘤,129例胶质母细胞瘤和152例星形细胞瘤)IDH、ATRX和1p/19q联合缺失状态进行了分析.该团队根据“ISN-Haarlem”协议,对脑胶质瘤病理诊断进行重新评估,包括100例少突胶质细胞瘤、150例胶质母细胞瘤和155例星形细胞瘤(图2)[4].
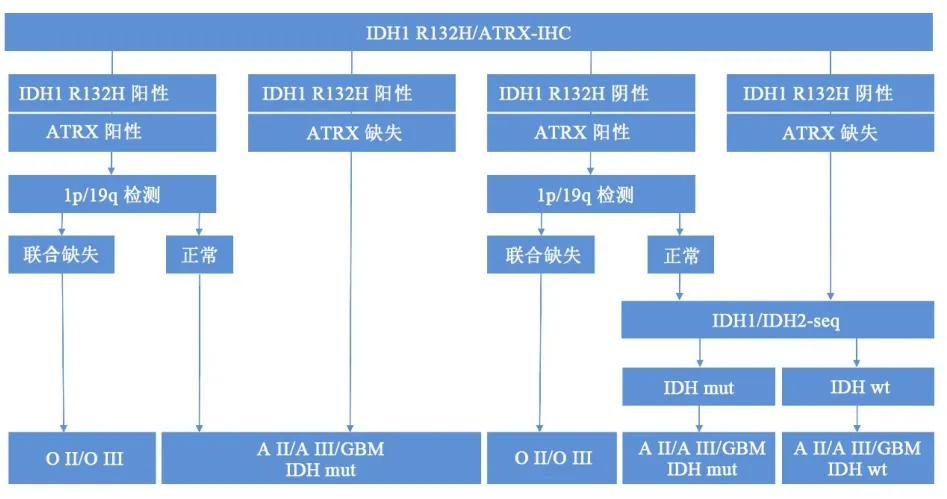
图1 脑胶质瘤“综合诊断”流程[5]
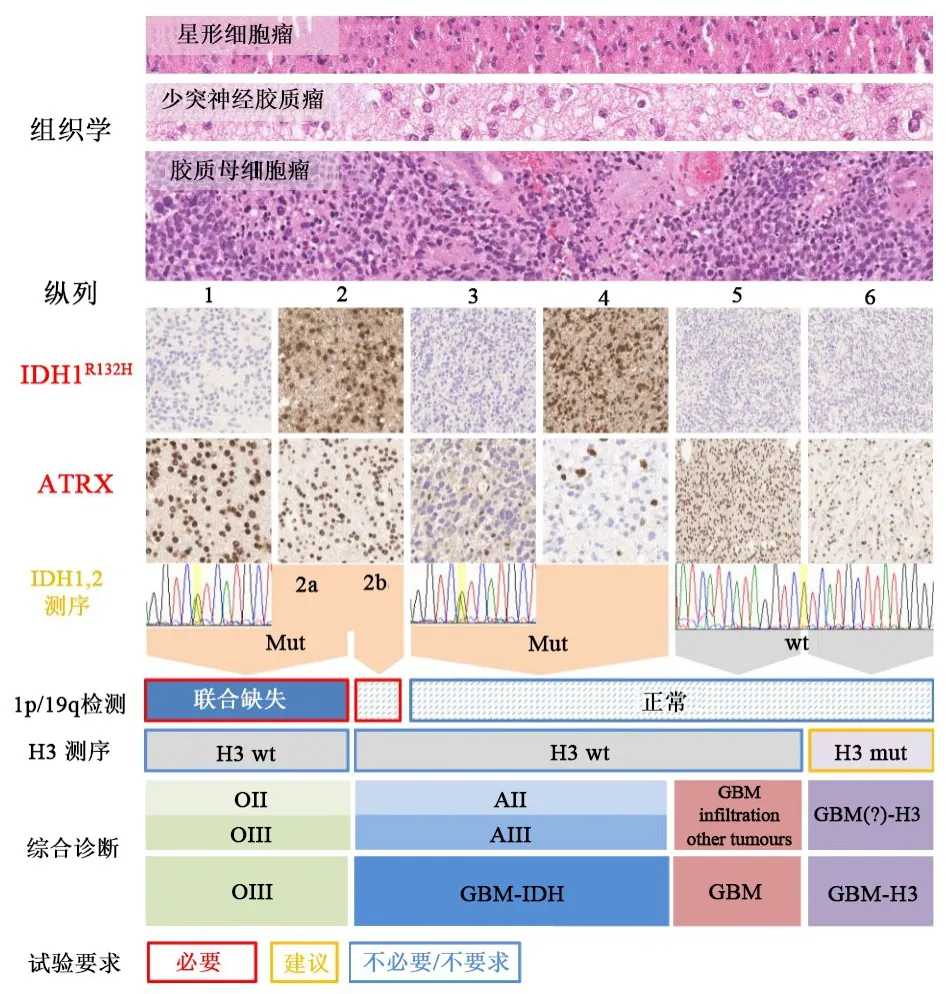
图2 利用分子标记物对400多例胶质瘤进行综合诊断[5]
通过对100例带有随访资料的患者预后进行分析,该团队发现相比于WHO 2007版中枢神经系统肿瘤分类,“综合诊断”在预测患者无进展生存期和总生存期方面更加准确.在WHO 2007版中枢神经系统肿瘤分类中,由于使用了少突星形细胞瘤的诊断类型,而在生物学行为上星形细胞瘤和少突胶质瘤强烈相关,进而导致了各个中心在星形细胞瘤、少突星形细胞瘤和少突胶质细胞瘤的诊断上存在很大差异.避免使用少突星形细胞瘤诊断类型后,各个中心之间的诊断差异大大缩小.因此,相比于WHO 2007版中枢神经系统肿瘤分类,“综合诊断”改变了星形细胞瘤和少突胶质细胞瘤的发病比例.肿瘤分类决定于生物学起源,而肿瘤级别反映了肿瘤恶性程度和进展情况,“综合诊断”仅影响脑胶质瘤的分类,对肿瘤级别几乎没有影响.
脑胶质瘤“综合诊断”的常规步骤:首先用免疫组化检测肿瘤ATRX和IDH1-R132H状态,几乎所有星形细胞瘤来源的肿瘤均表现为ATRX缺失,且大部分表现为IDH1-R132H阳性.所有表达ATRX核蛋白的肿瘤均需检测1p/19q状态,其中星形细胞瘤来源的肿瘤表现为未带有1p/19q联合缺失,这部分肿瘤需要通过测序方法检测IDH少见突变.表达ATRX、未带有1p/19q联合缺失和IDH突变的星形细胞瘤很可能是胶质母细胞瘤.而所有表现为1p/19q联合缺失的肿瘤均是少突胶质细胞瘤.没有表现为IDH1-R1 32H阳性的少突胶质细胞瘤不需要测序检测IDH少见突变.
2 脑胶质瘤诊断治疗模式及其展望
2016年中国脑胶质瘤协作组在国际著名癌症期刊Cancer Letters上发表“CGCG Clinical Practice Guidelines for the Management of Adult Diffuse Gliomas”(图3).该指南不仅为成人脑胶质瘤患者的诊断和治疗提供了完整的方案,并且为研究机构和决策部门提供了咨询依据.脑胶质瘤需要影像学、手术、病理、放射治疗、化疗和支持治疗等多学科的综合治疗.而且患者Karnofsky的评分、神经功能和年龄等因素也不同程度的影响临床决策.
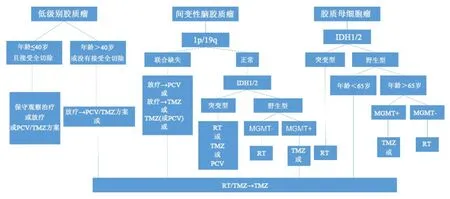
图3 脑胶质瘤术后综合治疗规范[6]
神经影像学作为非侵入性评估手段可以准确的诊断和划分肿瘤,并为制定患者的个性化治疗方案提供帮助.计算机断层扫描能够显示肿瘤相关的特征但不够敏感,并且可能漏诊小肿瘤.磁共振成像能够更加敏感地显示肿瘤的存在及位置,有助于明确诊断和制定治疗方案.正电子发射断层扫描在脑胶质瘤的评估和鉴别诊断中有独特的优势.
手术切除作为治疗脑胶质瘤必不可少的措施,在“最大安全切除”原则下,应尝试保护患者的神经功能.全切除术的患者一般有更好的临床预后,而术中导航系统、术中磁共振成像、术中神经电生理监测等可以在增加切除范围的同时降低神经功能缺损的风险.在感觉、语言和肢体运动等重要脑功能区附近的肿瘤,可以采用术中唤醒技术,最大安全范围切除肿瘤.对于长期癫痫病史的患者,手术切除有利于控制肿瘤引起的癫痫.根据肿瘤的大小和位置、患者的情况等,活检或部分切除也可作为一种暂时性处理措施,其目的在于获得足够的肿瘤组织用于组织学和分子生物学分析.再根据患者的临床资料、手术切除程度、组织学分级及生物学特征进一步制定术后具体的放疗和化疗方案.对于间变性胶质瘤和胶质母细胞瘤患者,IDH突变、1p/19q缺失和MGMT启动子区的甲基化状态可用于制定术后综合治疗方案[7].
2.1 低级别脑胶质瘤治疗 手术切除在低级别胶质瘤治疗方案中仍是化疗和放疗难以取代的.美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议对成人幕上低级别浸润性星形细胞瘤和少突胶质细胞瘤应采取最大安全切除原则,最大范围地切除肿瘤可显著延长患者生存时间[8].
对于无明显临床症状的低风险低级别脑胶质瘤患者(年龄≤40岁且接受全切除),可采取保守观察治疗,5年内每3~6个月复查一次MRI,5年后可每年复查一次MRI.然而,若肿瘤存在星形细胞瘤成分,患者肿瘤复发及死亡风险也会增加.早期总放疗剂量 50.4~54.0 Gy,每次 1.8 Gy 是目前低级别脑胶质瘤的标准放疗方案[9-10].接受早期放疗的患者的无进展生存期有明显延长,但在总生存期上并没有明显改善[10].同时早期放射治疗也有利于控制患者癫痫发作[11].
大量临床随机对照研究(RTOG 9802,EORTC 22033和RTOG 0424)显示高风险的低级别脑胶质瘤患者(年龄>40岁或没有接受全切除)在放化疗同步治疗及辅助化疗或仅辅助化疗中获益[12-15].尽管相比于PCV方案,替莫唑胺作为早期方案更易耐受,但是最近研究显示,替莫唑胺的使用会增加IDH突变型脑胶质瘤患者基因突变的风险[14,16-17].
2.2 间变性脑胶质瘤治疗 间变性星形细胞瘤(anaplastic astrocytoma,AA)、间变性少突胶质细胞瘤(anaplastic oligodendroglioma,AO)和间变性少突-星形细胞瘤(anaplastic oligoascrocytoma,AOA)统称为间变性脑胶质瘤.手术切除可改善患者临床症状且利于神经功能恢复,术后可以根据肿瘤组织学类型、分子分型以及患者临床状态的因素辅以总剂量60 Gy 的放射治疗[18].
表型为1p/19q联合缺失型间变性少突胶质细胞的肿瘤患者可采取化学治疗,有效延长生存时间,改善预后[19-21].而表型为 1p/19q 联合缺失型含少突胶质细胞的肿瘤患者可受益于术后放疗联合PCV化疗.相比PCV方案,TMZ在患者反应率和生存率方面没有显著差异且毒性更小,耐受性更好[21].目前,TMZ用于间变性脑胶质瘤治疗的临床研究正在进行中.“CODEL”试验旨在探讨放疗联合TMZ化疗是否可延长1p/19q联合缺失型肿瘤的生存时间,并回答放疗联合TMZ化疗在延长患者无进展生存时间(progress free survival,PFS)方面与放疗联合PCV化疗是否有差异的问题[22].“CATNON”试验将显示放疗和TMZ治疗(联合和/或辅助维持治疗)是否优于单纯放疗.对于1p/19q联合缺失型间变性脑胶质瘤可有多种治疗方案:放疗联合PCV化疗,放疗联合TMZ化疗,放疗联合加辅助TMZ化疗,或仅化学治疗(TMZ或PCV).对间变性脑胶质瘤,MGMT启动子甲基化可预测IDH野生型肿瘤对烷化剂的敏感性,但对IDH突变型没有预测价值[23].
此外,IDH野生、1p/19q未联合缺失型间变性少突胶质细胞瘤采用放疗加PCV化疗方案并未优于单纯放疗或化疗,特别是新诊断的1p/19q未联合缺失型间变性脑胶质瘤[22,24-25].NCCN 指南建议新诊断的间变性星形细胞瘤在术后放疗可保守观察,在肿瘤进展后行化学治疗[8].另一项回顾性研究[26]显示,对于IDH突变、1p/19q未联合缺失型肿瘤ATRX表达阳性患者,早期放疗联合PCV治疗有利于患者治疗.
2.3 胶质母细胞瘤治疗 EORTC 26981/NCIC CE3临床试验[18]首次表明新诊断的胶质母细胞瘤患者经放疗联合TMZ治疗可显著提高患者生存率.对于年龄<70岁、新诊断的胶质母细胞瘤患者采取术后放疗同步加辅助TMZ化疗的标准治疗方案.放射治疗通常总剂量为60 Gy,分30次,范围通常包含T1像增强区加T2像和FLAIR像异常区边界外2~3 cm[27].同步TMZ化疗为患者放疗期间接受7 d剂量75 mg/m2化疗;辅助化疗为患者放疗后每28天接受5天剂量为 150~200 mg/m2TMZ 化疗,共 6 个周期[18].多项研究[28-30]表明,MGMT 启动子甲基化预示着患者接受烷化剂治疗生存时间更长.2012年,两项独立的随机对照研究表明替莫唑胺化疗与低分割放疗均可被考虑作为老年胶质母细胞瘤患者的标准治疗方案[31-32].另有研究[33]表明,MGMT 启动子甲基化的肿瘤患者接受化疗后临床预后更佳.NOA-08和Nordic临床试验[34]结果表明,MGMT启动子区甲基化水平应作为常规检测指标.
最近,中国脑胶质瘤基因组图谱计划(Chinese Glioma Genome Atlas,CGGA)报道认为与单纯放疗相比,放疗联合TMZ化疗可显著延长IDH野生型胶质母细胞瘤患者生存时间;而IDH突变型胶质母细胞瘤患者采用这两种方案则无明显差异[35].IDH突变已被作为分子标记物用于继发性胶质母细胞瘤与原发性胶质母细胞瘤的鉴别诊断.这些结果表明,IDH突变和MGMT启动子区甲基化状态可以便于为胶质母细胞瘤患者制定治疗策略.
综上所述,脑胶质瘤“综合诊断”概念的明确为进一步细化诊断不同类型的胶质瘤提供了科学依据及理论参考,而不同类型胶质瘤诊断治疗模式的建立为不同类型胶质瘤患者的个体诊疗计划提供了重要帮助.脑胶质瘤“综合诊断”和诊疗模式能为更精确诊断胶质瘤,制定个体治疗方案提供参考,进而指导日后的临床治疗及科研工作.
[1]Jiang T, Tang GF, Lin Y, et al.Prevalence estimates for primary brain tumors in China: a multi-center cross-sectional study[J].Chin Med J (Engl), 2011,124(17):2578-2583.
[2]Yang P, Wang Y, Peng X, et al.Management and survival rates in patients with glioma in China (2004-2010): a retrospective study from a single-institution[J].J Neurooncol,2013,113(2):259-266.
[3]Hainfellner J, Louis DN, Perry A, et al.Letter in response to David N.Louis et al, international society of neuropathology-haarlem consensus guidelines for nervous system tumor classification and grading, brain pathology[J].Brain Pathol,2014,24(6):671-672.
[4]Reuss DE, Sahm F, Schrimpf D, et al.ATRX and IDH1-R132H immunohistochemistrywith subsequent copy number analysis and IDH sequencing as a basis for an “integrated” diagnostic approach for adultastrocytoma,oligodendroglioma and glioblastoma[J].Acta Neuropathol,2015,129(1):133-146.
[5]Brandner S, von Deimling A.Diagnostic, prognostic and predictive relevance of molecular markers in gliomas[J].Neuropathol Appl Neurobiol,2015,41(6):694-720.
[6]Jiang T,Mao Y,Ma W,et al.CGCG clinical practice guidelines for the management of adult diffuse gliomas[ J].Cancer Lett,2016,375(2):263-273.
[7]Weller M,Pfister SM,Wick W,et al.Molecular neuro-oncology in clinical practice:a new horizon[J].Lancet Oncol,2013,14(9):e370-e379.
[8]Nabors LB, Portnow J, Ammirati M, et al.Central nervous system cancers,Version 1.2015[J].J NatlCompr Canc Netw,2015,13(10):1191-1202.
[9]Soffietti R, Baumert BG, Bello L, et al.Guidelines on management of low-grade gliomas:report of an EFNS-EANO Task Force[J].Eur J Neurol,2010,17(9):1124-1133.
[10]Forst DA, Nahed BV, Loeffler JS, et al.Low-grade gliomas[J].Oncologist,2014,19(4):403-413.
[11]Shaw EG, Berkey B, Coons SW, et al.Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial lowgrade glioma:results of a prospective clinical trial[J].J Neurosurg,2008,109(5):835-841.
[12]Chan MD.Recent technical advances and indications for radiation therapy in low-grade glioma[J].Semin Radiat Oncol,2015,25(3):189-196.
[13]Shaw EG,Wang M,Coons SW,et al.Randomized trial of radiation therapy plusprocarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma:initial results of RTOG 9802[J].J Clin Oncol,2012,30(25):3065-3070.
[14]Fisher BJ, Lui J, Macdonald DR, et al.A phaseⅡ study of a temozolomide-based chemoradiotherapy regimen for high-risk low-grade gliomas: Preliminary results of RTOG 0424[J].2013.
[15]Buckner JC,Pugh SL,Shaw EG, et al.PhaseⅢ study of radiation therapy(RT) with or without procarbazine,CCNU, and vincristine(PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG,and SWOG[J].J Clin Oncol,2014.
[16]Kim J, Lee IH, Cho HJ, et al.Spatiotemporal evolution of the primary glioblastoma genome[J].Cancer Cell,2015,28(3):318-328.
[17]Johnson BE,Mazor T,Hong C,et al.Mutational analysis reveals the origin and therapy-driven evolution of recurrent glioma[J].Science,2014,343(6167):189-193.
[18]Stupp R, Hegi ME, Mason WP, et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
[19]Le Rhun E, Taillibert S, Chamberlain MC.Anaplastic glioma:current treatment and management[J].Expert Rev Neurother,2015,15(6):601-620.
[20]Cairncross G,Wang M,Shaw E,et al.Phase III trial of chemoradiotherapy for anaplasticoligodendroglioma:long-term results of RTOG 9402[J].J Clin Oncol,2013,31(3):337-343.
[21]van den Bent MJ, Brandes AA, Taphoorn MJ, et al.Adjuvant procarbazine,lomustine,and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma:long-term follow-up of EORTC brain tumor group study 26951[J].J Clin Oncol,2013,31(3):344-350.
[22]Wick W, Wiestler B, Platten M.Treatment of anaplastic glioma[J].Cancer Treat Res,2015,163:89-101.
[23]Wiestler B, Capper D, Hovestadt V, et al.Assessing CpG island methylator phenotype,1p/19q codeletion,and MGMT promoter methylation from epigenome-wide data in the biomarker cohort of the NOA-04 trial[J].Neuro-oncology,2014,16(12):1630-1638.
[24]Chamberlain MC.Salvage therapy with lomustine for temozolomide refractory recurrent anaplastic astrocytoma:a retrospective study[J].J Neurooncol,2015,122(2):329-338.
[25]Johnson DR, Galanis E.Medical management of high-grade astrocytoma:current and emerging therapies[J].Semin Oncol, 2014,41(4):511-522.
[26]Cairncross JG,Wang M,Jenkins RB, et al.Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH[J].J Clin Oncol,2014,32(8):783-790.
[27]Laperriere N, Zuraw L, Cairncross G, et al.Radiotherapy for newly diagnosed malignant glioma in adults:a systematic review [J].Radiother Oncol,2002,64(3):259-273.
[28]Hegi ME, Diserens AC, Godard S, et al.Clinical trial substantiates the predictive value of O-6-methylguanine-DNA methyltransferase promoter methylation in glioblastoma patients treated with temozolomide[J].Clin Cancer Res,2004,10(6):1871-1874.
[29]Esteller M, Garcia-Foncillas J, Andion E, et al.Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylatingagents[J].N Engl J Med,2000,343(19):1350-1354.
[30]Herrlinger U,Rieger J, Koch D,et al.PhaseⅠ/Ⅱ trial(UKT-03)of CCNU/temozolomide chemotherapy in addition to radiotherapy as first-line therapy for glioblastoma: Final report[C]//Congress of the European-Association-For-Neuro-Oncology,2006:348-348.
[31]Wick W, Platten M,Meisner C,et al.Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly:the NOA-08 randomised,phase 3 trial[J].Lancet Oncol,2012,13(7):707-715.
[32]Malmström A, Grønberg BH, Marosi C, et al.Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma:the Nordic randomised,phase 3 trial[J].Lancet Oncol,2012,13(9):916-926.
[33]李子为,蔡金全,蒋传路.脑胶质瘤生物学标记物和分子病理分型的研究进展[J].转化医学电子杂志,2017,4(7):21-27,32.
[34]Wick W, Weller M, van den Bent M, et al.MGMT testing--the challenges for biomarker-based glioma treatment[J].Nat Rev Neurol,2014,10(7):372-385.
[35]Yang P,Zhang W,Wang Y,et al.IDH mutation and MGMT promoter methylation in glioblastoma:results of a prospective registry[J].Oncotarget,2015,6(38):40896-40906.
Research advances of integrated diagnosis and treatment model of glioma
DONG Jia-Wei, LI Zi-Wei, CAI Jin-Quan
Harbin Medical University, Harbin 150081, China
As the most common intracranial primary malignant tumor, glioma has the seriously invasive capacity, leading to the unclear boundaries of tumor.The survival time of patients with glioma depends on a variety of clinical factors,such as surgical resection, age of onset, KPS Score, pathologic type and molecular marker alteration.Nowadays, the clinical diagnosis of glioma is based on morphology.Thus, it is difficult to accurately diagnose the pathological type and make a clear guidance for postoperative treatment of the tumor.With the clinical research and scientific progress, the “integrated diagnosis” comes into a new era.It will take advantage in the precise diagnosis,the guiding treatment and the improvement of the survival.It also provide effective help to investigate the pathological types of glioma and the clinical treatment model.Therefore, this review focuses on the “integrated diagnosis” of glioma and its effect on the treatment model, and provides scientific guidance for the future diagnosis and treatment of glioma, improving the prognosis and the quality of life.
glioma; integrated diagnosis; treatment model
脑胶质瘤作为最常见的颅内原发肿瘤,呈浸润性生长,与周围脑组织界限不清.目前脑胶质瘤患者预后取决于多种临床因素,如手术切除范围、发病年龄、KPS评分、病理类型和分子标记物等.当前研究表明,胶质瘤的临床诊断多以形态学为基础,难以准确客观地诊断其病理类型,也不能对患者术后做出明确指导和判断其预后.随着临床研究及科学进展发现,脑胶质瘤“综合诊断”概念的确定及诊断治疗模式的升级对胶质瘤患者的诊疗提供了有效的帮助,研究了胶质瘤关键生物学标记物,探索了脑胶质瘤病理分型以及在明确病理分型后开展的临床治疗模式.本文重点阐述脑胶质瘤“综合诊断”和诊断治疗模式,旨在为今后的胶质瘤临床诊断及治疗提供科学指导,改善患者预后,提高生存质量.
胶质瘤;综合诊断;治疗模式
R739.41
A
2095-6894(2017)12-72-05
2017-07-21;接受日期:2017-08-10
中国抗癌协会神经肿瘤专业委员会神经肿瘤研究基金(CSNO-2016-MSD12);哈尔滨医科大学创新科学研究资助项目(2017LCZX37)
董佳玮.硕士生.E-mail:1770140451@ qq.com
蔡金全.博士,主治医师.研究方向:神经外科.E-mail:caijinquan666777@ 126.com
