清燥救肺汤及其分解剂对肺炎支原体感染小鼠TLR-2/NF-κB信号通路的影响
2018-01-05吴振起贾晓儒敏娜岳志军王雪峰张聪聪
吴振起, 贾晓儒, 敏娜, 岳志军, 王雪峰, 张聪聪
实验论著
清燥救肺汤及其分解剂对肺炎支原体感染小鼠TLR-2/NF-κB信号通路的影响
吴振起, 贾晓儒, 敏娜, 岳志军, 王雪峰, 张聪聪
目的观察清燥救肺汤及其分解剂对肺炎支原体(MP)感染小鼠Toll样受体2(TLR-2)、髓样分化因子88(MyD88)、核因子κB(NF-κB)信号通路的影响,探讨其抗MP的作用机制。方法选择SPF级BALB/c小鼠144只,随机分成正常组、模型组、全方组、分解剂Ⅰ组、分解剂Ⅱ组及阿奇霉素组,每组24只。除正常组其他各组制备MP感染模型,造模成功后予药物灌胃治疗,并于感染后第3、7、10、14天进行取材。采用苏木精-伊红染色观察肺脏病理组织学改变、qPCR方法检测肺组织中TLR-2 mRNA变化、ELISA法检测血清中MyD88、TNF-α的含量及Western blot法检测肺组织NF-κB的表达。结果MP感染后小鼠肺组织出现间质性炎症改变,7 d时炎症最明显,14 d时炎症逐渐减轻;治疗后各组肺部炎症均有改善,尤以第10、14天全方组、阿奇霉素组明显。MP感染后小鼠肺组织中TLR-2、NF-κB表达水平升高,血清中MyD88、TNF-α含量亦升高(P<0.05),各项指标出现峰值的时间不一致,其中NF-κB出现最早(第3天),TLR-2、TNF-α于第7天达峰值,而MyD88则相对较晚,于第10天达峰值。第7天,全方组即起效(P<0.05),肺组织中TLR-2、NF-κB表达水平下降,血清中MyD88、TNF-α含量亦降低;分解剂Ⅰ组在第10、14天亦能发挥类似全方组的作用,但较全方组偏弱(P>0.05);分解剂Ⅱ组在第14天TLR-2 mRNA表达略升高。结论清燥救肺汤抗MP感染的机制与减少促炎因子的释放,调控TLR-2/NF-κB信号通路传导有关,其中分解剂Ⅰ起主要作用。
肺炎支原体; 清燥救肺汤; TLR-2/NF-κB信号通路; 小鼠
肺炎支原体(mycoplasma pneumonia,MP)是临床上常见的一种病原体,其感染引起的肺炎占小儿肺炎的20%左右,在密集人群其发病率则更高[1]。随着研究深入,我们认识到MP感染由多因素所致,其致病机制复杂,目前公认的免疫炎症机制越来越受到人们的关注[2]。Toll样受体(Toll-like receptors,TLRs)作为模式识别受体,通过和病原相关分子的结合,激活天然免疫,同时在机体炎症反应中的固有免疫应答中也起着非常重要的作用。近年来,大量的临床和实验研究证实TLRs在各类炎症动物模型中的表达都有显著的升高[3]。炎症通路TLR-2启动的信号通路既能激活先天免疫,也能调控后天免疫。髓样分化因子88(myeloid differentiation factor 88,MyD88)作为信号通路中的枢纽分子,介导了多种TLRs信号向下游传导,MyD88依赖性反应通路中参与细胞内信号转导的分子有MyD88、肿瘤坏死因子(tumor necrosis factor,TNF-α)等,最终激活核因子κB(nuclear factor kappa-B,NF-κB),而NF-κB的激活是炎症信号转导过程中的重要环节[4]。
MP感染具有燥邪致病特征,前期的研究已证实清燥救肺汤对MP有抑制作用[5]。清燥救肺汤作为治疗燥热伤肺病证的经典方剂,具有甘凉滋润,清金保肺的效用。本研究以法拆方,将具有“清、宣、降”作用的药物如桑叶、石膏、杏仁等作为分解剂Ⅰ,具有“润、补”作用的药物如人参、阿胶、甘草等作为分解剂Ⅱ。通过观察清燥救肺汤及其分解剂对MP感染小鼠TLR-2/NF-κB信号通路的影响以探讨其抗MP的作用机制,为临床治疗提供实验依据。
1 材料与方法
1.1 实验动物与菌株 选SPF级BALB/c小鼠144只,体质量(20±2)g,雌雄各半,购买于辽宁长生生物技术有限公司,生产许可证号:SCXK(辽)2013-0009,使用许可证号:SYXK(辽)2015-0001;MP菌株保存于辽宁中医药大学附属医院病毒室。
1.2 药物及制备 清燥救肺汤全方组、分解剂Ⅰ组与分解剂Ⅱ组中药均购于辽宁中医药大学附属医院门诊药局,相关草药已验视,均为正品。清燥救肺汤全方组:桑叶、石膏、麦冬、人参、阿胶、甘草、杏仁、枇杷叶、胡麻仁;分解剂Ⅰ:桑叶、石膏、杏仁、枇杷叶;分解剂Ⅱ:人参、阿胶、甘草、胡麻仁、麦冬。供试药液的配制:石膏水煎浓缩,阿胶烽化,药液备用;余药用8倍量70%乙醇加热回流提取2次,合并药液,回收溶剂并浓缩,分别制成含生药1、0.61、0.39 g/mL混悬液。阿奇霉素分散片(东北制药厂,批号:4170201),配成6 g/L药液。每组药液分别4 ℃保存备用。
1.3 主要试剂 Trizol总RNA提取试剂(Invitrogen公司);RT-PCR试剂盒、DEPC、DNA marker DL2000(大连宝生物公司);小鼠TNF-α ELISA试剂盒、MyD88 ELISA试剂盒、Phospho-NF-κB P65抗体试剂盒、GAPDH、ECM Ⅱ of Western-blotting检测试剂盒、浓缩型兔IgG二抗(武汉博士德公司)。引物根据文献设计[6],TLR-2,G1:5'-GCC ACC ATT TCC ACG GAC T-3';G2:5'-GGC TTC CTC TTG GCC TGG-3';GAPDH,G1:5'-ACC ACC ATG GAG AAG GCT GG-3',G2:5'-CTC AGT GTA GCC CAG GAT GC-3',扩增特异片段长度为528 bp,由北京六合华大基因合成。
1.4 动物分组及模型建立 144只SPF级BALB/c小鼠按随机数字表法分为正常组、模型组、全方组、分解剂Ⅰ组、分解剂Ⅱ组、阿奇霉素组,每组24只。对各组小鼠进行标记称重。
1.5 MP感染模型制备 用乙醚将小鼠轻度麻醉后,用1 mL注射器缓慢向鼻腔中滴入1×107CCU/mL的MP菌液,每只0.1mL,接种后持小鼠呈45°静置30 s,以利于MP菌液的充分吸入并防止窒息,连续滴鼻3 d,正常组以等量生理盐水处理。
1.6 给药方法 正常组和模型组灌服生理盐水,全方组灌服清燥救肺汤全方,分解剂Ⅰ组灌服清燥救肺汤分解剂Ⅰ,分解剂Ⅱ组灌服清燥救肺汤分解剂Ⅱ,阿奇霉素组灌服阿奇霉素溶液。每日1次,每次0.3 mL,各组均灌服14 d。阿奇霉素组灌药3 d,停药4 d,2个循环,停药期间蒸馏水灌胃。最后一次给药后禁水、禁食4 h。
1.7 标本采集与检测 于造模后第3、7、10、14天采集标本,称量体质量后摘除眼球取血,储存于促凝管中,后放入离心机中以4 000 r/min离心5 min,离心后取上层血清存于EP管中,放入-80 ℃冰箱中冷藏以备ELISA检测。予小鼠进行颈椎脱臼处死,取左肺放入4%多聚甲醛固定液中固定,待做病理切片,病理切片采用苏木精-伊红染色,于光镜下观察;取右肺于EP管中,-80 ℃冷冻以备qPCR、Western blot检测。将各组小鼠肺组织取出,制造细胞悬液,用Trizol提取细胞总RNA。分析RNA的纯度及完整性,检测RNA质量合格后,进行反转录,以反转录产物为模板,加入TLR-2的引物,进行qPCR检测。小鼠MyD88、TNF-α的ELISA试剂盒,检测程序按照试剂盒说明书进行。用总蛋白提取试剂提取总蛋白,离心取上清液,-20 ℃冰箱中保存。BCA蛋白浓度测定试剂盒测定蛋白浓度,用蒸馏水调整到统一浓度,提取液中加入5×SDS上样缓冲液,100 ℃变性10 min,蛋白上样每孔含10 μL,10%SDS-聚丙烯酰胺凝胶电泳分离,转膜30 min,2%牛血清白蛋白室温封闭2 h。一抗室温孵育2 h,4 ℃过夜,TBST缓冲液洗膜3次,每次10 min,二抗室温孵育1 h,TBST缓冲液洗膜3次,每次10 min。ECL发光,Fluor Chem Q蛋白质印迹,成像系统显色。
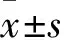
2 结果
2.1 光镜下MP感染小鼠肺组织的病理变化 光镜下观察正常组:气管管壁无充血、水肿,肺泡间隔无增宽,血管无扩张、充血,未见明显的炎性细胞的浸润。模型组:病变区内肺泡间隔明显增宽,血管扩张、充血,间质水肿伴大量炎症细胞浸润;气管管壁及其周围间质充血,可见炎性细胞浸润;符合肺炎病理表现。全方组、阿奇霉素组:造模后第7天肺组织炎症明显吸收;分解剂Ⅰ组、分解剂Ⅱ组出现类似模型组样炎症改变,但个别小鼠出现不同程度改善,第14天后炎症有一定程度的减轻。见图1(封三)。2.2 MP感染小鼠肺组织TLR-2基因表达 MP感染后小鼠肺组织中TLR-2基因表达明显升高,于第7天出现峰值,然后逐渐降低,各时间点均高于正常组,差异有统计学意义(P<0.05);阿奇霉素组肺组织中TLR-2基因表达显著低于模型组,差异有统计学意义(P<0.05)。第3天全方组、分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05);第7天全方组始起效,TLR-2基因表达有所降低(P<0.05),而分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05),第10天分解剂Ⅰ组TLR-2基因表达亦有所降低(P<0.05),但不如全方组显著,差异无统计学意义(P>0.05);分解剂Ⅱ组第14天TLR-2基因表达略升高。见表1。
2.3 MP感染小鼠血清中MyD88含量的比较 见表2。
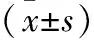
表1 MP感染小鼠肺组织TLR-2 mRNA表达比较
注:与全方组比较,aP<0.05。
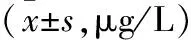
表2 MP感染小鼠血清MyD88的含量比较
注:与全方组比较,aP<0.05。
表2结果表明,MP感染小鼠后小鼠血清中MyD88含量明显升高,于第10天出现峰值,然后逐渐降低,各时间点均高于正常组,差异有统计学意义(P<0.05);阿奇霉素组血清中MyD88含量显著低于模型组,差异有统计学意义(P<0.05)。第3天全方组、分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05);第7天全方组始起效,MyD88有所降低(P<0.05),而分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05),第10、14天分解剂Ⅰ组MyD88含量亦有所降低(P<0.05),但不如全方组显著,差异无统计学意义(P>0.05)。
2.4 MP感染小鼠肺组织NF-κB表达结果 见表3和图2。
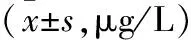
表3 MP感染小鼠肺组织NF-κB表达比较
注:与全方组比较,aP<0.05。
表3结果表明,MP感染后小鼠肺组织中NF-κB明显升高,于第3天出现峰值,然后逐渐降低,各时间点均高于正常组,差异有统计学意义(P<0.05);阿奇霉素组肺组织中NF-κB表达显著低于模型组,差异有统计学意义(P<0.05)。第3天全方组、分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05);第7天全方组始起效,NF-κB有所降低(P<0.05),而分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05),第10、14天分解剂Ⅰ组亦能降低NF-κB表达(P<0.05),分解剂Ⅰ组降低NF-κB表达不如全方组显著,差异无统计学意义(P>0.05)。
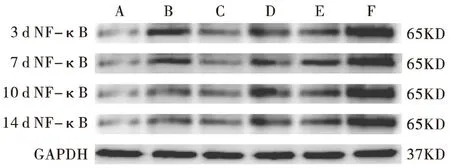
图2 MP感染小鼠肺组织NF-κB表达
2.5 MP感染小鼠血清中TNF-α含量比较 MP感染后小鼠血清中TNF-α含量明显升高,于第7天出现峰值,然后逐渐降低,各时间点均高于正常组,差异有统计学意义(P<0.05);阿奇霉素组血清中TNF-α含量显著低于模型组,差异有统计学意义(P<0.05)。第3天全方组、分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05);第7天全方组始起效,TNF-α有所降低(P<0.05),而分解剂Ⅰ组、分解剂Ⅱ组作用不明显(P>0.05),第10、14天分解剂Ⅰ组TNF-α含量亦有所降低(P<0.05),但其降低不如全方组显著,差异无统计学意义(P>0.05)。见表4。
表4 MP感染小鼠血清TNF-α含量比较
注:与全方组比较,aP<0.05。
3 讨论
MP作为临床上常见的病原体,主要经呼吸道感染,其发病由于MP尖端的P1蛋白黏附于纤毛上皮细胞受体上,分泌毒性物质,破坏上皮细胞,导致黏膜清除功能障碍,且持续时间较长,气道上皮细胞的黏附作用、细胞的毒性作用、免疫炎症等是目前公认的致病机制[7-8]。在细胞免疫研究中人们发现MP与人类的CD4+和Ⅱ类主要组织相容性抗原的氨基酸序列具有同源性,可以产生相应的自身抗体,与组织细胞表面TLR-2和TLR-6结合,激活NF-κB,引起炎症反应,促使淋巴细胞、单核巨噬细胞等免疫细胞凋亡,同时大量免疫因子的消耗也加重了机体免疫功能的损伤[9]。随着研究的不断深入,人们发现TLRS是一种广泛存在于机体的跨膜蛋白,在机体免疫,尤其是感染免疫中具有重要意义,在其信号通路中NF-κB及TNF-α也起了重要的作用。在MP肺炎的免疫炎症反应中,TLRs信号通路发挥了重要的作用[10],它属于模式识别受体,通过识别病原体相关分子模式参与机体的免疫应答,并触发一系列信号转导,进而导致炎性介质的释放,在天然免疫防御中起着重要作用,并最终激活获得性免疫系统。其中TLR-2表达范围最广,识别病原微生物及其产物种类最多。TLR-2识别外源性配体或内源性分子后,将识别信号传递给MyD88接头蛋白。MyD88是该信号通路重要的转接分子,其通路有两条[11]:一是髓样分化蛋白MyD88依赖途径,另一条是非MyD88依赖途径。在MyD88依赖的途径中活化的TLR-2识别相应配体,其胞内TIR结构域与MyD88羧基端相互作用激活MyD88,经由信号分子TRAF6及其他相关蛋白激酶进入下游信号转导,后经激酶磷酸化激活NF-κB通路,诱导炎症细胞因子如白细胞介素6、TNF-α等释放,其中TNF-α是早期炎症反应最具代表性的两个促炎细胞因子之一,在肺内炎症反应中发挥着重要的作用[12]。本研究结果表明MP感染后小鼠肺组织中TLR-2、NF-κB表达升高,血清中MyD88、TNF-α含量也升高,各项指标出现峰值的时间不一致,其中NF-κB出现最早(第3天),TLR-2、TNF-α于第7天达峰值,而MyD88则相对较晚,于第10天达峰值。提示MP感染后TLR-2/NF-κB信号通路被激活,其峰值时间不一致可能由于激活了非MyD88依赖的途径有关。
清燥救肺汤出自清·喻嘉言的《医门法律》,是治“燥”的代表方剂。主治燥热伤肺重证,所主病证的病机为外燥深入肺脏,伤阴耗气,肺失清肃,其疗效无论在实验还是临床中都得到了证实。该方具有宣、清、降、润、补的特性,为明确清燥救肺汤抗MP的机制,根据配伍及功效将其拆分为分解剂Ⅰ(宣、清、降)和分解剂Ⅱ(润、补)。分解剂Ⅰ由桑叶、石膏、杏仁、枇杷叶组成;分解剂Ⅱ由人参、阿胶、甘草、胡麻仁、麦冬组成。本实验中MP感染后小鼠肺组织中TLR-2、NF-κB表达水平升高,血清中MyD88、TNF-α含量亦升高。第7天,全方组即起效;第10天分解剂Ⅰ组亦发挥类似清燥救肺汤全方组的作用,但较清燥救肺汤全方组偏弱;第14天分解剂Ⅱ组TLR-2基因表达水平略升高。这可能与MP感染后激活TLR-2/NF-κB信号通路,活化的TLR-2与MP表面相关蛋白结合,激活抗原提呈细胞,进而调节固有免疫有关。清燥救肺汤全方及其分解剂Ⅰ能够阻断TLR-2/NF-κB信号通路传导,降低细胞因子的水平,而分解剂Ⅱ则效果不显著,可能与药物组成有关。现代药理研究证实分解剂Ⅰ中的石膏具有解热、抗炎等的作用[13];桑叶中主要发挥抗炎的作用[14];枇杷叶中的挥发油、黄酮类等活性成分,具有抗炎、止咳等作用[15];杏仁中的苦杏仁苷以及各种游离氨基酸等,具有镇咳平喘、抗炎止痛等作用[16]。分解剂Ⅱ中的麦冬能提高免疫功能[17];人参中含有的人参皂甙、生物碱、甾醇等物质也能够能增强机体免疫功能[18]。
清燥救肺汤抗MP感染的机制可能与调控TLR-2/NF-κB信号通路传导,减少促炎因子的释放有关,下调该通路上TLR-2、MyD88、NF-κB的表达,降低细胞因子TNF-α含量,其中清燥救肺汤分解剂Ⅰ起主要作用,而清燥救肺汤分解剂Ⅱ效果不明显,具体机制尚待进一步深入研究。
[1] 罗浩荡,游晓星,吴移谋.肺炎支原体致炎的分子机制研究进展[J].免疫学杂志,2017,33(7):639-644.
[2] 余丽丽,赵德育.肺炎支原体肺炎发病机制研究进展[J].中国实用儿科杂志,2017,32(3):234-238.
[3] 董静,施毅,宋勇,等.小鼠感染肺炎衣原体后肺组织TLR2、TLR4基因表达的变化及意义[J].中国感染与化疗杂志,2006,6(2):92-96.
[4] Seya T,Matsumoto M.A lipoprotein family from Mycoplasma fermentans confers host immune activation through Toll-like receptor 2[J].Int J Biochem Cell Biol,2002,34(8):901-906.
[5] 吴振起,刘光华,岳志军,等.清燥救肺汤抗肺炎支原体感染大鼠作用的实验研究[J].中国中西医结合儿科学,2013,5(1):1-4.
[6] 张进祥,吴河水,王慧,等.小鼠肝脏部分缺血再灌注过程中Toll样受体2的激活及意义[J].中国现代医学杂志,2005,5(5):646-648.
[7] 张会敏,马宏.肺炎支原体致病机制的研究进展[J].中国现代医生,2015,53(19):157-160.
[8] 王柯静.小儿肺炎支原体肺炎的研究进展[J].医学综述,2013,19(23):4306-4308.
[9] 徐世军,沈映君.TLR信号途径关键转接分子MyD88的研究进展[J].中华中医药学刊,2007,25(12):2504-2506.
[10]王玉红,张明磊,毛琪,等.肺炎支原体感染对BALB/c小鼠TLR4/NF-κB信号通路表达的影响[J].解剖科学进展,2017,23(3):242-244.
[11]Georgel P,Jiang Z,Kunz S,et al.Vesicular stomatitis virus glycoprotein G activates a specific antiviral Toll-like receptor 4-dependent pathway[J].Virology,2007,362(2):304-313.
[12]董六一,汪春彦,吴常青,等.金荞麦对克雷伯杆菌肺炎大鼠肺组织中TLR2/4 MyD88 mRNA和IκB-α表达的影响[J].中国中药杂志,2011,36(2):200-204.
[13]夏洽思,胡方林.清燥救肺汤石膏用法探讨[J].现代中医药,2015,35(5):127-129.
[14]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:279-280.
[15]郭宇,吴松吉,朴惠善.枇杷叶的化学成分及药理活性研究进展[J].时珍国医国药,2006,17(6):928-929.
[16]王芳.杏仁的现代药理研究及临证应用[J].中国中医药咨讯,2010,2(33):13.
[17]周二付.中药材麦冬的药理作用研究[J].中医临床研究,2017,9(9):125-126.
[18]宋齐.人参化学成分和药理作用研究进展[J].人参研究,2017,29(2):47-54.
InfluenceofQingzaoJiufeidecoctionanditsdecomposableagentonTLR-2/NF-κBsignalpathwayinMPinfectedmice
WUZhenqi,JIAXiaoru,MINNa,YUEZhijun,WANGXuefeng,ZHANGCongcong.
AffiliatedHospitalofLiaoningUniversityofTCM,Shenyang110032,China
ObjectiveTo observe the effect of Qingzao Jiufei decoction (QJD) and its decomposable agent on the toll-like receptors(TLR) 2/myeloid differentiation primary response gene 88 (MyD88) / (NF-κB) signal pathway in MP infected mice,and to explore its mechanism of action of resistance to MP.MethodsTotally 144 BALB/c mice, about 20 g in weight, were randomly divided into normal group(A),model group(B),QJD group(C),QJD decomposable agentⅠgroup(D),QJD decomposable agent Ⅱ group(E) and azithromycin group(F),with 24 mice in each group. Each treatment group was made into MP infection model and the corresponding group was given corresponding drugs by intragastric administration after modeling. The serum and the lung tissues were detected after 3,7,10 and 14 days of MP infection. HE staining was used to observe the pathological change of lung tissues, qPCR was used to detect the changes of TLR-2 mRNA in lung tissues, ELISA was used to detect the expressions of MyD88 and TNF-α in serum, and Western blot was used to detect the expression levels of NF-κB in lung tissues.ResultsThe interstitial inflammatory changes of lung occurred 3d after MP infection,which were most significant on the 7d,and then gradually became less and less significant. Pulmonary inflammation in each treatment group was improved, especially in Group C and Group F on the 10d and 14d. The expression level of TLR-2 and NF-κB in the lung tissue of mice after MP infection increased, and the content of MyD88 and TNF-α in serum was also increased(P<0.05).The peak time of each indicator was different with NF-κB appearing earliest (3rdday),TLR-2 and TNF-α peaking on the 7thday, while MyD88 was relatively late,peaking on the 10thday. On the 7thday in Group C(P<0.05),the expression level of TLR-2 and NF-κB in lung tissue decreased, and the content of MyD88 and TNF-α in serum was also decreased. Group D also played a similar role to Group C on the 10thday and 14thdays, but weaker than Group C (P>0.05); in Group E on the 14thday TLR-2 mRNA expression slightly increased.ConclusionThe mechanism of QJD against MP infection is associated with reducing the release of proinflammatory factors and regulating the conduction of TLR-2/NF-κB signaling pathway,in which the decomposition agent Ⅰ plays a major role.
Mycoplasma pneumoniae; Qingzao Jiufei decoction; TLR-2/NF-κB signal pathway; Mice
国家自然科学基金面上项目(81373687);辽宁省科技厅项目(2014020044)
110032沈阳,辽宁中医药大学附属医院儿科(吴振起,岳志军,王雪峰);110032沈阳,辽宁中医药大学中医儿科学专业研究生(贾晓儒,敏娜,张聪聪)
吴振起(1974-),男,医学博士,主任医师,硕士研究生导师。研究方向:中医药防治感染性疾病
吴振起,E-mail:zhenqiwu@163.com
10.3969/j.issn.1674-3865.2017.06.002
R-332
A
1674-3865(2017)06-0466-06
2017-11-09)
刘颖)
欢迎订阅欢迎投稿
