混合共培养条件下骨髓间充质干细胞与脂肪间充质干细胞成骨性能分析
2018-01-04王小伟高春生晏慧超李勇光
王小伟,高春生,晏慧超,李勇光
(湖北省第三人民医院骨科,湖北 武汉 430033)
实验研究
混合共培养条件下骨髓间充质干细胞与脂肪间充质干细胞成骨性能分析
王小伟,高春生*,晏慧超,李勇光
(湖北省第三人民医院骨科,湖北 武汉 430033)
目的探讨混合共培养条件下骨髓间充质干细胞(bone mesenchymal stem cells,BMSC)和脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSC)成骨分化潜能变化。方法无菌条件下获取BMSC和ADSC,纯化后倒置显微镜下观察细胞形态,对两种细胞分别进行成脂肪诱导、成软骨、成骨诱导,分别利用油红O染色、甲苯胺蓝染色、茜素红染色进行鉴定。实验分四组:A组:BMSC+ADSC未诱导(BMSC︰ADSC=1︰1);B组:BMSC诱导组;C组:ADSC诱导组;D组:BMSC+ADSC诱导组(BMSC︰ADSC=1︰1)。诱导组采用成骨诱导液进行成骨诱导,体外培养14d后Real-time PCR检测骨钙素(osteocalcin,OCN)及Runt相关转录因子2(Runx-2)基因表达情况,以及通过Western-blot法检测OCN及Runx-2蛋白表达情况。结果两种细胞在体外诱导后油红O染色、甲苯胺蓝染色、茜素红染色均为阳性,q-PCR结果显示D组OCN及Runx-2表达量明显高于A、B、C组(P<0.05),Western-blot结果显示OCN及Runx-2蛋白表达量D组明显高于其他三组P<0.05)。结论BMSC与ADSC在体外混合共培养条件下可促进干细胞的成骨性能。
骨髓间充质干细胞;脂肪间充质干细胞;混合培养;成骨潜能
骨髓间充质干细胞(bone mesenchymal stem cells,BMSC)和脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSC)都属于成体干细胞。骨髓作为成体干细胞的来源已经被广泛认知,BMSC具有多向分化潜能,然而BMSC在骨髓中含量极低,仅有0.01~0.001%,并且来源有限[1]。因此,有效提高BMSC在生物工程中的利用率十分必要。而脂肪是近年来研究较为热门的干细胞来源。与骨髓相比,脂肪组织能够通过较小创伤的方法分离并获得数目更多的脂肪来源干细胞[2]。目前关于二者成骨性能已有广泛研究,然而将二者进行接触混合培养条件下观察二者的成骨性能鲜有报道。本实验拟通过将BMSC与ADSC进行接触共培养,观察二者在成骨性能上的变化,以期为组织工程种子细胞的选择提供新的视角。
1 资料与方法
1.1 实验材料 8周龄SD大鼠,雌雄不限,150~200g(上海交通大学动物实验中心提供);低糖Dulbecco氏培养基(Dulbecoo's modified eagle medium,DMEM)(hyclone);hyclone胎牛血清;胰酶、Ⅰ型胶原酶(hyclone);3-异丁基-1-甲基黄嘌呤(millipore),转化生长因子β1(transforming growth factor beta,TGF-β1),碱性磷酸酶,油红O,茜素红(sigma公司),骨钙素(osteocalcin,OCN)一抗,RUNX2一抗(abcam),二抗IgG-HRP(Biosharp BL002A,millipore)。
1.2 原代细胞的提取 按照文献[3]的方法进行原代提取,无菌条件下分别获取大鼠下肢骨以及腹股沟处脂肪组织,贴壁法和酶消化法获取原代细胞,当原代细胞融合至80%时进行传代培养。
1.3 原代细胞的鉴定 根据文献[3],分别将ADSC与BMSC向成脂肪、成软骨、成骨方向诱导,并分别利用油红O染色、甲苯胺蓝染色、茜素红染色鉴定。
1.4 实验分组及成骨诱导 实验分四组,A组:BMSC+ADSC未诱导组;B组:BMSC诱导组;C组:ADSC诱导组;D组:BMSC+ADSC诱导组(BMSC︰ADSC=1︰1)。A组BMSC与ADSC细胞密度均为5.0×104/孔,BMSC︰ADSC=1︰1,普通培养液培养14 d;B、C组细胞密度为1.0×105/孔,进行体外成骨诱导14 d,D组BMSC与ADSC细胞密度均为5.0×104/孔,BMSC︰ADSC=1︰1,成骨诱导液培养14 d。成骨诱导液成分为:10%FBS的DMEM培养液,10 mmol/L β-甘油磷酸钠,0.05 mmol/L维生素C和100 mmol/L地塞米松。
1.5 Real-time PCR检测OCN和Runx2 mRNA表达 14d向各组细胞加入Trizol 试剂提取总RNA,用real time-PCR Kit(Takara 公司)逆转录成cDNA,利用SYBR green I real time PCR Kit(TaKaRa 公司)试剂盒扩增目的基因,引物由上海生工生物工程有限公司合成,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参(见表1)。
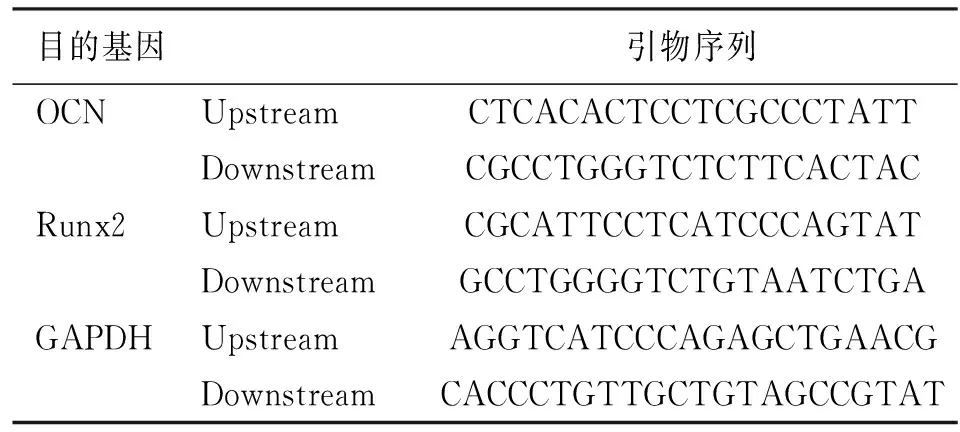
表1 各基因引物序列
1.6 Western blot 法检测成骨特异性蛋白OCN与Runx2蛋白表达 14d后将各组细胞取出,充分研磨,3 mL/g蛋白裂解液充分裂解后,100 00 g离心30 min。BCA法测定总蛋白浓度。分别进行SDS-PAGE电泳,转膜,封闭,一抗孵育过夜,二抗1︰100 00孵育4 h,加入显色剂显色,内参GAPDH。凝胶成像系统成像,Image J软件计算灰度值。相对灰度值=[目的蛋白灰度值/内参GAPDH灰度值]×100%。
2 结 果
2.1 原代细胞形态学观察及细胞鉴定 BMSC原代培养4~6 h后开始贴壁,细胞大小不均匀,起初为多角形,梭形,3 d后类成纤维细胞明显增多,4~5 d细胞进入对数生长期,6~7 d细胞融合接近80%。ADSC原代培养72 h后,细胞形态呈纺锤状或不规则形态;5~8 d后细胞逐渐形成分散的细胞集落,其形态多为成纤维样细胞样。成脂诱导后油红O染色可见红染的脂滴,成软骨诱导后甲苯胺蓝染色可见细胞质蓝染,成骨诱导后茜素红染色可见红色钙化灶(见图1)。
2.2 Real-time PCR检测OCN和Runx2 mRNA表达 为了从分子水平了解混合培养后两种干细胞的成骨性能,本实验利用Real-time PCR检测成骨特异性基因OCN和Runx2 mRNA表达,结果显示,混合培养后D组OCN和Runx2 mRNA表达量明显高于A、B、C组,差异有统计学意义(P<0.05,见表2)。

a BMSC/ADSC原代细胞(倒置相差显微镜,×10)

b BMSC/ADSC成脂肪诱导油红O染色(倒置相差显微镜,×20)

c BMSC/ADSC成软骨诱导甲苯胺蓝染色(倒置相差显微镜,×40)

d BMSC/ADSC成骨诱导茜素红染色(倒置相差显微镜,×10)

表2 Real-time PCR检测的各组OCN和Runx2 mRNA表达比较
2.3 Western blot 法检测成骨特异性蛋白OCN与Runx2蛋白表达 为了解混合培养后两种干细胞诱导成骨后蛋白水平的表达,本实验利用Western blot法检测成骨特异性蛋白OCN和Runx2表达,结果显示,混合培养后D组OCN和Runx2蛋白表达水平明显高于A、B、C组,差异有统计学意义(P<0.05,见表3,见图2)。

表3 Western blot法检测的各组OCN与Runx2蛋白表达比较
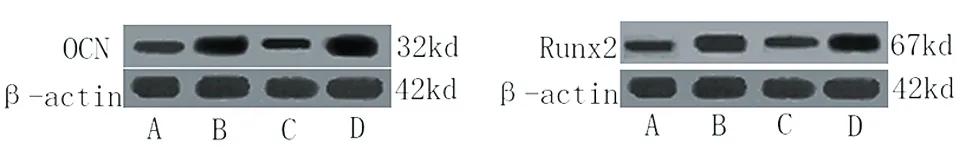
图2 OCN和Runx2蛋白相对表达
3 讨 论
骨缺损导致的畸形是临床上常见难题[4],目前,常用的修复骨缺损方法为自体骨移植和异体骨移植,但都有各自的局限性,如自体骨移植会导致术区创伤,且骨量受限,异体骨移植则可能出现排斥反应[5]。生物工程的出现为骨缺损的修复指明了新的方向,而种子细胞的选择是生物工程技术的关键[6]。骨髓是人们研究最早的成体干细胞来源之一,骨髓间充质干细胞来源于骨髓并且具有多向分化潜能,然而BMSC在骨髓中含量很低,仅有0.01%~0.001%,并且需要进行有创方法才能获取骨髓组织,无疑加重了患者的承受负担[1]。因此,有效提高BMSC在生物工程中的利用率十分必要。而脂肪是近年来研究较为热门的干细胞来源。与骨髓相比,脂肪组织能够通过较小创伤的方法分离并获得数目更多的脂肪来源干细胞。已有研究表明,BMSC在目前所知的成体干细胞领域具有更高的成骨能力[3],然而如何提高BMSC的成骨效率目前仍鲜有研究报道。
间充质干细胞(mesenchymal stem cells,MSC)具有多向分化潜能,研究表明,MSC可向成骨细胞、软骨细胞、神经细胞、肝细胞等多种终末分化细胞分化[7]。本实验通过提纯后将两种原代细胞分别进行成脂肪、成软骨和成骨诱导,分别进行油红O染色、甲苯胺蓝染色和茜素红染色,结果发现两种细胞在成脂肪诱导条件下可转换成脂肪细胞,成软骨诱导后甲苯胺蓝染色阳性,而成骨诱导后可生成钙化灶,提示BMSC与ADSC具有多向分化潜能。
OCN由成骨细胞合成与分泌,是骨细胞外基质最主要的非胶原蛋白并参与骨质形成[8-9]。而且间充质干细胞成骨诱导后也有OCN受体的表达[10]。OCN作为成体干细胞向软骨细胞/成骨细胞样细胞分化的矿化指标,参与骨细胞的矿化,并可能在骨质形成过程中调节晶体生长[11]。本实验通过研究发现,通过将BMSC与ADSC混合共培养并进行成骨后,其OCN mRNA表达量明显提高,为了从蛋白水平观察二者成骨效果,本实验利用Wstern blot法检测OCN蛋白水平,发现混合培养后两种细胞OCN表达量明显高于其他三组,展现了更好的成骨能力。
Runx2是成骨细胞(osteoblast,OB)分化必需的转录因子,调控多种与成骨和成牙本质相关基因的表达[12]。并且,Runx2是成骨分化特异性转录因子,能提高前成骨细胞、软骨细胞中与矿化相关蛋白的基因转录,使其向成骨细胞分化[13]。因此,Runx2的表达是成骨细胞开始分化的标志,诱导MSC骨向分化。此外,有研究显示,Runx2基因的缺失将导致骨发育不良或终止[14-15]。相对高表达的Runx2也可促进新生成骨细胞的分泌和成熟,Benson等[16]研究发现,Runx2基因与成骨细胞特异顺式作用元件(osteoblast-specific cis-acting element,OSE)结合后可激活骨钙蛋白(osteocalcin)、骨桥素(osteopontin)、骨涎蛋白(bonesialopmtein)以及I型胶原(Type Ⅰ collagen)基因的转录和表达。本实验通过研究发现,通过将BMSC与ADSC混合共培养并进行成骨后,其Runx2 mRNA表达量明显提高,为了从蛋白水平观察二者成骨效果,本实验利用Wstern blot法检测Runx2蛋白水平,发现混合培养后两种细胞Runx2表达量明显高于其他三组,提示混合培养后两种间充质干细胞具有更好的成骨分化潜能。
综上所述,将BMSC与ADSC混合共培养后,其OCN和Runx2基因和蛋白水平明显提升,较单种成体干细胞具有更高的成骨潜能,为生物工程种子细胞的选择提供了新的思路。
[1]Chen K,Zhou Z,Zhou B,et al.Potential therapeutic effect of paracrine factors from bone marrow-derived mesenchyme stem cells in the treatment of severe acute pancreatitis[J].Shengwu Yixue Gongchenxue Zazhi,2015,32(1):245-248.
[2]Combellack EJ,Jessop ZM,Naderi N,et al.Adipose regeneration and implications for breast reconstruction:update and the future[J].Gland Surg,2016,5(2):227-241.
[3]Yoshimura H,Muneta T,Nimura A,et al.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium,periosteum,adipose tissue,and muscle[J].Cell Tissue Res,2007,327(3):449-462.
[4]Rozalia Dimitriou,George I Mataliotakis,Giorgio Maria Calori,et al.The role of barrier membranes for guided bone regeneration and restoration of large bone defects:current experimental and clinical evidence[J].BMC Med,2012,10(7):81.
[5]Bushra Kamal,David Russell,Anthony Payne,et al.Biomechanical properties of bone in a mouse model of Rett syndrome[J].Bone,2015,71(2):106-114.
[6]Tanaka S.Mechanical strength and mechano-compatibility of tissue-engineered bones[J].Clin Calcium,2016,26(1):93-98.
[7]Ralf Hass,Cornelia Kasper,Stefanie Böhm,et al.Different populations and sources of human mesenchymal stem cells (MSC):A comparison of adult and neonatal tissue-derived MSC[J].Cell Commun Signal,2011,9(5):12.
[8]Zhang W,Zhang X,Ling J,et al.Proliferation and odontogenic differentiation of BMP2 gene?偉ctransfected stem cells from human tooth apical papilla:an in vitro study[J].Int J Mol Med,2014,34(4):1004-1012.
[9]Cui CY,Bo Y,Chen G,et al.Research on the effect of extract of dentin matrix on the differentiation of dental pulp cells[J].Sichuan Daxue Xuebao Yixuban,2013,44(4):657-661.
[10]Matsuoka K,Matsuzaka K,Yoshinari M,et al.Tenascin-C promotes differentiation of rat dental pulp cells in vitro[J].Int Endod J,2013,46(1):30-39.
[11]Papagerakis P,Berdal A,Mesbah M,et al.Investigation of osteocalcin,osteonectin,and dentin sialophosphoprotein in developing human teeth[J].Bone,2002,30(2):377-385.
[12]Zhao Z,Liu HC,Huang ZN,et al.The effect of different factors on forming-dentin differentiation of rat dental mesenchymal cells[J].Shanghai Kouqiang Yi xue,2014,23(6):661-668.
[13]Miyazaki T,Baba TT,Mori M,et al.Microtubule-associated protein tau (Mapt) is expressed in terminally differentiated odontoblasts and severely down-regulated in morphologically disturbed odontoblasts of Runx2 transgenic mice[J].Cell Tissue Res,2015,361(2):457-466.
[14]Zhen Liu,Xiao Yao,Guang Yan,et al.Mediator MED23 cooperates with RUNX2 to drive osteoblast differentiation and bone development[J].Nat Commun,2016,7(4):11149.
[15]Vimalraj S,Arumugam B,Miranda PJ,et al.Runx2:Structure,function,and phosphorylation in osteoblast differentiation[J].Int J Biol Macromol,2015,78(4):202-208.
[16]Benson MD,Bargeon JL,Xiao G,et al.Identification of a homeodomain binding element in the bone sialoprotein gene promoter that is required for its osteoblast-selective expression.J Biol Chem,2000,275(18):13907-13917.
OsteogenicDifferentiationCapacityofMixedCulturedBoneMarrowMesenchymalStemCellsandAdipose-derivedMesenchymalStemCells
Wang Xiaowei,Gao Chunsheng,Yan Huichao,et al
(Orthopedics Department,Third People's Hospital of Hubei Province,Wuhan 430033,China)
ObjectiveTo assess the osteogenic differentiation in the condition of co-culture of BMSC and ADSC.MethodsADSC and BMSC obtained under sterile conditions.Oil red O was used to identify two cells after being induced into fat.Toluidine blue staining was used to identify two cells after being induced into Chondrocytes.Alizarin red staining were used in osteogenic induction group.Osteogenic induction group was divided into four sub-groups,group A:BMSC+ADSC uninduced group(BMSC:ADSC=1︰1);group B:BMSC induced group;group C:ADSC induced group;group D:BMSC+ADSC induced group(BMSC:ADSC=1︰1).OCN and RUNX2 mRNA expression were detected by qPCR after osteogenic induction for 14 days,while the protein expression of OCN and RUNX2 were tested by Western blot at the same time.ResultsOil red O staining,Toluidine blue staining and Alizarin red staining showed positive results.The mRNA expression and protein expression of OCN and RUNX2 were significiantly higher than the other three groups after osteogenic induction for 14 days in vitro.ConclusionThe ability of osteogenic potential strengthened to some extent under the condition of co-culturing.
bone mesenchymal stem cells;adipose-derived mesenchymal stem cells;co-cultured;osteogenic potential
湖北省科技计划项目(2013CKB030);*本文通讯作者:高春生
王小伟,高春生,晏慧超,等.混合共培养条件下骨髓间充质干细胞与脂肪间充质干细胞成骨性能分析[J].实用骨科杂志,2017,23(11):1091-1094.
1008-5572(2017)12-1091-04
R329.5
A
2017-05-09
王小伟(1976- ),男,主治医师,湖北省第三人民医院骨科,430033。
