CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰生长和营养成分的影响
2018-01-04姜丽娜和淑琪桂富荣
可 芮,岳 英,李 胜,姜丽娜,郭 晋,和淑琪,桂富荣,3*
(1.云南农业大学植物保护学院,昆明 650201;2.云南省农业环境保护监测站,昆明 650034;3.云南省高原特色农业产业研究院,昆明 650201)
CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰生长和营养成分的影响
可 芮1,岳 英2,李 胜1,姜丽娜1,郭 晋2,和淑琪1,桂富荣1,3*
(1.云南农业大学植物保护学院,昆明 650201;2.云南省农业环境保护监测站,昆明 650034;3.云南省高原特色农业产业研究院,昆明 650201)
利用人工气候箱设置两种CO2浓度(400 μL/L和800 μL/L),在释放和未释放天敌泽兰实蝇两种情况下测定了紫茎泽兰的生长状况和营养成分。结果表明,在两种CO2浓度下泽兰实蝇的寄生均可抑制紫茎泽兰的生长,但不同CO2浓度下生长的紫茎泽兰株高、茎直径、节间距和各营养成分含量存在差异。在相同的寄生强度下,800 μL/L CO2浓度下生长的紫茎泽兰比400 μL/L CO2浓度下生长的紫茎泽兰的株高、节间距和茎直径分别增加了31.74%、6.70%和9.84%;CO2浓度倍增条件下泽兰实蝇的寄生导致紫茎泽兰的游离氨基酸和淀粉含量显著降低(P<0.01),分别较对照降低了25.81%和11.76%;在800 μL/L CO2浓度下紫茎泽兰形成的虫瘿和羽化出下一代泽兰实蝇的数量也显著低于400 μL/L CO2浓度下的处理植株,说明CO2浓度倍增条件下泽兰实蝇对紫茎泽兰的抑制效果减弱。研究结果可为预测全球气候变化下泽兰实蝇对紫茎泽兰的控制效应提供理论依据。
CO2浓度;紫茎泽兰;泽兰实蝇;营养物质
紫茎泽兰AgeratinaadenophoraSprengel原产于墨西哥,约20世纪40年代传入我国,现已广泛分布于我国西南地区(万方浩等,2011),严重破坏了入侵地的生物多样性和生态系统完整性(桂富荣等,2012)。泽兰实蝇ProcecidocharesutilisStone是紫茎泽兰的专食性天敌昆虫,美国、澳大利亚、新西兰和印度等国家利用该虫控制紫茎泽兰,并取得了一定效果(Rahmanetal.,1991)。20世纪80年代,我国首次将尼泊尔一带进入西藏边境地区的泽兰实蝇引种到云南,成功定殖后又引至四川、贵州等地,现已在紫茎泽兰分布的各省区形成了自然种群(李爱芳等,2006)。
全球气候变化是人类面临的重大环境问题,而大气中CO2浓度的不断升高是引起气候变化的一个主要原因(Sunetal.,2011)。据联合国政府气候变化专门委员会(Intergovernmental Panel on Climate Change,IPCC)报道,当前大气CO2浓度已在400 μL/L左右,预计到本世纪末将达到倍增水平(800 μL/L左右),并会继续增长下去(Mastrandreaetal.,2011)。CO2是植物生存的基础,其浓度的升高不仅会影响植物的生长发育,还会引起植物可溶性蛋白和游离氨基酸等营养成分含量的变化(Peuelasetal.,2002),导致植食性昆虫与寄主植物的相互关系发生变化(Taubetal.,2008)。本研究测定CO2浓度倍增条件下,被泽兰实蝇寄生的紫茎泽兰植株生长特性和营养成分(可溶性蛋白、可溶性糖、游离氨基酸和淀粉)的变化情况,研究结果可为深入研究泽兰实蝇对紫茎泽兰的控制效果提供依据。
1 材料与方法
1.1 试验材料
1.1.1人工气候箱的设置
设置RXZ智能型人工气候箱(上海三腾仪器LTC-1000):温度为25℃,相对湿度为75%,光周期为L ∶D=16 h ∶8 h,光强为20000 xL。实验设置2个大气CO2浓度水平,即对照(400 μL/L,当前大气CO2浓度水平)和倍增CO2浓度(800 μL/L,预计本世纪末大气CO2浓度水平)。
1.1.2供试虫源
从云南农业大学后山及其周围撂荒地采集野外的泽兰实蝇种群,采摘带有虫瘿的枝条(长约15 cm),在枝条根部包裹蘸水的脱脂棉团,放置在八角瓶内带回实验室置于光照培养箱(温度25℃,相对湿度75%,光周期L ∶D=16 h ∶8 h)中待其羽化。在养虫笼内放入盆栽的紫茎泽兰植株,把收集到的泽兰实蝇成虫放进笼内,繁殖3代以上,以保证供试虫源来自相同的种群。
1.1.3供试紫茎泽兰植株
紫茎泽兰种子采于云南省昆明市盘龙区落索坡村的野外自然生长的紫茎泽兰种群,阴干后用牛皮纸袋保存备用,播种前用3%的KMnO4溶液浸泡消毒1 h。所用土壤为南方红壤,事先把土壤混匀并分装于保鲜袋中,用LT-CPS立式压力蒸汽灭菌锅(立德泰勀科学仪器有限公司)104℃灭菌20 min,杀灭土壤中自带的病菌和虫卵。在白瓷盘内放入3 cm深的灭菌土,散播紫茎泽兰种子,置于光照培养箱内,待种子发芽。幼苗约5 cm高时,选取长势一致的幼苗40株分别移栽到40个小花盆(d×h=12 cm×10 cm)内。两种不同CO2浓度的人工气候箱中各放20盆,并用50目的尼龙纱网罩住,防止害虫为害,并适时浇水,不施任何肥料。
1.1.4接入泽兰实蝇
把40盆紫茎泽兰植株平均分为4个组,在CO2浓度400 μL/L下A组(泽兰实蝇寄生组)和B组(未寄生组),在CO2浓度800 μL/L下C组(泽兰实蝇寄生组)和D组(未寄生组)。待植株平均株高为10 cm时,同时在A组和C组的每盆植株的纱网中接入1对新羽化已交配的泽兰实蝇成虫。植株正常管理,泽兰实蝇不取出。
1.2 试验方法
1.2.1不同处理下紫茎泽兰生长状况的测定
在下一代泽兰实蝇开始羽化时,用直尺和游标卡尺分别测量A、B、C、D各组紫茎泽兰植株的株高、节间距和茎直径。
1.2.2不同处理下紫茎泽兰叶片组织营养成分的测定
在下一代泽兰实蝇开始羽化时,分别取A、B、C、D各组紫茎泽兰植株中部叶片组织,测定其可溶性糖、可溶性蛋白、游离氨基酸和淀粉含量。具体步骤参考钱蕾等(2015)的方法:可溶性糖和淀粉含量的测定采用蒽酮法,可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法,游离氨基酸含量的测定采用茚三酮染色法。各处理下营养成分的测定重复5次。
1.2.3CO2浓度倍增条件下紫茎泽兰形成的虫瘿数
观察和记录两种CO2浓度下,被泽兰实蝇寄生的紫茎泽兰植株形成的虫瘿数。
1.2.4CO2浓度倍增条件下泽兰实蝇下一代的数量
每天收集A组和C组中新羽化出的泽兰实蝇,鉴别雌雄并统计数量,比较分析两种CO2浓度下羽化出的泽兰实蝇数量。
1.3 数据处理方法
采用Excel 2003和SPSS 22.0数据分析软件进行数据处理,利用独立样本t检验分析当前CO2浓度和倍增CO2浓度下,被泽兰实蝇寄生和未被寄生的紫茎泽兰各生长指标及寄生后形成虫瘿数的差异显著性;利用单因素方差分析比较不同CO2浓度下,寄生和未被寄生的紫茎泽兰各营养成份及泽兰实蝇F1代成虫(雌、雄)羽化数量之间的差异。
2 结果与分析
2.1 CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰生长状况的影响
从紫茎泽兰种子开始播种到最后测定各组不同处理下的生长状况共历时170 d。由表1可知,在CO2浓度倍增条件下,紫茎泽兰的株高比对照增加了6.17%,节间距增加了8.18%,茎直径增加了13.89%,说明800 μL/L CO2浓度下的紫茎泽兰的长势优于400 μL/L CO2浓度下的紫茎泽兰。比较相同CO2浓度下寄生与未被寄生紫茎泽兰的生长情况发现,当前CO2浓度下生长的紫茎泽兰的株高降低了23.88%,节间距减少了2.21%,茎直径减少了2.34%;倍增CO2浓度下生长的紫茎泽兰的株高降低了5.24%,节间距减少了3.98%,茎直径减少了3.00%,说明泽兰实蝇的寄生使紫茎泽兰生长受到抑制,且对株高的影响特别明显。在相同的寄生强度下,倍增CO2浓度下生长的紫茎泽兰比400 μL/L CO2浓度下生长的紫茎泽兰株高增加了31.74%,节间距增加了6.70%,茎直径增加了9.84%,说明在CO2浓度倍增条件下泽兰实蝇对紫茎泽兰生长的抑制效应降低。

表1 CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰生长状况的影响
注:表中数据为平均数±标准误,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同。Note: Data in the table are mean±SE.*indicates significant difference at the 0.05 level,**indicates significant difference at the 0.01 level. The notes in the following table were the same as in table 1.
2.2 CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰营养成分的影响
泽兰实蝇的寄生可导致紫茎泽兰的营养成分发生变化(表2)。当CO2浓度为400 μL/L时,泽兰实蝇的寄生仅导致紫茎泽兰可溶性糖和可溶性蛋白含量显著降低(P<0.01),其可溶性糖、可溶性蛋白、游离氨基酸含量分别降低了8.19%、41.49%和4.00%,淀粉含量没有变化;当CO2浓度为800 μL/L时,泽兰实蝇的寄生导致紫茎泽兰各营养成分的含量均降低,可溶性糖、可溶性蛋白、游离氨基酸和淀粉分别降低了13.87%、18.00%、25.81%和11.76%(P<0.01)。说明CO2浓度倍增条件下泽兰实蝇的寄生导致紫茎泽兰的游离氨基酸和淀粉含量发生了显著改变。
CO2浓度升高对紫茎泽兰的营养成分具有不同程度的影响。在未被寄生的情况下,CO2浓度倍增使可溶性糖、可溶性蛋白、游离氨基酸和淀粉分别增加了1.17%、6.38%、24.00%和9.68%,其中游离氨基酸和淀粉含量显著增加(P<0.05),说明高CO2浓度有利于紫茎泽兰植株营养合成。在被寄生的情况下,CO2浓度倍增使可溶性糖、游离氨基酸和淀粉分别降低了5.10%、4.17%和3.23%,但可溶性蛋白增加了49.09%(P<0.01),说明在高CO2浓度下泽兰实蝇的取食使紫茎泽兰的营养成分含量发生改变。

表2 两种CO2浓度下泽兰实蝇寄生对紫茎泽兰营养成分的影响
注:不同字母表示同一种营养成分在4种不同处理下经邓肯氏多重比较检验分析差异显著(P<0.05)。Note: Different letters indicate significant difference among four treatments for the same nutrition by Duncan’s multiple range test (P<0.05).
2.3 不同CO2浓度条件下紫茎泽兰形成的虫瘿数量
当CO2浓度为400 μL/L时,每株紫茎泽兰可以形成1-4个虫瘿,平均2.1个;当CO2浓度为800 μL/L时,每株紫茎泽兰可以形成0-2个虫瘿,平均0.8个,两者差异极显著(P<0.01,图1)。可见,相同的泽兰实蝇寄生强度下,在倍增CO2浓度下生长的紫茎泽兰形成的虫瘿数明显比对照少。

图1 两种CO2浓度条件下紫茎泽兰形成的虫瘿数比较Fig.1 Number of galls on Ageratina adenophora under two CO2 concentrations
2.4 不同CO2浓度条件下羽化出下一代泽兰实蝇的数量
当CO2浓度为400 μL/L时,平均每株紫茎泽兰羽化出4.60头雌虫和4.20头雄虫,平均每个虫瘿羽化出4.19头成虫,雌雄比为1.10 ∶1.00;当CO2浓度为800 μL/L时,平均每株紫茎泽兰羽化出1.50头雌虫和1.40头雄虫,平均每个虫瘿羽化出3.63头成虫,雌雄比为1.07 ∶1.00。可见,两种CO2浓度下羽化出的成虫数量差异显著(P<0.05),在当前CO2浓度下单个虫瘿羽化出的成虫数量更多,但雌雄比差异不大(图2)。
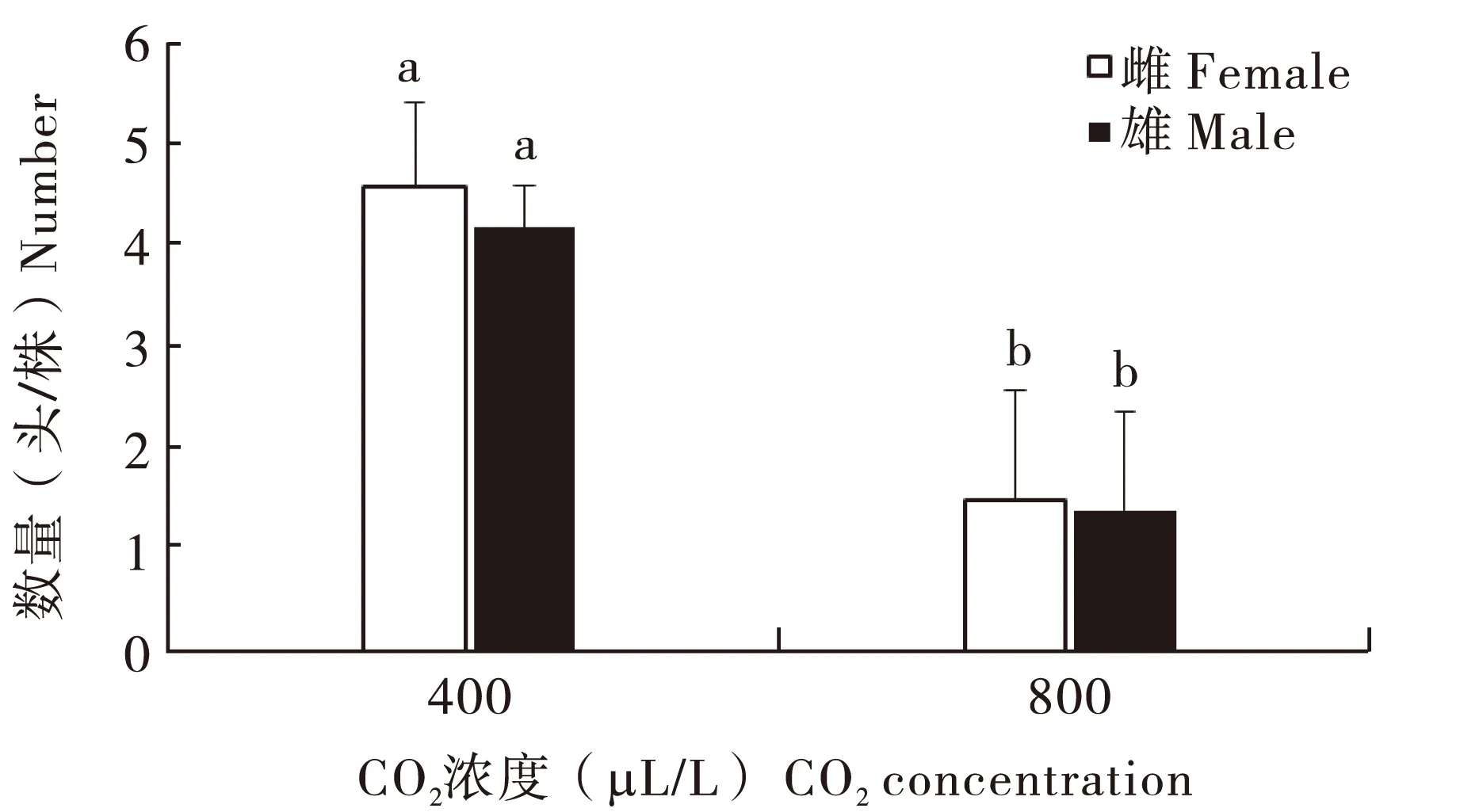
图2 两种CO2浓度条件下羽化出下一代泽兰实蝇的数量Fig.2 Number of F1 generation of Procecidochares utilis under two CO2 concentrations注:不同字母表示在两种CO2浓度下差异显著(P<0.05)。Note: Different letters indicate significanty difference at P<0.05.
3 结论与讨论
CO2是植物进行光合作用的必需物质,大气CO2浓度升高,对一些入侵植物来说是增加了一类重要的可用资源(万方浩等,2015)。本试验通过测定当前和倍增大气CO2浓度下,被泽兰实蝇寄生的紫茎泽兰植株生长状况,发现在高CO2浓度下生长的紫茎泽兰植株的株高、茎直径和节间距均高于对照;泽兰实蝇的寄生使紫茎泽兰的生长受到不同程度的抑制,但在低CO2浓度下的抑制效果更加明显。由此可见,紫茎泽兰能够很好地利用升高的CO2浓度,使植株生长得更加健壮。有研究表明,CO2浓度升高可提高植物的光合速率和生物量,植物气孔的张开度缩小或部分关闭,导致蒸腾作用减弱、水分散失减少,由此促进土壤湿度的提高(万方浩等,2015)。而紫茎泽兰具有阳性偏阴的生态习性,因此在高CO2浓度下生长的植株长势更好,与实验结果一致。
测定不同处理下紫茎泽兰营养成分的变化情况结果表明,在高CO2浓度下生长的紫茎泽兰各营养成分含量均高于对照,与钱蕾等(2015)测定高CO2浓度下生长的四季豆营养成分显著提高的研究结果一致。在被泽兰实蝇寄生时,两种CO2浓度下生长的紫茎泽兰的各营养成分均不同程度地降低,与李艳艳等(2013)研究寄主植物叶片中可溶性糖和可溶性蛋白含量在被瓜蚜危害之后显著降低的结果一致。
在高CO2浓度下生长的紫茎泽兰各营养成分均高于对照,但在泽兰实蝇寄生后高CO2浓度下的紫茎泽兰可溶性糖、游离氨基酸和淀粉的含量都低于对照,而可溶性蛋白含量却显著高于对照。这也许是紫茎泽兰在被天敌取食时通过改变自身营养物质的合成来抵御昆虫取食的一种防御策略,并且在高CO2浓度下紫茎泽兰的自身营养物质含量发生了改变。外来物种竞争力增强进化假说认为,许多入侵植物确实能通过资源配置转变来增强竞争力(Colauttietal.,2004),通过形态和生理等特征的变化表现出来的适应性就是表型可塑性(Richardsetal.,2006),能够使入侵种群的生长量超过原产地种群(万方浩等,2015)。本研究结果显示,在相同的寄生强度下,高CO2浓度下生长的紫茎泽兰形成的虫瘿数和羽化出的子一代成虫数量都显著低于对照。雷桂生等(2014)研究发现,被泽兰实蝇寄生后紫茎泽兰叶片丙二醛、脯氨酸含量与超氧化物歧化酶、过氧化物酶、过氧化氢酶比活力等均明显升高。当有泽兰实蝇寄生的时候,选择压力使得对有限的生物资源进行再分配,将生长和繁殖的生物资源转移到应对抵御天敌上来,因此紫茎泽兰的生长就受到了抑制,同时改变自身营养物质和次生代谢产物的合成情况来抵抗天敌,这可能是紫茎泽兰能够成功入侵的原因之一。
从本研究结果来看,在未来高CO2浓度的环境中,紫茎泽兰会生长得更加茂盛,而泽兰实蝇寄生对紫茎泽兰的控制力会减弱。此外,泽兰实蝇被寄生蜂寄生也是导致其对紫茎泽兰控制效应降低的一个原因,王志飞等(2007)调查云南省昆明市紫茎泽兰虫瘿,发现泽兰实蝇被6种重寄生蜂寄生,重寄生率高达70%以上;我们在野外采集紫茎泽兰虫瘿的过程中,也发现泽兰实蝇的重寄生率高达72.92%,极高的重寄生率导致泽兰实蝇的自然种群数量受到抑制,从而致使利用泽兰实蝇防治紫茎泽兰效果不佳。但本试验仅仅是对一代泽兰实蝇对紫茎泽兰的寄生进行了研究,控制效能还需要经过更长期的实验观察,环境—植物—昆虫是非常复杂的系统,还需要进一步从各个方面研究它们之间的相互关系。
)
Colautti RI, Ricciardi A, Grigorovich IA,etal. Is invasion success explained by the enemy release hypothesis? [J].EcologyLetters, 2010, 7 (8): 721-733.
Gui FR, Jiang ZL, Wang R,etal. Distribution and regional sustainable management strategies ofAgeratinaadenophorain China [J].GuangdongAgriculturalSciences, 2012, 39 (13): 93-97. [桂富荣, 蒋智林, 王瑞, 等. 外来入侵杂草紫茎泽兰的分布与区域减灾策略[J]. 广东农业科学, 2012, 39 (13): 93-97]
Lei GS, Jiang ZL, Deng DD,etal. The effect of parasitism byProcecidocharesutilison the growth and physiological response ofAgeratinaadenophora[J].JournalofPuerUniversity, 2014, 30 (3): 1-5. [雷桂生, 蒋智林, 邓丹丹, 等. 泽兰实蝇寄生对紫茎泽兰生长的影响及其生理响应[J]. 普洱学院学报, 2014, 30 (3): 1-5]
Li AF, Gao XM, Dang WG,etal. Parasitism ofProcecidocharesutilisand its effect on growth and reproduction ofEupatoriumadenophorum[J].JournalofPlantEcology, 2006, 30 (3): 496-503. [李爱芳, 高贤明, 党伟光, 等. 泽兰实蝇寄生状况及其对紫茎泽兰生长与生殖的影响[J]. 植物生态学报, 2006, 30 (3): 496-503]
Li YY, Zhou XR, Pang BP,etal. Influences ofAphisgossypiiGlover feeding on the contents of main nutrients and secondary compounds in host plants [J].JournalofEnvironmentalEntomology, 2013, 35 (1): 49-54. [李艳艳, 周晓榕, 庞保平, 等. 瓜蚜为害对寄主植物主要营养物质和次生物质的影响[J]. 环境昆虫学报, 2013, 35 (1): 49-54]
Mastrandrea MD, Mach KJ, Plattner GK,etal. The IPCC AR5 guidance note on consistent treatment of uncertainties: A common approach across the working groups [J].ClimaticChange, 2011, 108 (4): 675-691.
Qian L, Jiang XC, Liu JY,etal. Effect of elevted CO2concentration on development of the western flower thrips,Frankliniellaoccidentalis(Thysanoptera: Thripidae) and nutrients of their host plant,Phaseolusvulgaris[J].ChineseJournalofEcology, 2015, 34 (6): 1553-1558. [钱蕾, 蒋兴川, 刘建业, 等. 大气CO2浓度升高对西花蓟马生长发育及其寄主四季豆营养成分的影响[J]. 生态学杂志, 2015, 34 (6): 1553-1558]
Rahman O, Agarwal ML. Biological control of crofton weed (Eupatorinm adenophorem Spreng) by a fruit flyPocecidocharesutilisStone in eastern Himalayas [J].Weedsciencek, 1991, 22 (1-2): 98-101.
Richards CL, Oliver B, Muth NZ,etal. Jack of all trades, master of some? On the role of phenotypic plasticity in plant invasions [J].EcologyLetters, 2006, 9 (8): 981-993.
Sun YC, Yin J, Chen FJ,etal. How does atmospheric elevated CO2affect crop pests and their natural enemies? Case histories from China [J].InsectScience, 2011, 18 (4): 393-400.
Taub DR, Miller B, Allen H. Effects of elevated CO2on the protein concentration of food crops: A meta-analysis [J].GlobalChangeBiology, 2008, 14 (3): 565-575.
Wan FH, Hou YP, Jiang MX. Invasion Biology [M]. Beijing: Science Press, 2015, 6: 108-109. [万方浩, 侯有明, 蒋明星. 入侵生物学[M]. 北京: 科学出版社, 2015, 6: 108-109]
Wan FH, Liu WX, Guo JY,etal. Invasive mechanism and control strategy ofAgeratinaadenophora(Sprengel) [J].ScienceChinaLifeScience, 2011, 41 (1): 13-21. [万方浩, 刘万学, 郭建英, 等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学: 生命科学, 2011, 41 (1): 13-21]
Wang ZF, Li BP.Parasitism of native parasitoids onProcecidocharesutilisStone (Tephritidae, Diptera), a biocontrol agent against the invasive exotic weedEupatoriumadenophorumSpreng (Compositae) in southwest China [J].ChineseJournalofBiologicalControl, 2007, 23 (2): 115-118. [王志飞, 李保平. 本土寄生蜂对移殖天敌昆虫泽兰实蝇的寄生[J]. 中国生物防治, 2007, 23 (2): 115-118]
TheeffectsofProcecidocharesutilisparasitismongrowthandnutritionofAgeratinaadenophoraunderdoubledCO2concentration
KE Rui1, YUE Ying2, LI Sheng1, JIANG Li-Na1, GUO Jin2, HE Shu-Qi1, GUI Fu-Rong1,3*
(1. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China; 2. Yunnan Agri-environmental Protection and Monitoring Center, Kunming 650034, China; 3. Yunnan Plateau Characteristic Agriculture Industry Research Institute, Kunming 650201, China)
The growth and nutrition ofAgeratinaadenophorawere measured under two CO2concentrations (400 μL/L VS 800 μL/L) with presence and absence of its natural enemy,Procecidocharesutilis. The results showed that the growth ofA.adenophorawas inhibited withP.utilisparasitism under both CO2concentrations, while there were differences with regard to the height, stem diameter, internodal distance and nutrient contents ofA.adenophorabetween two CO2concentrations. With the same parasitic intensity, the height, internodal distance and stem diameter ofA.adenophoraunder 800 μL/L CO2concentration increased 31.74%, 6.70% and 9.84%, respectively, comparing with those ofA.adenophoraplanting under 400 μL/L CO2concentration. Parasitism ofP.utilisunder 800 μL/L CO2concentration might lead to significantly decrease of free amino acids and starch content ofA.adenophora(P<0.01). The number of galls and F1emergence ofP.utilisadults under 800 μL/L CO2concentration were significantly lower than those ofP.utilisadults under 400 μL/L CO2concentration. The results indicated that the inhibitory effect ofP.utilisonA.adenophoramight be weakened under the doubled CO2concentration, which would provide theoretical evidence for predicting the control capability ofP.utilisparasitism onA.adenophoraunder the changing global climate.
CO2concentration;Ageratinaadenophora;Procecidocharesutilis; nutrient
可芮,岳英,李胜,等.CO2浓度倍增条件下泽兰实蝇寄生对紫茎泽兰生长和营养成分的影响[J].环境昆虫学报,2017,39(6):1281-1286.
Q968.1;S476
A
1674-0858(2017)06-1281-06
国家自然科学基金(31660546,31260450);国家重点研发计划“生物安全关键技术研发”重点专项(2016YFC1202100);云南省科技人才培养计划项目(2013HB072)
可芮,女,硕士研究生,研究方向为农业昆虫与害虫防治,E-mail:kerui106@126.com
*通讯作者Author for correspondence, E-mail: furonggui18@sina.com
Received: 2016-09-17; 接受日期Accepted: 2017-02-22
