天蒙山皇菊挥发油的化学成分SPME-GC-MC分析
2018-01-03陈文华郑晓文王飞张明燕徐凌川
陈文华,郑晓文,王飞,张明燕,徐凌川*
(1.山东中医药大学,山东 济南 250355;2.山东御华景宸生态农业发展有限公司,山东 临沂 276000)
【中药与天然活性产物】
天蒙山皇菊挥发油的化学成分SPME-GC-MC分析
陈文华1,郑晓文1,王飞2,张明燕2,徐凌川1*
(1.山东中医药大学,山东 济南 250355;2.山东御华景宸生态农业发展有限公司,山东 临沂 276000)
采用固相微萃取-气相色谱-质谱(SPME-GC-MS)联用技术,建立了快速简便、完全自动化鉴定天蒙山皇菊中挥发油的分析方法,以色谱峰面积归一化法分析各成分的相对质量分数。天蒙山皇菊挥发油共鉴定出57个化学成分,占挥发油色谱峰总面积的82.448%。主要化学成分及相对质量分数分别为1,8-桉树脑(12.44%)、右旋-樟脑(9.209%)、左旋-α-蒎烯(8.597%)、合成右旋龙脑(6.172%)、 β-水芹烯(5.642%)和乙酸龙脑酯(4.861%)。
固相微萃取-气相色谱-质谱;天蒙山皇菊;挥发油
皇菊是菊科植物菊(ChrysanthemummorifoliumRamat.)的干燥头状花序,又名黄菊,原产于江西婺源上晓起,有抗癌、益寿、驻颜之奇效[1]。据《神农本草经》记载, 皇菊性辛、甘、苦、寒,归肺、肝经,能疏散风热、清热解毒、平肝明目。主治风头眩、肿痛、目欲脱、泪出、恶风、湿痹。作为药食同源花卉,皇菊广泛地应用于医疗保健行业,具有滋养容颜、暖胃润肠、生津润喉、降压降脂、延年益寿的作用。
近年来有关皇菊的研究报道基本是局限在南方地区的繁殖栽培技术, 没有关于引种到北方的报道,关于皇菊挥发油的研究很少。南北方地理条件的差异,对皇菊的生长及各种营养成分的含量具有很大的影响。天蒙山皇菊是2014年从江西婺源引种栽培到山东临沂费县朱田镇的,该镇位于 118.2°E、35.4°N,属暖温带半湿润大陆季风气候,年均气温13.6 ℃,年均水面蒸发量857.9 mm,年均降水量819.3 mm,年均无霜期197 d。地貌特征是低山地、丘陵地和倾斜的山前平原,土壤有机质含量偏低、氮素不足、严重缺磷、普遍缺钾。目前,天蒙山皇菊生长优良,对环境适应能力良好。
天蒙山皇菊是天然富硒高锶的有机菊花,经检测硒含量43 μg/kg,锶含量3.8 mg/kg,总黄酮质量分数高达12%,均优于原产地的江西婺源皇菊[2]。目前,固相微萃取-气相色谱-质谱(SPME-GC-MS)联用技术已经广泛地应用于食品、茶叶、水果、蔬菜等挥发性物质的检测[3]。天蒙山皇菊的主要成分之一为挥发油,采用该技术对挥发油进行成分分析,方法简单、快速,能够避免温度或溶剂对挥发油成分的影响[4]。本文首次采用SPME-GC-MS联用技术,对不同地理环境、气候条件引种栽培到我国北方的天蒙山皇菊(栽培变种)挥发油化学成分进行分析测定,为天蒙山皇菊的进一步综合开发利用和药理活性的深入研究提供依据和技术支持。
1 仪器与材料
1.1 仪器
Agilent 7590A-5973N气相质谱联用仪(美国Agilent);手动固相微萃取(SPME) 装置(美国 Supelco);Stable Flex 复合萃取纤维头(50/30 μmDVB/CAR/PDMS(2 cm),美国Supelco);手动SPME进样器(美国 Supelco)。
1.2 材料
天蒙山皇菊于2016年10月下旬在晴朗、花瓣完全展开的盛花期采收,采收地点为山东御华景宸生态农业发展有限公司天蒙山菊花生产基地,经山东中医药大学药学院徐凌川教授鉴定为菊科植物皇菊ChrysanthemummorifoliumRamat.(栽培变种)。
2 方法与结果
2.1 仪器分析条件
2.1.1 气相色谱(GC)条件
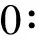
2.1.2 质谱(MS)条件
接口温度:200 ℃;EI离子源;离子源温度:230 ℃;电子轰击能量:70 eV;溶剂延迟2 min;采集方式:全扫描模式;扫描范围:m/z29~500。
2.1.3 GC-MS检测分析
将固相微萃取装置的萃取头插入气相色谱的进样口,200 ℃老化20 min,载气量1.0 mL/min。取3.0 g 过20目筛的天蒙山皇菊粉末加入到15 mL的顶空瓶中,密封后置于70 ℃水浴中40 min进行静态吸附。萃取头置于气相色谱仪进样口200 ℃进行解吸3 min,采集数据。
2.2 组分的测定
将天蒙山菊挥发油按照2.1的分析条件进行含量测定,经质谱扫描后得到质谱图,采用峰面积归一化法处理数据,确认化合物,计算在挥发油中各组分的相对质量分数[5]。
3 结果与分析
3.1 固相微萃取条件的研究
3.1.1 固相微萃取头的选择
按2.1.3的方法,在其他条件不变的情况下,分别用PDMS(100 μm)、PDMS(7 μm)、PA(85 μm)、DVB-CAR-PDMS(50/30 μm)萃取头萃取天蒙山皇菊挥发油组分数(表1)数据显示,以DVB-CAR-PDMS(50/30 μm)萃取头萃取的天蒙山皇菊挥发油组分数最多,为79种。因此,萃取天蒙山挥发油时选用此萃取头。

表1 固相微萃取头吸附挥发油组分数
3.1.2 萃取温度的选择
按2.1.3的方法,其他条件不变,分别在40、50、60、70、80、90 ℃温度条件下对天蒙山挥发油进行固相微萃取,经过GC-MS分析,计算各挥发油成分的总峰面积,结果如图1所示。当萃取温度低于70 ℃时,随着温度的升高,总峰面积也逐渐增高。而萃取温度高于70 ℃时,总峰面积反而逐渐下降,有可能是挥发油的成分性质在高温下不稳定,萃取温度过高而分解。因此,70 ℃为最适萃取温度。
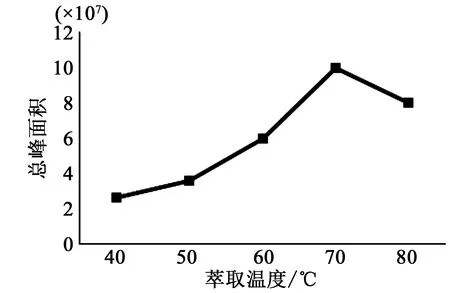
图1 萃取温度对天蒙山皇菊挥发油萃取效果的影响Fig.1 Effect ofextraction temperature on the extraction of aroma compounds from Tianmeng Mountain Imperial Chrysanthemum
3.1.3 萃取时间的选择
按2.1.3的方法,其他条件不变,分别在10、20、30、40、50 min进行天蒙山皇菊挥发油的固相微萃取,经过GC-MS分析,计算各挥发油成分的总峰面积,结果如图2所示。随着萃取时间的增加,挥发油的萃取量逐渐增大,30 min时峰面积达到最大,30 min后随着萃取时间延长,萃取量稍微减少。这说明当萃取时间为30 min时,天蒙山皇菊挥发油的吸附和解析达到了动态平衡。因此,30 min为最佳萃取时间。
3.1.4 解吸时间的选择
按2.1.3的方法,其他条件不变,分别在1、2、3、4 min进行天蒙山皇菊挥发油的固相微萃取,经过GC-MS分析,计算各挥发油成分的总峰面积,结果如图3所示。当解吸时间达到3或4 min时峰面积最大。因此,3 min为最佳解吸时间。
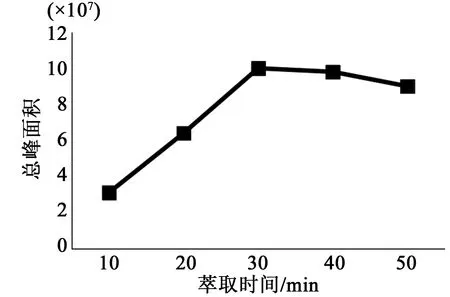
图2 萃取时间对天蒙山皇菊挥发油萃取效果的影响Fig.2 Effect ofextraction time on the extraction of aroma compounds from Tianmeng Mountain Imperial Chrysanthemum
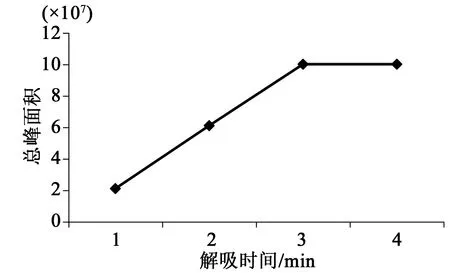
图3 解吸时间对天蒙山皇菊挥发油萃取效果的影响Fig.3 Effect of desorb time on the extraction of aroma compoundsfrom Tianmeng Mountain Imperial Chrysanthemum
3.2 挥发油成分分析
根据GC-MS检测分析,天蒙山皇菊挥发油总离子流图见图4,经过检索、解析及文献核对等综合分析,共鉴定出57个化学成分,占挥发油总色谱峰面积的82.448%。挥发油化学成分分析结果详见表2,挥发油化合物种类分析结果详见表3。
天蒙山皇菊主要成分烃类共22种,相对质量分数37.801%;其次是醇类共9种,23.613%;酮类共7种,11.394%;脂类共7种, 7.3415%;无氧化物类。主要化学成分是单萜、倍半萜等萜烯类化合物,其次是酮醛类、醇类,还有少量的脂类。在已鉴定出的挥发油成分中相对质量分数在5%以上的有1,8-桉树脑(12.44%)、右旋-樟脑(9.209%)、左旋-α-蒎烯(8.597%)、合成右旋龙脑(6.172%)、β-水芹烯(5.642%)。
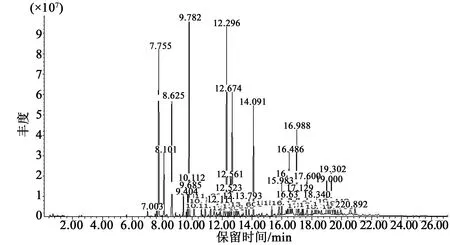
图4 天蒙山皇菊挥发油GC-MS总离子流图Fig.4 Total ion current GC-MS spectrogram of essential oil from Tianmeng Mountain Imperial Chrysanthemum
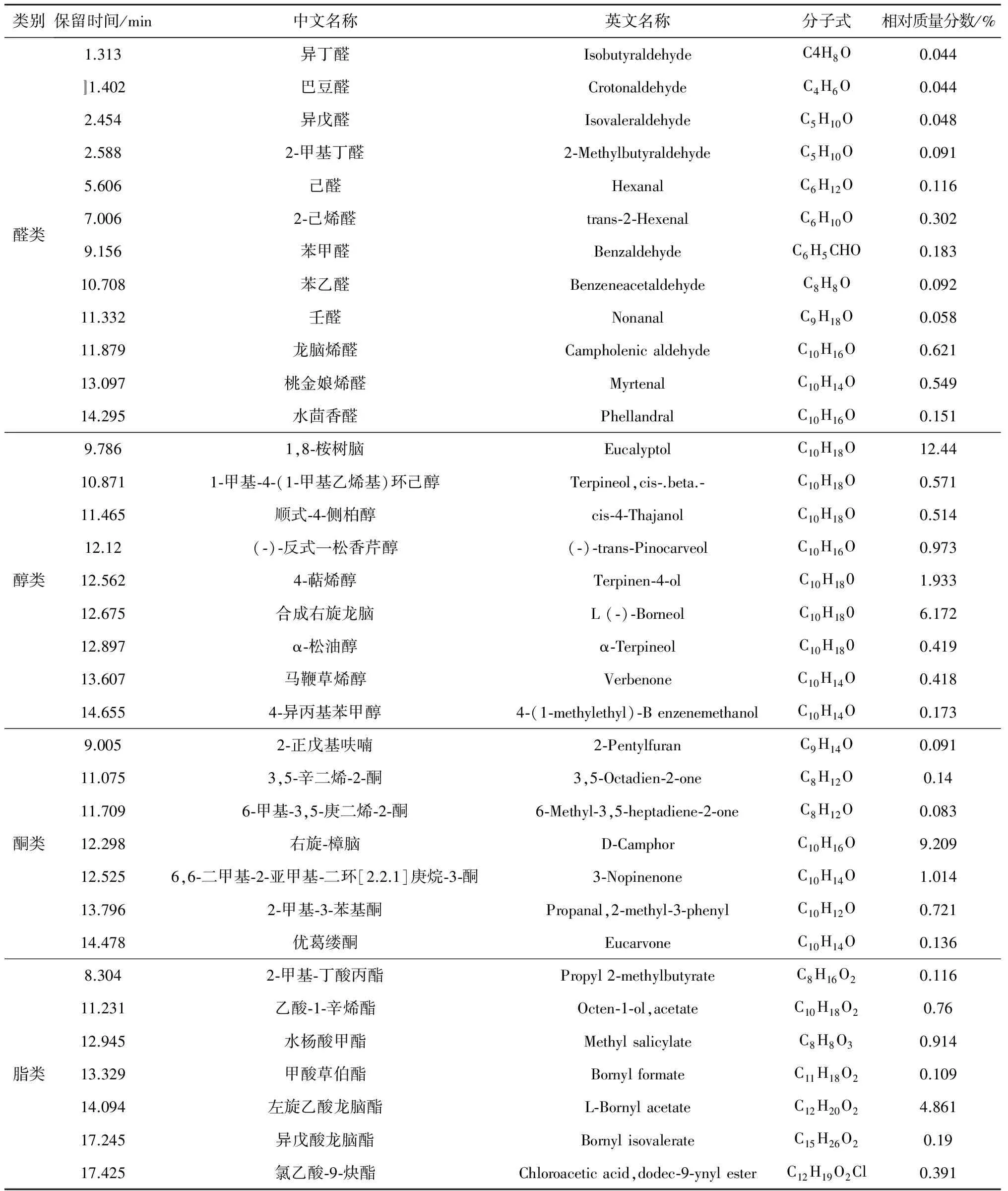
表2 天蒙山皇菊挥发油化学成分分析结果Table 2 Chemical composition analysis of essential oil from Tianmeng Mountain Imperial Chrysanthemum
续表2
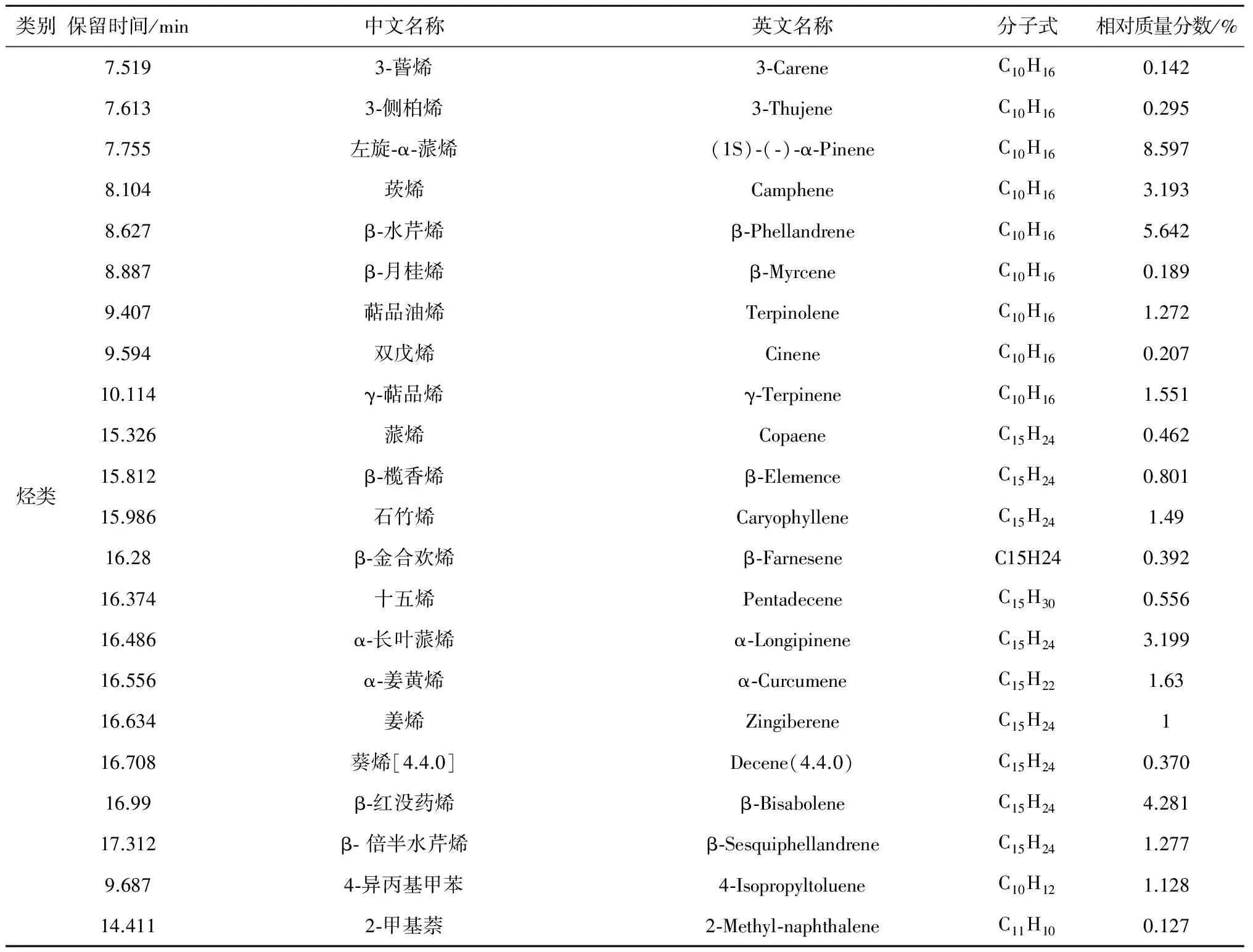
类别保留时间/min中文名称英文名称分子式相对质量分数/%烃类7.5193⁃蒈烯3⁃CareneC10H160.1427.6133⁃侧柏烯3⁃ThujeneC10H160.2957.755左旋⁃α⁃蒎烯(1S)⁃(⁃)⁃α⁃PineneC10H168.5978.104莰烯CampheneC10H163.1938.627β⁃水芹烯β⁃PhellandreneC10H165.6428.887β⁃月桂烯β⁃MyrceneC10H160.1899.407萜品油烯TerpinoleneC10H161.2729.594双戊烯CineneC10H160.20710.114γ⁃萜品烯γ⁃TerpineneC10H161.55115.326蒎烯CopaeneC15H240.46215.812β⁃榄香烯β⁃ElemenceC15H240.80115.986石竹烯CaryophylleneC15H241.4916.28β⁃金合欢烯β⁃FarneseneC15H240.39216.374十五烯PentadeceneC15H300.55616.486α⁃长叶蒎烯α⁃LongipineneC15H243.19916.556α⁃姜黄烯α⁃CurcumeneC15H221.6316.634姜烯ZingibereneC15H24116.708葵烯[4.4.0]Decene(4.4.0)C15H240.37016.99β⁃红没药烯β⁃BisaboleneC15H244.28117.312β⁃倍半水芹烯β⁃SesquiphellandreneC15H241.2779.6874⁃异丙基甲苯4⁃IsopropyltolueneC10H121.12814.4112⁃甲基萘2⁃Methyl⁃naphthaleneC11H100.127

表3 天蒙山皇菊挥发油的类别汇总Table 3 Category of chemical components in essential oil from Tianmeng Mountain Imperial Chrysanthemum
4 结论与讨论
挥发油又称精油,是一种存在植物体内具有挥发性、芳香性的油状液体。因为地理环境、气候条件、采收季节等的差异,会造成皇菊挥发油的药用疗效差别[6]。研究发现皇菊在盛花期出油率最高[7],所以我们选择在花瓣完全开放的盛花期采收,测定天蒙山皇菊挥发油成分。
我们利用SPME-GC-MC技术在最优的固相微萃取条件下,对从江西婺源引种栽培到山东临沂的天蒙山皇菊挥发油成分进行分析。研究发现,天蒙山皇菊挥发油的主要化学成分为烃类共22种(相对质量分数37.801%),其次是醇类共9种(23.613%),酮类共7种(11.394%),脂类共7种(7.3415%),无氧化物类。而胡文杰等[7]用传统水蒸气蒸馏法测定婺源皇菊挥发油的主要成分为烃类共25种(55.47%),醇类共13种(23.70%),酮类仅2种(10.97%,脂类共3种(2.68%),氧化物2种(0.8%),无醛类。本文天蒙山皇菊挥发油鉴定出的57种成分和胡文杰等对婺源皇菊挥发油鉴定出的45种成分仅有14种成分完全相同,其中烃类11种:1,8-桉树脑、β-水芹烯、γ-萜品烯、β-榄香烯、β-金合欢烯、β-倍半水芹烯、莰烯、萜品油烯、3-蒈烯、α-姜黄烯、姜烯;醇类3种:1,8-桉树脑、4-萜烯醇、α-松油醇[7],这14种相同成分的相对质量分数约占挥发油总量的30%。天蒙山皇菊挥发油主要化学成分是1,8-桉树脑(12.44%)、右旋-樟脑(9.209%)、左旋-α-蒎烯(8.597%)、合成右旋龙脑(6.172%)、 β-水芹烯(5.642%)。婺源皇菊挥发油的主要化学成分是α-蒎烯(19.25%)、β-水芹烯(18.49%)、1,8-桉树脑(9.55%)、龙脑(8.82%)、左旋樟脑(6.40%)[7]。上述结果表明,天蒙山皇菊和婺源皇菊挥发油成分含量差别较大,分析可能因为不同产地、不同样品处理和检测方法造成的。
菊花挥发油有抑菌、抗肿瘤、镇痛、驱虫、抗病毒、抗焦虑、抗炎、神经保护和胃保护作用[8]。1,8-桉树脑不仅有抗癌、消炎、杀虫、抗菌、抗氧化、镇痛等药理作用,对哮喘等呼吸道疾病的治疗作用显著[9],还具有透皮渗透、脂溶性好等优点,广泛地应用于医疗、香料、工业等领域[10]。右旋-樟脑有杀虫止痒、消肿止痛、通窍、辟秽等功效[11],可以兴奋中枢神经系统,改善心血管系统。左旋-α-蒎烯作为原料被应用于手性医药中间体、植物保护及合成香料工业。 肿瘤、哮喘、心血管病都是常见疾病,随着生活质量的提高,这些疾病在人群中发病率越来越高。如今人们的保健养生意识越来越强烈,更多地选择食疗。菊花挥发油没有毒副作用,近年来还广泛地用于食品、药品、香料、化妆品等方面[12]。通过对挥发油含量和有效成分的分析,为具有天然活性的药食同源天蒙山皇菊进一步打入市场、进行综合开发利用提供了科学依据。
[1]烛微. 皇菊赋并序[J]. 农业考古,2011(2):303.
[2]刘玉珊,许震寰,刘静,等. 皇菊的有益成分含量及其可食用性分析[J]. 安徽农业科学,2014,42(31):10905-10906.
[3]刘春红. 固相微萃取技术及其在国内食品领域中的应用[J]. 生命科学仪器,2007,5(9): 3-8.
[4]李良,马莺,杨鑫. SPME-GC-MS测定稀奶油中的挥发性化合物[J]. 哈尔滨工业大学学报,2012,44(06):102-104.
[5]张世尧,王琦,徐凌川. 莳萝蒿挥发油化学成分分析[J]. 山东科学,2016,29(4):12-16.
[6]何小珍,蒋军辉,赵雷,等. 安徽野菊花挥发油化学成分分析[J]. 应用化工,2014,43(8):1536-1539.
[7]胡文杰,许樟润,鲁思情, 等. 皇菊花发育过程中挥发油化学成分及其抗氧化活性的研究[J]. 植物研究,2016,36(6):942-948.
[8]谢占芳. 八种菊花挥发性成分及其抑菌活性研究[D].开封:河南大学,2016
[9]张丽佳,薛银,张岑容, 等. 桉油精的抗菌抗炎作用研究[J]. 中国兽药杂志,2013,47(3):21-24.
[10]ZANT D, GUBLER D A. The presence of eucalyptol in Artemisia australis validates its use in traditional Hawaiian medicine[J]. Asian Pacific Journal of Tropical Biomedicine,2014,4(7):520-522.
[11]王文元,顾丽莉,吴志民.1,8-桉叶油素的研究进展[J].食品与药品,2007,9(2):56-59.
[12]尹小英, 李石蓉,李琴,等. 药用植物樟的研究概况[J]. 江西中医学院学报, 2009, 21(6): 87-89.
SPME-GC-MCanalysisofchemicalcomponentsofessentialoilfromTianmengMountainImperialChrysanthemum
CHENWen-hua1,ZHENGXiao-wen1,WANGFei2,ZHANGMing-yan2,XULing-chuan1*
(1.ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;2.ShandongYuhuaJingchenEcoagricultureDevelopmentCompany,Linyi276000,China)
∶Using solid-phase micro extraction-gas chromatography-mass spectrometry (SPME-GC-MS) technique, a rapid, simple and fully automated procedure was developed for the identification of essential oil from Tianmeng Mountain Imperial Chrysanthemum. The relative mass fraction of each component was calculated by the normalization method of chromatographic peak area. Fifty seven chemical components were identified in total, accounting for 82.448% of the total GC peak area of essential oil. The principal chemical constituents and their relative mass fractions were as follows: Eucalyptol (12.44%), D-Camphor(9.209%), (1S)-(-)-α-Pinene (8.597%), L(-)-Borneol (6.172%), β-Phellandrene(5.642%), L-Bornyl acetate (4.861%).
∶SPME-GC-MC; Tianmeng Mountain Imperial Chrysanthemum; essential oil
10.3976/j.issn.1002-4026.2017.06.003
2017-05-26
山东省中医药科技发展计划(2017-530);中医行业科研专项基金(201407002)
陈文华(1994—),女,硕士研究生,研究方向为中药质量控制与品质评价。
*通信作者,徐凌川(1962—),男,教授,研究方向为生药中药质量控制、资源开发利用及药用真菌研究与应用。E-mail:xulingchuan518@sina.com
R284.1
A
1002-4026(2017)06-0015-07
