发芽糙米中多糖提取工艺优化及抗氧化研究
2018-01-03张宇马永强刘晓飞王鑫孟庆虹卢淑雯
张宇,马永强,*,刘晓飞,,*,王鑫,孟庆虹,卢淑雯
(1.哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨150076;2.黑龙江省农业科学院博士后科研工作站,黑龙江哈尔滨150086)
发芽糙米中多糖提取工艺优化及抗氧化研究
张宇1,马永强1,*,刘晓飞1,2,*,王鑫1,孟庆虹2,卢淑雯2
(1.哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨150076;2.黑龙江省农业科学院博士后科研工作站,黑龙江哈尔滨150086)
以发芽糙米为原料,用超声波辅助复合酶的方法提取发芽糙米中的多糖类物质,以发芽糙米多糖得率为指标进行单因素试验,并通过响应曲面试验确定超声波辅助复合酶法提取发芽糙米多糖的最佳工艺条件,通过测定DPPH自由基、超氧阴离子和羟基自由基的清除能力,检测提取的多糖抗氧化活性。结果表明:复合酶(木瓜蛋白酶∶纤维素酶:果胶酶的添加质量比例为4∶3∶2)的酶解pH值为6,酶解时间2.5 h,酶解温度为50℃,酶添加量为1.5%,此条件下多糖得率为37.58%。抗氧化性研究发现发芽糙米多糖对DPPH自由基和超氧阴离子,羟基自由基都具有较强的抗氧化作用。
发芽糙米;多糖;超声波;复合酶法;响应曲面法;抗氧化性
糙米是稻谷脱去外保护皮层稻壳后的颖果,由米糠层、胚芽、胚乳组成,在米糠层和胚芽中含有很多营养成分。糖类、脂肪、蛋白质、纤维、维生素和矿物质等是其主要营养成分,糙米被视为一种绿色的健康食品。但由于糙米吸水困难、蒸煮时间较长导致米饭的口感差、糠味较重、咀嚼困难、不易消化,贮存期短,直接食用受到限制[4]。发芽糙米与糙米相比,其生理活性具有明显的优势。糙米发芽后,组织软化,炊煮方便,米中蛋白质和淀粉被降解,使糙米的感官性能和风味得以改善,而且在保留了丰富的维生素、矿物质、膳食纤维营养成分的同时,更是产生了多种具有促进人体健康和防治疾病的成分,如γ-氨基丁酸、六磷酸肌醇等,营养成分大大提高,发芽糙米也是一种比糙米更好的预防糖尿病及其并发症的食物。发芽糙米中有更多的人体所需营养成分和生理活性成分种类,具有明显的生理活性优势[5],因此需要更深入研究。
将超声法和复合酶法这两种方法结合起来,对糙米多糖提取工艺进行研究,通过超声使复合酶的活性得到提高,从而使破壁率得到提高;通过超声还可以使传质过程得到强化,有利于多糖的溶解,使多糖得率得到大幅提升,旨在获得一个得率高、品质好的发芽糙米多糖提取条件[6-7],分别就多糖的提取和抗氧化性进行研究。利用正交试验确定提取发芽糙米多糖的方法的最佳条件,并测定多糖的抗氧化性。
1 材料与方法
1.1 材料与试剂
供试粳稻为“龙梗”:黑龙江伊春储粮厂;纤维素酶、木瓜蛋白酶、果胶酶:宁夏和氏璧生物技术有限公司;柠檬酸、磷酸氢二钠、3,5-二硝基水杨酸、苯酚、浓硫酸(均为分析纯):北京博奥拓达科技有限公司。
1.2 仪器与设备
超声波细胞粉碎仪(JY92-2D型):宁波新知生物科技股份有限公司;电热恒温水浴锅(HHS-12型):上海东星建材实验设备有限公司;紫外可见分光光度计(721E型):上海光谱仪器有限公司;电子分析天平(BS224S型):塞多利斯科学仪器有限公司;高速万能粉碎机(M288479型):北京东方德教育科技有限公司;台式高速离心机(TGL-16G-B型):闽南星科科学仪器有限公司。
1.3 发芽糙米多糖的制备及测定
1.3.1 发芽糙米多糖的制备
用龚谷机去除稻子外壳得到糙米,于4℃条件避光储藏。用浸泡-湿热法对糙米进行发芽前处理,浸泡3 h,当糙米发芽结束后,放入到80℃的恒温干燥箱中对发芽糙米进行30min的灭酶处理,然后再放在50℃的恒温干燥箱中对发芽糙米进行干燥,粉碎过筛(80目)备用。按料液体积比1∶30加入蒸馏水,100 W超声60min,再放入80℃水浴振荡箱中振荡4 h,离心过滤收集上清液,按体积比1∶3加入80%~85%的乙醇,放置24 h。离心,收集沉淀,冷冻干燥得发芽糙米粗多糖。
1.3.2 发芽糙米多糖的测定
采用苯酚-硫酸法[91]测定发芽糙米多糖的含量,制作葡萄糖标准曲线。将样品准确稀释合适的倍数,吸取2mL样品溶液,分别加入1mL的6%苯酚,5mL浓硫酸,490 nm下测量其吸光度值,代入葡萄糖标准曲线方程,计算糖含量。

1.4 超声波辅助复合酶法提取发芽糙米多糖的条件优化
取发芽糙米5.0 g,加入柠檬酸-磷酸氢二钠缓冲溶液,料液体积比1∶15,超声波超声30min,超声温度50℃,冷却至室温后,复合酶法提取多糖,添加复合酶(木瓜蛋白酶∶纤维素酶∶果胶酶的添加质量比例为4 ∶3 ∶2)[8],单因素选择酶解 pH(5.0、5.5、6.0、6.5、7.0),酶解温度(40、45、50、55、60 ℃),酶解时间(1.0、1.5、2.0、2.5、3.0 h),酶添加量(0.5%、1%、1.5%、2%、2.5%)[9-10]。
1.5 响应面试验设计
以酶解温度、酶解时间、酶解pH值、酶的添加量为变量,多糖得率为指标,进行响应曲面试验[11-12],试验因素水平编码见表1。
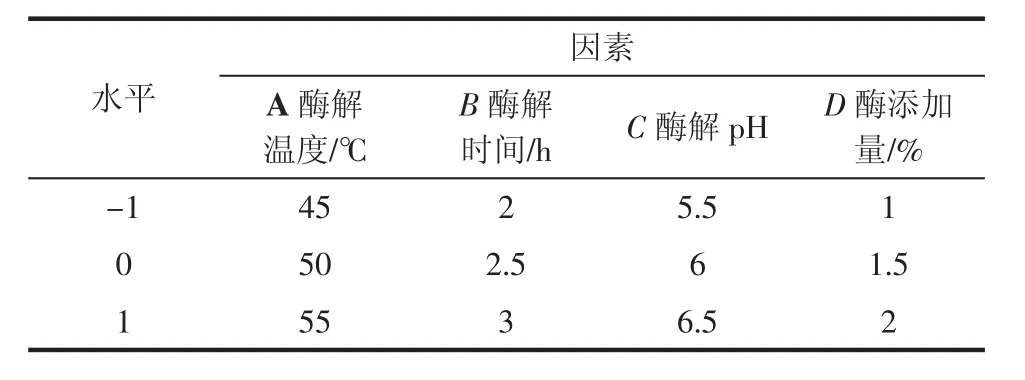
表1 水平试验因素表Table 1 The factor level table
1.6 发芽糙米多糖抗氧化性的测定
1.6.1 自由基清除能力的测定
将样品溶液稀释后用移液枪吸取100μL,加入2mL 0.2 mmol/L DPPH的乙醇溶液,缓慢摇晃使其混合均匀,室温条件下避光反应20min,在57 nm处测定吸光度,空白组是2mL DPPH和100 μL磷酸盐缓冲溶液的混合液的吸光度[13-14]。
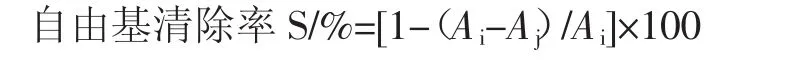
式中:Ai为样品吸光光度值;Aj为空白组吸光光度值。
1.6.2 超氧阴离子清除能力的测定
用移液枪吸取4.5mL pH8.2的50 mmol/L Tris-HCl缓冲溶液和3.2mL的双蒸水加入到10mL的试管中,缓慢摇晃试管使其混合均匀,吸取1mL不同浓度的样品溶液加入到试管中,吸取3 mmol/L的邻苯三酚溶液加入到另一支试管中,将两只试管置于25℃的恒温水浴箱中,水浴20min。再将0.3mL的浓度是3 mmol/L的邻苯三酚溶液快速加到混有待测样品的缓冲液中,空白管用10 mmol/L盐酸溶液调零,在325 nm波长下测定吸光度值,每隔30秒测一次,测定时间在300 s~360 s内的吸光度值,最后计算吸光度每分钟的增加值ΔAo。将各个吸光度值带入到公式中,求出不同浓度样品对超氧阴离子(O2-)的清除率[15]。
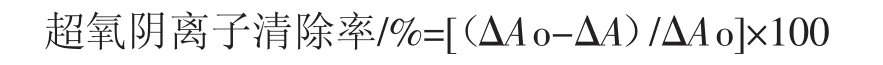
式中:ΔAo为样品吸光光度每分钟的增加值;ΔA为空白组吸光光度值每分钟的增加值。
1.6.3 羟自由基清除能力的测定
用移液枪吸取1mL 0.75 mmol/L的邻二氮菲溶液2mL pH为7.4的磷酸盐缓冲溶液和1mL双蒸水,振荡使其混合,再加入1mL 0.75 mmol/L的硫酸亚铁,再次振荡使其混合均匀,最后加入1mL 0.01%的过氧化氢溶液,在37℃条件下放置60min,在536 nm波长下测其吸光度,为损伤管的吸光值A(损);再用1mL蒸馏水代替1mL过氧化氢,测得吸光度为A(未);用不同浓度待测样品1mL代替1mL双蒸水测得吸光度为A(样),平行测定3次不同浓度的样品,分别记录吸光度值,求平均值。将所得的各个吸光度带入公式以下求出不同浓度样品对于羟基自由基(·OH)的清除率[16]。

2 结果与分析
2.1 标准曲线的试验
葡萄糖标准曲线的绘制:采用硫酸-苯酚法[17]测定葡萄糖在波长490 nm处的吸光度值,横坐标为吸光度值(x),葡萄糖浓度值(y)为纵坐标,得出葡萄糖标准曲线,结果见图1。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
如图1所示标准曲线线性回归方程为y=0.139 7x-0.144,拟合系数R2=0.998 4,表明葡萄糖含量与吸光度值呈良好的线性关系(在葡萄糖浓度0~0.05mg/mL范围内)。
2.2 超声波辅助复合酶法提取发芽糙米多糖的单因素影响结果
2.2.1 pH值对发芽糙米多糖提取率的影响
pH值对发芽糙米多糖提取率的影响如图2所示。
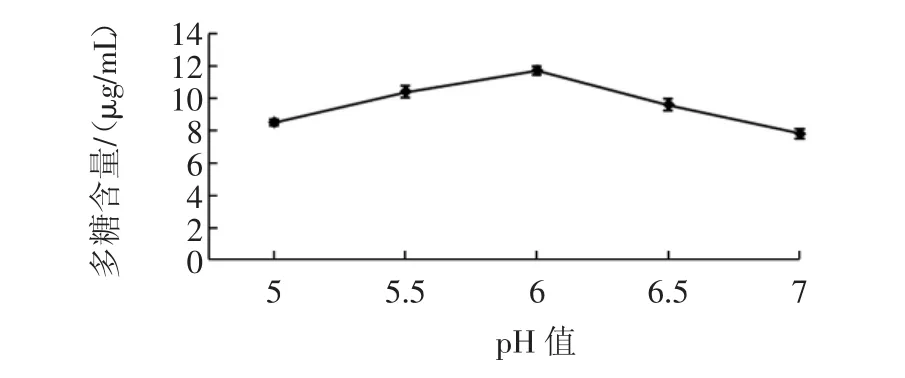
图2 pH值对多糖得率的影响Fig.2 Influence of pH on Polysaccharides Yield
pH值的大小和酶的活力之间存在着密切的关系,酶活性中心存在着三维构象,当pH值的大小适宜时,三维构象通过静电作用达到最佳状态,从而使酶与底物充分的接触[18]。同时pH值还会影响酶的催化速度[19]。在试验过程中,随着pH值的大小不断变大,提取的多糖含量也在不断变大,而当提取多糖的溶解达到平衡时,pH值的大小再次变大,开始减弱了酶的催化速度,从而提取的多糖含量便开始呈下降的趋向,在pH值为6时是发芽糙米多糖得率的最适宜值。
2.2.2 时间对发芽糙米多糖得率的影响
酶解时间对发芽糙米多糖得率的影响如图3所示。

图3 酶解时间对多糖得率的影响Fig.3 Influence of enzymolysis time on polysaccharides yield
提取时间影响着酶解的进行程度,如果酶解提取时间太少,酶解反应进行的就会不是很充分,当溶解达到平衡时,增加酶促反应的时间没有很明显的提高多糖提取得率[20]。在超声波辅助下,不同酶解时间条件下的多糖得率,试验过程中多糖的得率随着提取时间的不断增加而增加,在2.5 h左右多糖得率最大,如果再增加提取时间,提取率反而呈下降趋势。从操作费用方面进行来看如果提取的时间过长会拖延整个生产周期,操作费用增多,导致多糖水解,所以多糖提取的最佳时间为150min。
2.2.3 温度对发芽糙米多糖得率的影响
酶解温度对多糖得率的影响如图4所示。

图4 温度对多糖得率的影响Fig.4 Influence of enzymolysis temperature on polysaccharide yield
温度对酶催化反应有着极为重要的影响,温度不仅影响了酶的活性,还影响着溶解度、组织细胞等[21]。在一定的温度范畴里,提升温度,多糖的溶解度也随之变大,减弱了提取液的黏度,增大了溶剂的扩散速率、也增大了多糖固体成分的破碎程度。当超过了最适温度,过高的温度破坏了酶蛋白质,使其变性,从而使酶活力不断降低直到失活。随着温度的不断升高,酶解速度也会逐渐变慢[22]。
一定范围内,随着酶解温度的不断变大,多糖的得率也变大,而当提取的多糖达到溶解平衡,组织细胞内外浓度也达到平衡时,多糖的得率也呈下降的趋向,这是由于当温度超过最适温度,酶活会变弱,因此50℃为发芽糙米多糖得率的最佳提取温度。
2.2.4 酶添加量对发芽糙米多糖提取率的影响
不同复合酶添加量条件下的糙米多糖得率结果如图5所示。

图5 酶添加量对多糖得率的影响Fig.5 Influence of enzyme addition on polysaccharides yield
在一定的范围内,随着酶的添加量的增大,增大了酶和底物接触的机会,在相同的时间里增大了水解的分子数量[23],使多糖能快速地分离出来从而使提取效率升高,当复合酶用量过大时,过于饱和,一部分酶,无法与底物接触,减弱了水解底物的速度,使多糖得率变低,增加操作成本[24]。因此,需要找到最佳的酶添加量。
多糖得率随着酶添加量的增加而上升,随着酶添加量的增多,多糖的得率也会上升;当酶添加量为1.5%时,多糖得率达到最高值;当添加酶的量多于1.5%时,酶的添加量继续变大,多糖的得率随之变小,也许是因为此时酶用量达到了饱和。因此,选择复合酶添加量为1.5%。
2.3 响应曲面优化结果
2.3.1 响应曲面优化试验结果
根据上述单因素实验的结果,对酶解温度(A)、酶解时间(B)、pH 值(C)和酶添加量(D)采用统计软件Design-expert8.0.6建立四因素三水平的响应分析试验,试验设计与结果见表2。
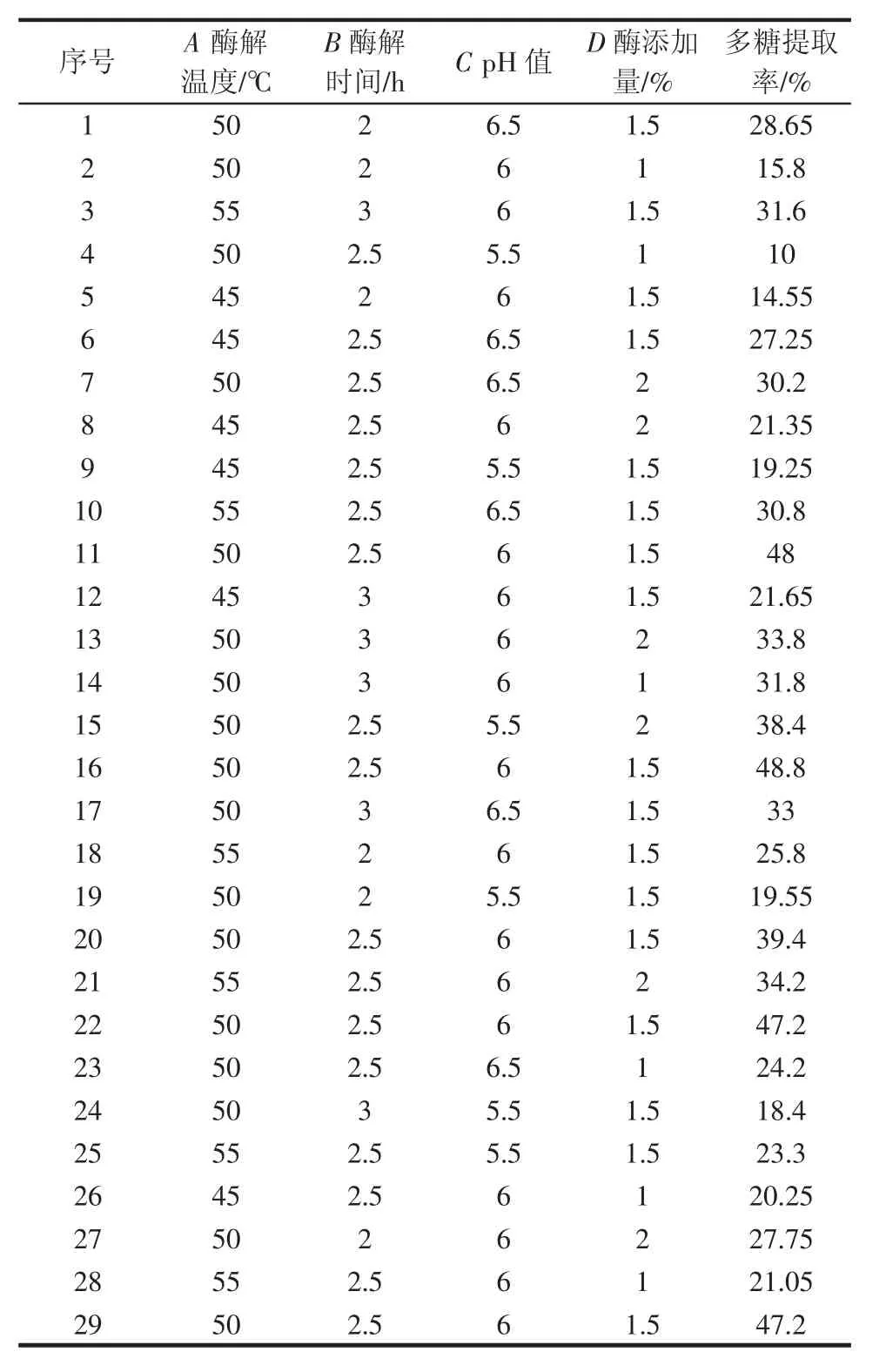
表2 试验设计与结果表Table 2 Experimental design and results
并利用Design Expert软件对表2数据进行二次多元回归拟合,得到发芽糙米多糖提取率(y)对编码自变量A、B、C和D的二次多项回归方程:
y=48.12+5.12A+2.35B+4.18C+7.22D-0.32AB+1.12AC+1.51AD+1.38BC+0.012BD-5.6CD-12.45A2-12.17B2-10.21C2-12.11D2
由该模型的方差分析表3可知:该试验选用的模型极显著(P<0.000 1),方差的失拟项不显著(P=0.100 4>0.05),说明模型的选择是合适的;在此试验设计中,B、AB 项显著(P<0.05),A、C、D、CD、AC、AD、BC、BD、A2、B2、C2、D2项均为极显著(P<0.01)。

表3 回归模型方差分析表Table 3 Analysis of variance for regression equation
2.3.2 响应面交互作用分析与最佳提取条件的确定
如图6所示,通过对6个响应曲面和6个等高线图的分析可以预测和检验变量的响应值和确定变量之间的关系[25],如果响应曲面越陡则各因素之间具有越显著的交互作用。分析等高线图也可判断交互作用的强弱,椭圆形表示交互作用显著,而圆形则表示交互作用不明显[26]。通过响应曲面发现,酶解温度、酶解pH值和酶添加量对发芽糙米多糖提取率的影响都最大,酶解时间对发芽糙米多糖提取率的影响稍弱,这与方差分析结果一致。通过Design-Expert 7.5软件分析,获得发芽糙米多糖的最佳提取条件:酶解温度为50℃、酶解时间为2.5 h、酶解pH值为6、酶添加量为1.5%。在此条件下,发芽糙米多糖的提取率最高,提取率的预测值为38.14%,在此条件下做验证试验(做3个平行试验),得到实际粗多糖的平均提取率为37.58%;与理论预测值相比相差不显著,说明模型可以较好地反映出发芽糙米多糖提取的条件。




图6 各因素交互作用的响应面与等高线图Fig.6 Response surface and contour plots showing the effect of different extraction parameters on the yield of polysaccharide
2.4 发芽糙米多糖抗氧化性测定结果
2.4.1 DPPH法测定发芽糙米多糖抗氧化性的变化
多糖浓度与DPPH自由基清除的关系如图7所示。

图7 多糖对DPPH自由基的清除率Fig.7 DPPH free radical-scavenging effect of polysaccharides
由图7可知,抗氧化能力随多糖浓度升高逐渐增强,这是由于多糖类化合物的抗氧化作用。在研究中多糖浓度为0.6mg/mL时,DPPH自由基清除率最高,达到95.85%,基本达到DPPH自由基清除率的最高值,抗氧化性最强[27-28]。
2.4.2 邻苯三酚自氧化法测定发芽糙米多糖抗氧化性的变化
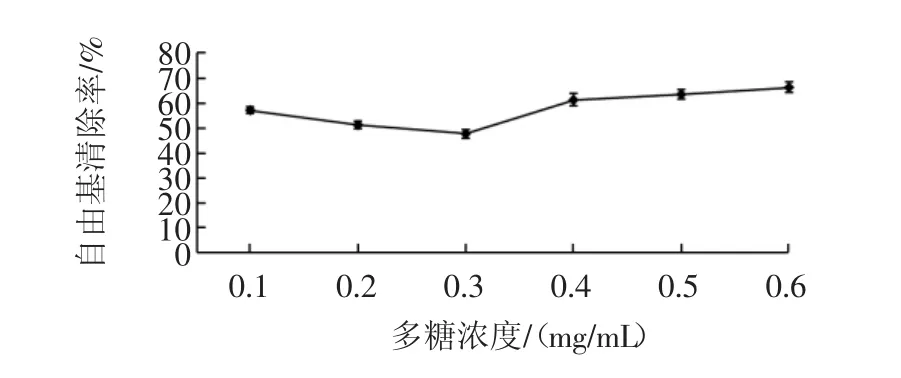
图8 多糖对O2-自由基的清除作用Fig.8 Scavenging capacity of polysaccharides on superoxide anion free radicals
多糖浓度与O2-自由基清除的关系如图8所示。由图8可知,多糖含量越高,其对O2-自由基清除作用越强,因此抗氧化能力随多糖浓度升高逐渐增强,多糖浓度为0.6mg/mL时,超氧阴离子自由基清除率最高,达到66.67%,基本达到超氧阴离子自由基清除率的最高值,抗氧化性最强。
2.4.3 邻二氮菲法测定发芽糙米多糖抗氧化性的变化多糖浓度与羟基自由基清除的关系如图9所示。

图9 多糖羟自由基清除能力Fig.9 Hydroxyl radical scavenging capacities of polysaccharide
由图9可知,多糖的浓度对羟基自由基的清除不太稳定,其与多糖浓度并不成正相关。在本试验中,多糖浓度0.1mg/mL~0.5mg/mL葡萄糖浓度为0.5mg/mL时,羟基自由基清除率最高,达到53.35%,抗氧化性最强。
3 结论
通过超声波辅助复合酶法对发芽糙米中的多糖类物质进行提取,对影响多糖得率的因素进行了单因素试验,通过响应曲面试验确定超声波辅助复合酶法提取发芽糙米多糖的最佳工艺条件为:复合酶的酶解pH值为6,酶解时间2.5 h,酶解温度为50℃,酶添加量为1.5%,此条件下多糖得率为37.58%。
利用发芽糙米多糖检测DPPH自由基、超氧阴离子和羟基自由基的清除能力。结果表明:多糖浓度为0.6mg/mL时,对DPPH自由基清除率达到了95.85%;对超氧阴离子自由基清除率达到了66.67%;对羟基自由基清除率最高了达到53.35%。这些结果说明糙米中多糖对DPPH自由基和超氧阴离子,羟基自由基均有较强的抗氧化作用。
[1]岳贤田.微波辅助提取香蕉皮中果胶的研究[J].粮油加工,2010(10):145-147
[2]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125
[3]王浩,沉文忠,欧爱武,等.罗汉果多糖的抗病毒活性研究[J].营养学报,2007,29(3):271-275
[4]Skeie G,Braaten T,Olsen A,et al.Whole grainintake and survival amongscandinavian colorectal cancerpatients[J].Nutrition and Cancer,2014,66(1):6-13
[5]高雅,张春红,韩艳秋,等.糙米的营养价值及加工利用现状[J].农业科技与装备,2013(2):56-58
[6]吴凤凤.发芽对糙米主要营养成分、生理功效和加工特性的影响[D].无锡:江南大学,2013:1-17
[7]孙海涛,邵信儒,夏光辉,等.超声辅助酶法提取玉米须多糖[J].食品研究与开发,2010(2):1-4
[8]马永强,张静,王鑫,等.酶法提取甜玉米芯多糖的对比研究[J].哈尔滨商业大学学报,2015(4):162-165
[9]贾富国,兰海鹏,左彦军,等.糙米二次加湿调质工艺优化与试验[J].农业机械学报,2010(5):95-98
[10]薛丹,黄豆豆,黄光辉,等.植物多糖提取分离纯化的研究进展[J].中药材,2014,37(1):157-161
[11]宋怀恩,闻韧.抗氧化剂筛选方法的研究进展[J].中国药物化学杂志,2003,13(2):119-124
[12]翁新楚,吴侯.抗氧化剂的抗氧化活性的测定方法及其评价[J].中国油脂,2000,25(6):119-122
[13]王笑晴.基于DPPH自由基清除能力的姜黄提取物抗氧化活性评价[J].药物评价研究,2011(5):360-364
[14]陈丛瑾,黄克瀛,李德良,等.香椿叶总黄酮的超声波辅助提取及其清除DPPH自由基能力的研究[J].食品与机械,2007(1):76-80
[15]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009(6):159-163
[16]杨明琰,张晓琦,沈俭,等.超氧化物歧化酶两种邻苯三酚自氧化测定活力方法的比较[J].微生物学志,2006,26(3):40-42
[17]Ross K A,Godfrey D,Fukumoto L.Purification and Characterization of Water Soluble Polysaccharides from Sweet Cherries,Raspberries,and Ginseng:Chemical Composition and Bioactivity[J].Research in Health and Nutrition,2015,29(3):1-13
[18]吴叶莲,肖春玲.酶解法提取黑米多糖的研究[J].食品研究与开发,2015(6):38-41
[19]贯云娜,吴昊,杨绍兰,等.超声复合酶法提取大蒜多糖的工艺优化[J].食品与机械,2014(1):199-204
[20]杨新生,姜忠丽.枸杞多糖的超声波辅助提取法及其抗氧化研究[J].食品研究与开发,2016(10):73-77
[21]吴建中.大豆蛋白的酶法水解及产物抗氧化活性的研究[D].广州:华南理工大学,2003:1-11
[22]CAROLINE M,RIEDERER M.Plant surface properties in chemical ecology[J].J Chem Ecology,2005,31(11):2621-2651
[23]Kurda F,Samavatib V.Water soluble polysaccharides from Spirulina platensis:Extraction and in-vitro anti-cancer activity[J].Interna-tional Journal of Biological Macromolecules,2015,74:498-506
[24]李贵荣.枸杞多糖的提取及其对活性氧自由基的清除作用[J].中国现代应用药学,2002(2):94-96
[25]马艳弘,刘晨,张宏志,等.响应面法优化芦荟皮多糖的微波辅助提取工艺及抗氧化活性研究[J].江西农业大学学报,2015,37(1):149-156
[26]李燕,王晓丽,俞飞锋.响应曲面法优化超声辅助提取芦荟凝胶多糖的工艺[J].食品研究与开发,2010,31(6):17-21
[27]谭萍,方玉梅,王毅红,等.苦荞麦多糖的抗氧化作用[J].食品研究与开发,2011(4):5-8
[28]梁鹏,甄润英.辣木茎叶中水溶性多糖的提取及抗氧化活性的研究[J].食品研究与开发,2013(14):25-29
Optimization of Extraction Process and Antioxidant Activity of Polysaccharide in Germinated Brown Rice
ZHANG Yu1,MA Yong-qiang1,*,LIU Xiao-fei1,2,*,WANG Xin1,MENG Qing-hong2,LU Shu-wen2
(1.College of Food Engineering,Harbin University of Commerce,Key Laboratory for Food Science and Engineering in Heilongjiang College and University,Harbin 150076,Heilongjiang,China;2.Heilongjiang Academy of Agricultural Sciences Postdoctoral Programme,Harbin 150086,Heilongjiang,China)
The germinated brown rice is the raw material,extract polysaccharides from brown rice germination by ultrasonic assisted method of compound enzyme,the germinated brown rice yield of polysaccharide was the index of single factor experiment,and through the response surface experiment to determine the optimum conditions.Meanwhile,the anti-oxidative activity of polysaccharides were detected.The results showed that the optimal ultrasonic-assisted extraction parameters were composite enzyme of (papaya protease,cellulase,pectinase adding quantity proportion for 4 ∶3 ∶2)at 1.5%dosage for 2.5 h at pH 6 and 50 ℃.Under such conditions,the maximum yield of polysaccharides from the germinated brown rice was 37.58%.The polysaccharide of germinated brown rice had strong clearance power to OH-,O2-and DPPH free radicals.
germinated brown rice;polysaccharides;ultrasound;enzyme complex method;response surface method;antioxidant activity
张宇,马永强,刘晓飞,等.发芽糙米中多糖提取工艺优化及抗氧化研究[J].食品研究与开发,2018,39(1):30-37
ZHANG Yu,MA Yongqiang,LIU Xiaofei,et al.Optimization of Extraction Process and Antioxidant Activity of Polysaccharide in Germinated Brown Rice[J].Food Research and Development,2018,39(1):30-37
10.3969/j.issn.1005-6521.2018.01.007
哈尔滨商业大学校级科研项目(17XN023)
张宇(1992—),男(汉),在读硕士研究生,农产品加工及贮藏工程专业。
*通信作者:马永强(1963—),男,教授,博士生导师,研究方向:农产品加工与利用;刘晓飞(1980—),女,副教授,博士,研究方向:天然产物。
2017-10-16
