猪群感染圆环病毒3型病例的诊断和病毒鉴定
2018-01-03贺东生苏丹萍梁伟放李锦辉
贺东生,俞 丽,苏丹萍,梁伟放,李锦辉
(华南农业大学兽医学院,广东 广州 510642)
猪群感染圆环病毒3型病例的诊断和病毒鉴定
贺东生,俞 丽,苏丹萍,梁伟放,李锦辉
(华南农业大学兽医学院,广东 广州 510642)
2017年8月,华南某猪场保育猪出现慢性消瘦和呼吸道综合征的病猪。经实验室PCR诊断,排除猪繁殖与呼吸综合征病毒(PRRSV)和猪圆环病毒2型(PCV2)后显示为猪圆环病毒3型(PCV3) 阳性。采用特异性CAP 段基因引物扩增该片段,使用DNAMAN7.0 和MEGA6.06 软件进行同源性分析。结果,成功克隆了该病毒的CAP段基因,序列长度为 671 bp,并进行基因测序和遗传进化分析。序列同源性分析表明该毒株为PCV3,命名为PCV3/CN/Guangzhou/2017。
猪;PCR鉴定;PCV3;CAP段基因;序列分析
PCV是目前报道的动物病毒中最小的无囊膜DNA病毒。成熟的病毒粒子由60个核衣壳蛋白质(capsid protein,Cap)亚基组装成为一个直径为17~20 nm 的正二十面体的球形颗粒,病毒的基因组包裹于其中,由1 767~1 768 碱基组成的单链环形DNA[1-2],编码两个主要的开放阅读框(open reading frames,ORFs):CAP 和 REP( 病 毒 复制相关的酶)[3]。CAP是 PCV 唯一的结构蛋白质和主要抗原,由 232~234个氨基酸残基组成,相对分子质量约为27 ku[4-5]。2016年 10月,美国 Kansas 州立大学的 R.Palinski 等和加州大学San Francisco 分校 T.G.Phan等几乎在同一时间报道一个新的PCV 基因型,又称为 PCV3[6-7]。该病毒从出现病症的母猪或仔猪中分离得到,同时PCV2检测为阴性。基因组序列分析发现,PCV3基因组包含2 000碱基,具有与 PCV1和PVC2相似的基因组结构,主要编码CAP和REP两个基因。在CAP 和REP 基因5′端包含有一个由 9个碱基(TAGTATTAC) 组成的stem loop结构,其碱基组成与 PCV1 的stem loop序列完全一致。PCV3 CAP基因编码 214个氨基酸残基,较PCV2 CAP少19~20个,此外,与 PCV2和鸭圆环病毒相比,其CAP 基因相似性仅为 36%~37%。PCV3 REP 基因编码 297氨基酸残基,与 GenBank数据库比较发现,该 REP蛋白质氨基酸与先前在美国报道的一株 PCV 毒株(GenBank accession 登录号:ADU77001)展现出较高的相似性(69.4%);与从我国分离到的蝙蝠圆环病毒的 REP 相似性为54%。此外,PCV3在其他国家和地区尚未见报道[8]。
1 材料与方法
1.1 病料
本研究检测的26份猪病料(心、脾、肺、肝和淋巴结)于2017年采自华南地区多个规模猪场的发病猪,病猪临床表现为慢性消瘦、多器官衰竭、食欲减退、精神不振,疑似为PCV2感染。将病料按1:3加入PBS缓冲液进行稀释研磨,6 000 g,4 ℃离心5 min,取上清,于-80 ℃冰箱储存备用。

表1 PCV3及PCV2引物序列

图1 PCV3 CAP基因PCR扩增结果
1.2 主要试剂
DNA Marker、dNTP、Taq酶等购自宝生物工程(大连)有限公司,pMD19-T载体、DH5α感受态细胞、DNA提取试剂盒、质粒提取试剂盒均购自Omega公司,DNA产物纯化试剂盒购自TaKaRa公司,溴化乙锭、氨苄青霉素、IPTG 为 Sigma公司产品;其余的化学试剂均是进口或者国产分析纯。引物合成、DNA测序由北京睿博兴科生物技术有限公司完成。
1.3 引物设计与合成
本实验室根据GenBank 所发布的序列号,选择全基因序列,运用Primer Premier5.0针对cap设计1对PCV3引物。其中,PCV2引物为本实验室他人所设计。由睿博兴科生物技术有限公司合成,引物序列见表1。
1.4 病毒核酸的提取
将病料离心后取出上清,按DNA试剂盒说明书提取病毒核酸,然后-20 ℃冰箱保存备用。
1.5 病毒的PCR 检测
以病毒DNA为模板进行PCR 扩增,反应体系为:10×PCR buffer 2.5μL,dNTP2.0μL, 上 下 游 引 物 各1.0μL,DNA 模 板 2μL,rTaq DNA 聚 合 酶 0.5μL,Rnase Free DH2O 16μL。PCR 扩增程序为:94 ℃预变性4 min ;94 ℃变性 30 s;55.4 ℃退火 30 s;72 ℃延伸 30 s;30个循环 ;72 ℃延伸 10 min ;4 ℃保存。取5μL PCR 扩增产物经2%琼脂糖凝胶电泳检测,CLINX凝胶成像系统拍照观察。
1.7 克隆测序
将阳性PCR 产物经纯化回收后与PMD-18T 载体连接,转化到大肠杆菌DH5α 感受态细胞中,培养后挑单个菌落进行PCR 鉴定,鉴定成功的重组质粒送往睿博兴科生物技术有限公司进行测序。
1.8 序列分析
将PCR 扩增获得的基因片段进行克隆、测序,利用DNAMAN7.0和MEGA6.06软件处理,与GenBank上已公布的PCV3毒株的基因序列进行同源性比对分析,并绘制系统进化树。
2 结果与分析
2.1 病料PCR 检测结果
以提取的DNA为模板,用PCV2和PCV3引物分别对样品进行检测。结果如图1所示,PCV2检测结果为阴性,PCV3 在671 bp左右有明显条带,检测结果为阳性。
由此说明该病毒为PCV3而非PCV2。将PCV3 CAP基因PCR产物纯化后构建至pMD-19T质粒并进行测序。
2.2 PCV3 CAP基因同源性分析
将测序结果在NCBI中进行BLAST,结果显示其与GeneBank中已发表序列同源性高达99.1%,由此进一步确定其为PCV3,将其命名为PCV3/CN/Guangzhou/2017。以GeneBank中已发表的13株PCV3毒株为参考(表2),进行PCV3 CAP基因同源性分析(图3)。结果显示, PCV3/CN/Guangzhou/2017 CAP基因核苷酸序列同源性为97.4%~99.1%:其中与中国已公布毒株相比核苷酸同源性为97.4%~98.9%;与意大利毒株相比核苷酸同源性为98.9%~99.1%;与美国毒株核苷酸同源性为97.7%~98.8%.该毒株与意大利毒株同源性最高,为99.1%,与中国安徽毒株同源性较低,为97.4%。
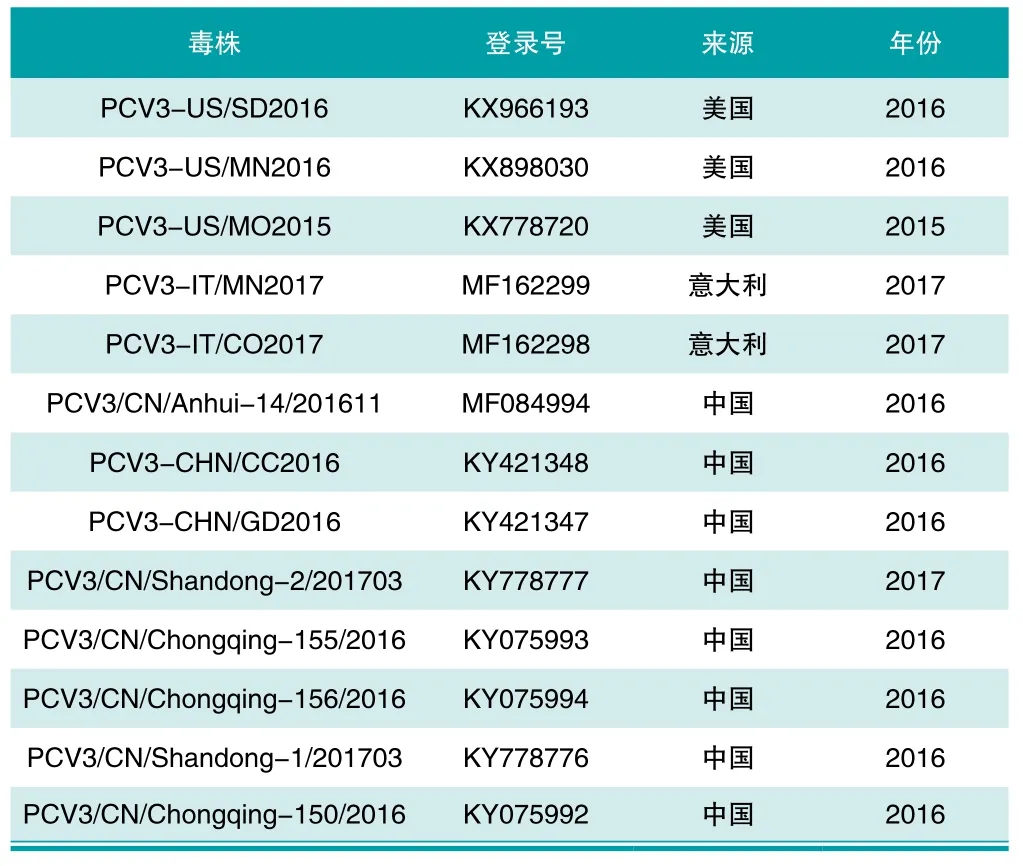
表2 Genebank已登录的pcv3参考毒株
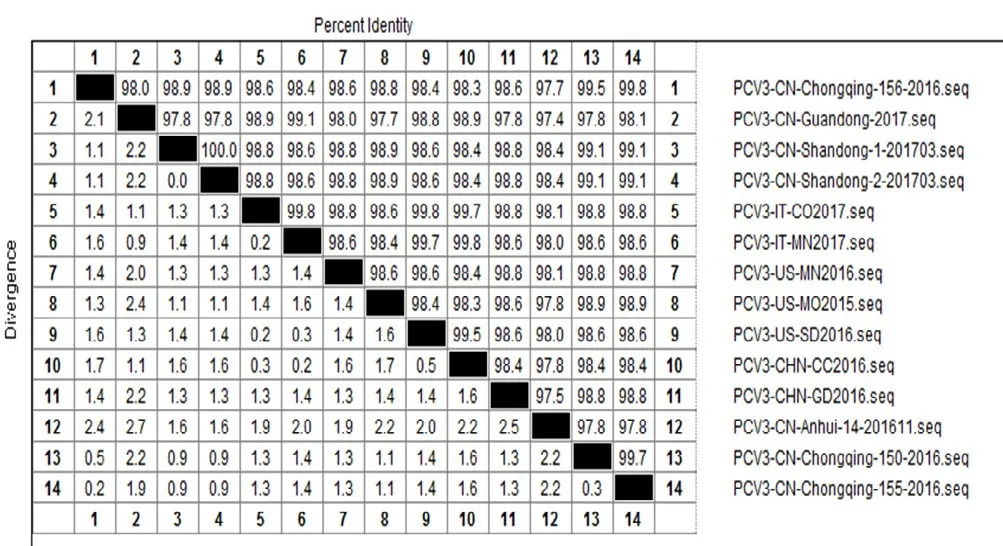
图3 基于PCV3/CN/Guangzhou/2017 CAP基因的序列同源性分析
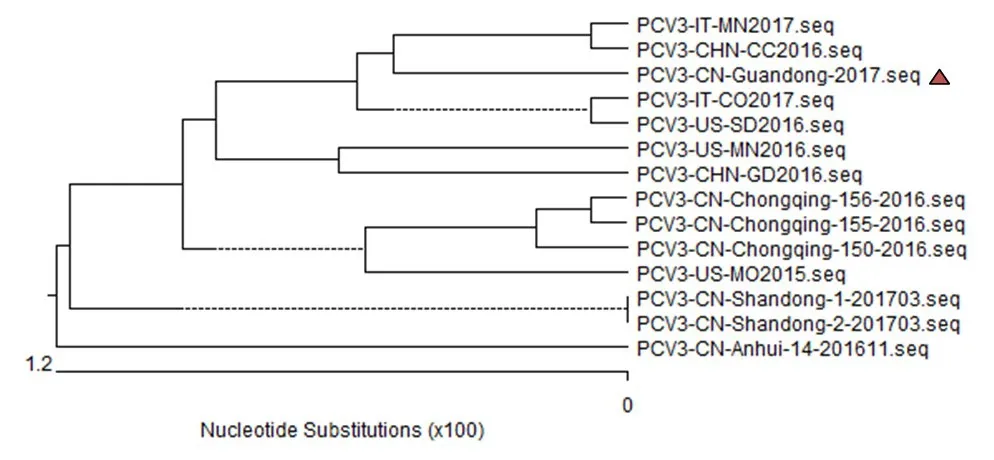
图4 基于PCV3/CN/Guangzhou/2017 CAP基因的遗传进化树
2.3 基于PCV3 CAP基因的遗传进化分析
以表2中13株毒株为参考,运用MEGA6.06软件采用Neighbor-Joining聚类分析方法构建基于CAP基因序列的进化树。如图4所示,PCV3/CN/Guangzhou/2017 CAP与意大利毒株亲缘关系较近,而与美国毒株较远。本次鉴定毒株与国内其他毒株虽然亲缘关系较近,但单独形成一个分支,说明该病毒是PCV3新成员。
3 讨论
本次鉴定出的PCV3/CN/Guangzhou/2017与其他毒株不在一个分支,表明在进化过程中极不保守,这种变异对疾病的防治和疫苗的研究增加了难度。该病毒PK-15细胞上进行增殖,但病变并不明显,需要借助间接免疫荧光等试验才能证明该病变在细胞中的增殖。因该病是猪场新病,对其认知比较有限,且发病率较高、传播快、猪场损失大,对猪场短期及长期的影响难以预估,需要进一步研究其传入源头、防控方法,做好防控方案。
致谢:本实验是在华南农业大学兽医学院、人兽共患病防控制剂国家地方联合工程实验室、农业部兽用疫苗创制重点实验室和广东省兽用生物制品技术研究与应用企业重点实验室完成。感谢广东省生猪产业体系创新团队基金的资助。
[1] TRIBLE B R,ROWLAND R R R.Genetic variation of porcine circovirus type 2 (pcv2) and its relevance to vaccination,pathogenesis and diagnosis[J].Virus Res,2012,164(1-2):68-77.
[2] SEGALES J,KEKARAINEN T,CORTEY M,The natural history of porcine circovirus type 2: from an inoffensive virus to a devaststing swine disease?[J].Vet Microbiol,2013,15(1-2):13-20.
[3] FAUREZ F, DORY D, GRASLAND B,et al. Replication of porcine circoviruses{J].Virol J,2009(6):60.
[4] HORLEN K P, DRITZ S S,NIETFELD J C,et al.A field evaluation of mortality rate and growth performance in pigs vaccinated against porcine circovirus type 2[J].j Am Vet Med Assoc,2008,232(6):906-912.
[5] POGRANICHNYY R M, YOON K J, HARMS P A,et al.Characterization of immune response of young pigs to porcine circovirus type 2 infection[J]. Viral Immunol,2000,13(2):143-153.
[6] PHANTG ,GIANNITTIF,ROSSOW S, et al.Detection of a novel circovirus PCV3 in pigs with cardiac and multisystemic inflammation[J]. Virol J,201,13:184.
[7] PALINSKI R, PINEYRO P, SHANG P C,et al.A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure[J].J Virol,2016,91(1):e01879-16.
[8] 湛洋,王东亮,王乃东,等.猪圆环病毒3型检测及其Cap结构序列和抗原性预测分析[J].畜牧兽医学报,2017,48(6):1076-1084.
2017-10-10)
